El músculo cardíaco (también llamado músculo cardíaco o miocardio ) es uno de los tres tipos de tejidos musculares de los vertebrados , los otros son el músculo esquelético y el músculo liso . Es un músculo estriado involuntario que constituye el tejido principal de la pared del corazón . El músculo cardíaco (miocardio) forma una capa intermedia gruesa entre la capa externa de la pared del corazón (el pericardio ) y la capa interna (el endocardio ), con sangre suministrada a través de la circulación coronaria . Está compuesto por células musculares cardíacas individuales unidas por discos intercalados , y revestidas por fibras de colágeno y otras sustancias que forman la matriz extracelular .
El músculo cardíaco se contrae de manera similar al músculo esquelético , aunque con algunas diferencias importantes. La estimulación eléctrica en forma de potencial de acción cardíaco desencadena la liberación de calcio del depósito interno de calcio de la célula, el retículo sarcoplásmico . El aumento de calcio hace que los miofilamentos de la célula se deslicen unos sobre otros en un proceso llamado acoplamiento excitación-contracción . Las enfermedades del músculo cardíaco conocidas como miocardiopatías son de gran importancia. Estas incluyen afecciones isquémicas causadas por un suministro restringido de sangre al músculo, como la angina de pecho y el infarto de miocardio .




El tejido muscular cardíaco o miocardio forma la mayor parte del corazón. La pared del corazón es una estructura de tres capas con una gruesa capa de miocardio intercalada entre el endocardio interno y el epicardio externo (también conocido como pericardio visceral). El endocardio interno recubre las cámaras cardíacas, cubre las válvulas cardíacas y se une al endotelio que recubre los vasos sanguíneos que se conectan al corazón. En el aspecto externo del miocardio se encuentra el epicardio , que forma parte del saco pericárdico que rodea, protege y lubrica el corazón. [1]
Dentro del miocardio, hay varias capas de células musculares cardíacas o cardiomiocitos. Las capas de músculo que envuelven el ventrículo izquierdo más cercanas al endocardio están orientadas perpendicularmente a las más cercanas al epicardio. Cuando estas capas se contraen de manera coordinada, permiten que el ventrículo se contraiga en varias direcciones simultáneamente: longitudinalmente (acortándose desde el ápice hasta la base), radialmente (estrechándose de lado a lado) y con un movimiento de torsión (similar a escurrir un paño húmedo) para exprimir la máxima cantidad posible de sangre del corazón con cada latido. [2]
La contracción del músculo cardíaco consume mucha energía y, por lo tanto, requiere un flujo constante de sangre para proporcionar oxígeno y nutrientes. La sangre llega al miocardio a través de las arterias coronarias , que se originan en la raíz aórtica y se encuentran en la superficie externa o epicárdica del corazón. Luego, la sangre es drenada por las venas coronarias hacia la aurícula derecha . [1]
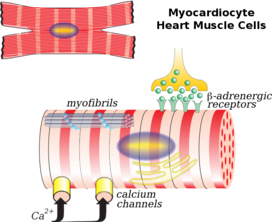
Las células del músculo cardíaco (también llamadas cardiomiocitos ) son los miocitos contráctiles del músculo cardíaco. Las células están rodeadas por una matriz extracelular producida por células de fibroblastos de soporte . Los cardiomiocitos modificados especializados, conocidos como células marcapasos , marcan el ritmo de las contracciones del corazón. Las células marcapasos son débilmente contráctiles sin sarcómeros y están conectadas a las células contráctiles vecinas a través de uniones comunicantes . [3] Se encuentran en el nódulo sinoauricular (el marcapasos primario) ubicado en la pared de la aurícula derecha , cerca de la entrada de la vena cava superior . [4] Otras células marcapasos se encuentran en el nódulo auriculoventricular (marcapasos secundario).
Las células marcapasos transportan los impulsos que son responsables del latido del corazón. Están distribuidas por todo el corazón y son responsables de varias funciones. En primer lugar, son responsables de poder generar y enviar espontáneamente impulsos eléctricos . También deben poder recibir y responder a los impulsos eléctricos del cerebro. Por último, deben poder transferir impulsos eléctricos de una célula a otra. [5] Las células marcapasos en el nódulo sinoauricular y el nódulo auriculoventricular son más pequeñas y conducen a una velocidad relativamente lenta entre las células. Las células conductoras especializadas en el haz de His y las fibras de Purkinje tienen un diámetro mayor y conducen señales a una velocidad rápida. [6]
Las fibras de Purkinje conducen rápidamente señales eléctricas: las arterias coronarias llevan nutrientes a las células musculares, y las venas y una red capilar eliminan los productos de desecho. [7]
Las células musculares cardíacas son las células que se contraen y que permiten que el corazón bombee. Cada cardiomiocito necesita contraerse en coordinación con sus células vecinas (lo que se conoce como sincitio funcional ) para bombear sangre de manera eficiente desde el corazón y, si esta coordinación falla, a pesar de que las células individuales se contraigan, el corazón puede dejar de bombear sangre, como puede ocurrir durante ritmos cardíacos anormales como la fibrilación ventricular . [8]
Vistas a través de un microscopio, las células del músculo cardíaco son aproximadamente rectangulares, midiendo 100–150μm por 30–40μm. [9] Las células musculares cardíacas individuales están unidas en sus extremos por discos intercalados para formar fibras largas. Cada célula contiene miofibrillas , fibras proteicas contráctiles especializadas de actina y miosina que se deslizan unas sobre otras. Estas están organizadas en sarcómeros , las unidades contráctiles fundamentales de las células musculares. La organización regular de las miofibrillas en sarcómeros da a las células musculares cardíacas una apariencia rayada o estriada cuando se observan a través de un microscopio, similar al músculo esquelético. Estas estrías son causadas por bandas I más claras compuestas principalmente de actina y bandas A más oscuras compuestas principalmente de miosina. [7]
Los cardiomiocitos contienen túbulos T , bolsas de membrana celular que van desde la superficie celular hasta el interior de la célula y que ayudan a mejorar la eficiencia de la contracción. La mayoría de estas células contienen solo un núcleo (algunas pueden tener dos núcleos centrales), a diferencia de las células del músculo esquelético que contienen muchos núcleos . Las células del músculo cardíaco contienen muchas mitocondrias que proporcionan la energía necesaria para la célula en forma de trifosfato de adenosina (ATP), lo que las hace muy resistentes a la fatiga. [9] [7]
Los túbulos T son tubos microscópicos que van desde la superficie celular hasta las profundidades de la célula. Son continuos con la membrana celular, están compuestos por la misma bicapa de fosfolípidos y están abiertos en la superficie celular al líquido extracelular que rodea la célula. Los túbulos T en el músculo cardíaco son más grandes y anchos que los del músculo esquelético , pero son menos numerosos. [9] En el centro de la célula se unen, y recorren la célula como una red transversal-axial. Dentro de la célula se encuentran cerca del depósito interno de calcio de la célula, el retículo sarcoplásmico . Aquí, un solo túbulo se empareja con una parte del retículo sarcoplásmico llamada cisterna terminal en una combinación conocida como diada . [10]
Las funciones de los túbulos T incluyen la transmisión rápida de impulsos eléctricos conocidos como potenciales de acción desde la superficie celular hasta el núcleo de la célula, y ayudar a regular la concentración de calcio dentro de la célula en un proceso conocido como acoplamiento excitación-contracción . [9] También están involucrados en la retroalimentación mecanoeléctrica, [11] como es evidente a partir del intercambio de contenido de los túbulos T inducido por la contracción celular (difusión asistida por advección), [12] que fue confirmado por observaciones de tomografía electrónica confocal y 3D. [13]

El sincitio cardíaco es una red de cardiomiocitos conectados por discos intercalados que permiten la transmisión rápida de impulsos eléctricos a través de la red, lo que permite que el sincitio actúe en una contracción coordinada del miocardio. Hay un sincitio auricular y un sincitio ventricular que están conectados por fibras de conexión cardíacas. [14] La resistencia eléctrica a través de los discos intercalados es muy baja, lo que permite la libre difusión de iones. La facilidad de movimiento de iones a lo largo de los ejes de las fibras musculares cardíacas es tal que los potenciales de acción pueden viajar de una célula muscular cardíaca a la siguiente, enfrentando solo una ligera resistencia. Cada sincitio obedece a la ley de todo o nada . [15]
Los discos intercalados son estructuras adherentes complejas que conectan los cardiomiocitos individuales a un sincitio electroquímico (en contraste con el músculo esquelético, que se convierte en un sincitio multicelular durante el desarrollo embrionario ). Los discos son responsables principalmente de la transmisión de fuerza durante la contracción muscular. Los discos intercalados constan de tres tipos diferentes de uniones célula-célula: las uniones de fascia adherente de anclaje de filamentos de actina, las uniones de desmosomas de anclaje de filamentos intermedios y las uniones gap . [16] Permiten que los potenciales de acción se propaguen entre las células cardíacas al permitir el paso de iones entre células, lo que produce la despolarización del músculo cardíaco. Los tres tipos de unión actúan juntos como una única área compuesta . [16] [17] [18] [19]
En el microscopio óptico , los discos intercalados aparecen como líneas delgadas, generalmente de color oscuro, que dividen las células musculares cardíacas adyacentes. Los discos intercalados corren perpendiculares a la dirección de las fibras musculares. En el microscopio electrónico, la trayectoria de un disco intercalado parece más compleja. A bajo aumento, esto puede aparecer como una estructura densa en electrones contorneada que se superpone a la ubicación de la línea Z oscurecida. A alto aumento, la trayectoria del disco intercalado parece aún más contorneada, con áreas tanto longitudinales como transversales que aparecen en la sección longitudinal. [20]
Los fibroblastos cardíacos son células de sostén vitales dentro del músculo cardíaco. No pueden proporcionar contracciones enérgicas como los cardiomiocitos , pero en cambio son en gran medida responsables de crear y mantener la matriz extracelular que rodea a los cardiomiocitos. [7] Los fibroblastos juegan un papel crucial en la respuesta a una lesión, como un infarto de miocardio . Después de una lesión, los fibroblastos pueden activarse y convertirse en miofibroblastos , células que muestran un comportamiento intermedio entre un fibroblasto (generando matriz extracelular) y una célula de músculo liso (capacidad de contraerse). En esta capacidad, los fibroblastos pueden reparar una lesión creando colágeno mientras se contraen suavemente para unir los bordes del área lesionada. [21]
Los fibroblastos son más pequeños pero más numerosos que los cardiomiocitos, y varios fibroblastos pueden unirse a un cardiomiocito a la vez. Cuando se unen a un cardiomiocito, pueden influir en las corrientes eléctricas que pasan a través de la membrana de la superficie de la célula muscular, y en el contexto se hace referencia a ellos como acoplados eléctricamente, [22] como se demostró originalmente in vitro en la década de 1960, [23] y finalmente se confirmó en el tejido cardíaco nativo con la ayuda de técnicas optogenéticas. [24] Otras funciones potenciales de los fibroblastos incluyen el aislamiento eléctrico del sistema de conducción cardíaca y la capacidad de transformarse en otros tipos de células, incluidos los cardiomiocitos y los adipocitos . [21]
La matriz extracelular (MEC) rodea al cardiomiocito y a los fibroblastos. La MEC está compuesta de proteínas, entre ellas colágeno y elastina, junto con polisacáridos (cadenas de azúcar) conocidos como glicosaminoglicanos . [7] En conjunto, estas sustancias dan soporte y fuerza a las células musculares, crean elasticidad en el músculo cardíaco y mantienen las células musculares hidratadas mediante la unión de moléculas de agua.
La matriz en contacto inmediato con las células musculares se denomina membrana basal y está compuesta principalmente de colágeno tipo IV y laminina . Los cardiomiocitos están unidos a la membrana basal a través de glicoproteínas especializadas llamadas integrinas . [25]
Los seres humanos nacen con un número determinado de células musculares cardíacas, o cardiomiocitos, que aumentan de tamaño a medida que el corazón se hace más grande durante el desarrollo infantil. La evidencia sugiere que los cardiomiocitos se renuevan lentamente durante el envejecimiento, pero menos del 50% de los cardiomiocitos presentes al nacer se reemplazan durante una vida normal. [26] El crecimiento de los cardiomiocitos individuales no solo ocurre durante el desarrollo normal del corazón, sino que también ocurre en respuesta al ejercicio extensivo ( síndrome del corazón atlético ), enfermedad cardíaca o lesión del músculo cardíaco, como después de un infarto de miocardio. Un cardiomiocito adulto sano tiene una forma cilíndrica de aproximadamente 100 μm de largo y 10-25 μm de diámetro. La hipertrofia de los cardiomiocitos ocurre a través de la sarcomerogénesis, la creación de nuevas unidades de sarcómeros en la célula. Durante la sobrecarga del volumen cardíaco, los cardiomiocitos crecen a través de una hipertrofia excéntrica. [27] Los cardiomiocitos se extienden longitudinalmente pero tienen el mismo diámetro, lo que resulta en dilatación ventricular. Durante la sobrecarga de presión cardíaca, los cardiomiocitos crecen a través de hipertrofia concéntrica. [27] Los cardiomiocitos crecen en diámetro pero tienen la misma longitud, lo que resulta en un engrosamiento de la pared del corazón.
La fisiología del músculo cardíaco comparte muchas similitudes con la del músculo esquelético . La función principal de ambos tipos de músculos es contraerse y, en ambos casos, la contracción comienza con un flujo característico de iones a través de la membrana celular conocido como potencial de acción . El potencial de acción cardíaco desencadena posteriormente la contracción muscular al aumentar la concentración de calcio en el citosol.
El ciclo cardíaco es el funcionamiento del corazón humano desde el inicio de un latido hasta el inicio del siguiente. Consta de dos períodos: uno durante el cual el músculo cardíaco se relaja y se vuelve a llenar de sangre, llamado diástole , seguido de un período de contracción y bombeo de sangre robusto, llamado sístole . Después de vaciarse, el corazón se relaja y se expande inmediatamente para recibir otro flujo de sangre que regresa de los pulmones y otros sistemas del cuerpo, antes de contraerse nuevamente para bombear sangre a los pulmones y esos sistemas. Un corazón que funciona normalmente debe expandirse por completo antes de poder bombear sangre de nuevo de manera eficiente.
La fase de reposo se considera polarizada. El potencial de reposo durante esta fase del latido separa los iones como el sodio, el potasio y el calcio. Las células del miocardio poseen la propiedad de automaticidad o despolarización espontánea . Esto es el resultado directo de una membrana que permite que los iones de sodio entren lentamente en la célula hasta que se alcanza el umbral de despolarización. Los iones de calcio siguen y extienden la despolarización aún más. Una vez que el calcio deja de moverse hacia adentro, los iones de potasio salen lentamente para producir la repolarización. La repolarización muy lenta de la membrana CMC es responsable del largo período refractario. [28] [29]
Sin embargo, el mecanismo por el cual aumentan las concentraciones de calcio dentro del citosol difiere entre el músculo esquelético y el cardíaco. En el músculo cardíaco, el potencial de acción comprende un flujo entrante de iones de sodio y calcio. El flujo de iones de sodio es rápido pero de muy corta duración, mientras que el flujo de calcio es sostenido y da la fase de meseta característica de los potenciales de acción del músculo cardíaco. El flujo comparativamente pequeño de calcio a través de los canales de calcio de tipo L desencadena una liberación mucho mayor de calcio del retículo sarcoplásmico en un fenómeno conocido como liberación de calcio inducida por calcio . Por el contrario, en el músculo esquelético, fluye un mínimo de calcio hacia la célula durante el potencial de acción y, en cambio, el retículo sarcoplásmico en estas células está acoplado directamente a la membrana superficial. Esta diferencia puede ilustrarse con la observación de que las fibras del músculo cardíaco requieren que el calcio esté presente en la solución que rodea a la célula para contraerse, mientras que las fibras del músculo esquelético se contraerán sin calcio extracelular.
Durante la contracción de una célula muscular cardíaca, los largos miofilamentos proteicos orientados a lo largo de la célula se deslizan unos sobre otros en lo que se conoce como la teoría de filamentos deslizantes . Hay dos tipos de miofilamentos, filamentos gruesos compuestos por la proteína miosina y filamentos delgados compuestos por las proteínas actina , troponina y tropomiosina . A medida que los filamentos gruesos y delgados se deslizan uno sobre el otro, la célula se vuelve más corta y más gruesa. En un mecanismo conocido como ciclo de puente cruzado , los iones de calcio se unen a la proteína troponina, que junto con la tropomiosina descubren sitios de unión clave en la actina. La miosina, en el filamento grueso, puede entonces unirse a la actina, tirando de los filamentos gruesos a lo largo de los filamentos delgados. Cuando la concentración de calcio dentro de la célula disminuye, la troponina y la tropomiosina vuelven a cubrir los sitios de unión en la actina, lo que hace que la célula se relaje.

Se creía comúnmente que las células del músculo cardíaco no podían regenerarse. Sin embargo, esto fue contradicho por un informe publicado en 2009. [30] Olaf Bergmann y sus colegas del Instituto Karolinska en Estocolmo analizaron muestras de músculo cardíaco de personas nacidas antes de 1955 que tenían muy poco músculo cardíaco alrededor del corazón, muchas de las cuales presentaban discapacidades a causa de esta anomalía. Al utilizar muestras de ADN de muchos corazones, los investigadores calcularon que un niño de 4 años renueva aproximadamente el 20% de las células del músculo cardíaco por año, y aproximadamente el 69% de las células del músculo cardíaco de una persona de 50 años se generaron después de su nacimiento. [30]
Una forma en que se produce la regeneración de los cardiomiocitos es a través de la división de cardiomiocitos preexistentes durante el proceso normal de envejecimiento. [31]
En la década de 2000, se informó del descubrimiento de células madre cardíacas endógenas adultas y se publicaron estudios que afirmaban que varios linajes de células madre, incluidas las células madre de la médula ósea , podían diferenciarse en cardiomiocitos y podrían usarse para tratar la insuficiencia cardíaca . [32] [33] Sin embargo, otros equipos no pudieron replicar estos hallazgos, y muchos de los estudios originales fueron posteriormente retractados por fraude científico. [34] [35]

El músculo cardíaco forma tanto las aurículas como los ventrículos del corazón. Aunque este tejido muscular es muy similar entre las cámaras cardíacas, existen algunas diferencias. El miocardio que se encuentra en los ventrículos es grueso para permitir contracciones enérgicas, mientras que el miocardio en las aurículas es mucho más delgado. Los miocitos individuales que componen el miocardio también difieren entre las cámaras cardíacas. Los cardiomiocitos ventriculares son más largos y anchos, con una red de túbulos T más densa . Aunque los mecanismos fundamentales de manejo del calcio son similares entre los cardiomiocitos ventriculares y auriculares, el transitorio de calcio es menor y se desintegra más rápidamente en los miocitos auriculares, con un aumento correspondiente en la capacidad de amortiguación del calcio . [36] El complemento de canales iónicos difiere entre cámaras, lo que lleva a duraciones de potenciales de acción más prolongadas y períodos refractarios efectivos en los ventrículos. Ciertas corrientes iónicas como I K(UR) son altamente específicas de los cardiomiocitos auriculares, lo que los convierte en un objetivo potencial para los tratamientos de la fibrilación auricular . [37]
Las enfermedades que afectan al músculo cardíaco, conocidas como miocardiopatías , son la principal causa de muerte en los países desarrollados . [38] La afección más común es la enfermedad de la arteria coronaria , en la que se reduce el suministro de sangre al corazón . Las arterias coronarias se estrechan por la formación de placas ateroscleróticas . [39] Si estos estrechamientos se vuelven lo suficientemente graves como para restringir parcialmente el flujo sanguíneo, puede producirse el síndrome de angina de pecho. [39] Esto generalmente causa dolor en el pecho durante el esfuerzo que se alivia con el descanso. Si una arteria coronaria se estrecha repentinamente o se bloquea por completo, interrumpiendo o reduciendo gravemente el flujo sanguíneo a través del vaso, se produce un infarto de miocardio o un ataque cardíaco. [40] Si el bloqueo no se alivia rápidamente con medicación , intervención coronaria percutánea o cirugía , una región del músculo cardíaco puede quedar cicatrizada y dañada de forma permanente. [41] Las miocardiopatías específicas incluyen: aumento de la masa del ventrículo izquierdo ( miocardiopatía hipertrófica ), [42] anormalmente grande ( miocardiopatía dilatada ), [43] o anormalmente rígida ( miocardiopatía restrictiva ). [44] Algunas de estas afecciones son causadas por mutaciones genéticas y pueden heredarse. [45]
El músculo cardíaco también puede resultar dañado a pesar de un suministro normal de sangre. El músculo cardíaco puede inflamarse en una afección llamada miocarditis , [46] causada más comúnmente por una infección viral [47] pero a veces causada por el propio sistema inmunológico del cuerpo . [48] El músculo cardíaco también puede resultar dañado por drogas como el alcohol, presión arterial alta o hipertensión de larga duración o taquicardia anormal persistente . [49] Muchas de estas afecciones, si son lo suficientemente graves, pueden dañar el corazón tanto que la función de bombeo del corazón se reduce. Si el corazón ya no puede bombear suficiente sangre para satisfacer las necesidades del cuerpo, esto se describe como insuficiencia cardíaca . [49]
El daño significativo a las células del músculo cardíaco se conoce como miocitolisis , que se considera un tipo de necrosis celular definida como coagulativa o colicuativa. [50] [51]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: Mantenimiento de CS1: otros ( enlace ){{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )