
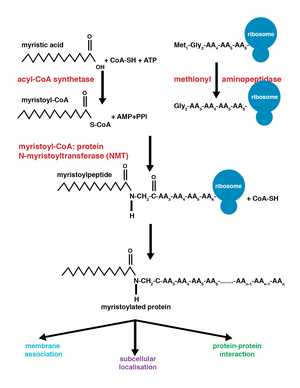
La miristoilación es una modificación de lipidación en la que un grupo miristoilo , derivado del ácido mirístico , se une covalentemente mediante un enlace amida al grupo alfa-amino de un residuo de glicina N -terminal . [1] El ácido mirístico es un ácido graso saturado de 14 carbonos (14:0) con el nombre sistemático de ácido n -tetradecanoico. Esta modificación se puede agregar de forma co-traduccional o postraduccional . La N -miristoiltransferasa (NMT) cataliza la reacción de adición de ácido mirístico en el citoplasma de las células. [2] Este evento de lipidación es el tipo más común de acilación grasa [3] y está presente en muchos organismos, incluidos animales , plantas , hongos , protozoos [4] y virus . La miristoilación permite interacciones débiles proteína-proteína y proteína-lípido [5] y desempeña un papel esencial en la orientación de la membrana, las interacciones proteína-proteína y funciona ampliamente en una variedad de vías de transducción de señales .
En 1982, el laboratorio de Koiti Titani identificó un " grupo bloqueador N -terminal" en la subunidad catalítica de la proteína quinasa dependiente de AMP cíclico en vacas como n -tetradecanoilo. [6] Casi simultáneamente en el laboratorio de Claude B. Klee, este mismo grupo bloqueador N -terminal fue caracterizado además como ácido mirístico. [7] Ambos laboratorios hicieron este descubrimiento utilizando técnicas similares: espectrometría de masas y cromatografía de gases . [6] [7]

La enzima N -miristoiltransferasa (NMT) o glicilpéptido N -tetradecanoiltransferasa es responsable de la adición irreversible de un grupo miristoilo a los residuos de glicina internos o N -terminales de las proteínas. Esta modificación puede ocurrir co-traduccionalmente o post-traduccionalmente . En los vertebrados, esta modificación es llevada a cabo por dos NMT, NMT1 y NMT2 , ambas miembros de la superfamilia de acetiltransferasas GCN5 . [8]
La estructura cristalina de NMT revela dos subunidades idénticas, cada una con su propio sitio de unión de miristoil CoA. Cada subunidad consta de una gran lámina β con forma de silla de montar rodeada de hélices α . La simetría del pliegue es pseudo doble. [ Aclaración necesaria ] El miristoil CoA se une en la porción N -terminal , mientras que el extremo C -terminal se une a la proteína. [9]
La adición del grupo miristoilo se produce a través de una reacción de adición-eliminación nucleofílica . En primer lugar, la miristoil coenzima A (CoA) se coloca en su bolsillo de unión de NMT de modo que el carbonilo se enfrenta a dos residuos de aminoácidos, fenilalanina 170 y leucina 171. [9] Esto polariza el carbonilo de modo que hay una carga neta positiva en el carbono, haciéndolo susceptible al ataque nucleofílico por el residuo de glicina de la proteína a modificar. Cuando la miristoil CoA se une, la NMT se reorienta para permitir la unión del péptido. El extremo C de la NMT actúa entonces como una base general para desprotonar el NH 3 + , activando el grupo amino para atacar al grupo carbonilo de la miristoil-CoA. El intermedio tetraédrico resultante se estabiliza mediante la interacción entre un agujero de oxianión cargado positivamente y el anión alcóxido cargado negativamente . Luego se libera CoA libre, lo que provoca un cambio conformacional en la enzima que permite la liberación del péptido miristoilado. [2]

Las modificaciones covalentes co-traduccionales y post-traduccionales permiten que las proteínas desarrollen niveles más altos de complejidad en la función celular, agregando aún más diversidad al proteoma . [10] La adición de miristoil-CoA a una proteína puede ocurrir durante la traducción de la proteína o después. Durante la adición co-traduccional del grupo miristoil, la glicina N -terminal se modifica después de la escisión del residuo de metionina N -terminal en el polipéptido en crecimiento que se está formando recientemente . [1] La miristoilación post-traduccional ocurre típicamente después de un evento de escisión de caspasa , lo que resulta en la exposición de un residuo de glicina interno, que luego está disponible para la adición de ácido mirístico. [8]
La miristoilación no sólo diversifica la función de una proteína, sino que también le añade capas de regulación. Una de las funciones más comunes del grupo miristoilo es la asociación a la membrana y la localización celular de la proteína modificada. Aunque el grupo miristoilo se añade al final de la proteína, en algunos casos queda secuestrado dentro de las regiones hidrofóbicas de la proteína en lugar de estar expuesto al disolvente. [5] Al regular la orientación del grupo miristoilo, estos procesos pueden coordinarse en gran medida y controlarse de cerca. La miristoilación es, por tanto, una forma de " interruptor molecular ". [13]
Los grupos miristoilo hidrófobos y los "parches básicos" (regiones altamente positivas en la proteína) caracterizan los interruptores electrostáticos de miristoilo. El parche básico permite que se produzcan interacciones electrostáticas favorables entre las cabezas de fosfolípidos de la membrana con carga negativa y la superficie positiva de la proteína asociada. Esto permite una asociación más estrecha y una localización dirigida de las proteínas. [5]
Los cambios conformacionales del miristoil pueden presentarse de varias formas. La unión del ligando a una proteína miristoilada con su grupo miristoil secuestrado puede causar un cambio conformacional en la proteína, lo que da como resultado la exposición del grupo miristoilado. De manera similar, algunas proteínas miristoiladas se activan no por un ligando designado, sino por el intercambio de GDP por GTP por factores de intercambio de nucleótidos de guanina en la célula. Una vez que el GTP se une a la proteína miristoilada, se activa, exponiendo el grupo miristoilado. Estos cambios conformacionales se pueden utilizar como una señal para la localización celular, la membrana-proteína y las interacciones proteína-proteína . [5] [13] [14]
Otras modificaciones de las proteínas N -miristoiladas pueden añadir otro nivel de regulación a la proteína miristoilada. La acilación dual puede facilitar una localización de proteínas más regulada, dirigiendo específicamente las proteínas a las balsas lipídicas de las membranas [15] o permitiendo la disociación de las proteínas miristoiladas de las membranas.
La miristoilación y la palmitoilación son modificaciones acopladas que suelen estar asociadas. La miristoilación por sí sola puede promover interacciones transitorias con la membrana [5] que permiten que las proteínas se anclen a las membranas pero se disocien fácilmente. Una mayor palmitoilación permite un anclaje más firme y una disociación más lenta de las membranas cuando la célula lo requiere. Esta modificación dual específica es importante para las vías de los receptores acoplados a la proteína G y se conoce como el interruptor de acilación grasa dual. [5] [8]
La miristoilación suele ir seguida de la fosforilación de los residuos cercanos. La fosforilación adicional de la misma proteína puede reducir la afinidad electrostática de la proteína miristoilada por la membrana, lo que provoca la translocación de esa proteína al citoplasma tras la disociación de la membrana. [5]
La miristoilación desempeña un papel vital en la orientación de la membrana y la transducción de señales [16] en las respuestas de las plantas al estrés ambiental. Además, en la transducción de señales a través de la proteína G, la palmitoilación de la subunidad α, la prenilación de la subunidad γ y la miristoilación están involucradas en la fijación de la proteína G a la superficie interna de la membrana plasmática para que la proteína G pueda interactuar con su receptor. [17]
La miristoilación es una parte integral de la apoptosis o muerte celular programada. La apoptosis es necesaria para la homeostasis celular y ocurre cuando las células están bajo estrés, como la hipoxia o el daño del ADN . La apoptosis puede proceder por activación mitocondrial o mediada por receptores. En la apoptosis mediada por receptores, las vías apoptóticas se desencadenan cuando la célula se une a un receptor de muerte. En uno de esos casos, la unión del receptor de muerte inicia la formación del complejo de señalización inductor de muerte , un complejo compuesto de numerosas proteínas que incluyen varias caspasas, incluida la caspasa 3. La caspasa 3 escinde varias proteínas que posteriormente son miristoiladas por NMT. El agonista de muerte del dominio de interacción BH3 proapoptótico (Bid) es una de esas proteínas que, una vez miristoilada, se transloca a las mitocondrias , donde provoca la liberación de citocromo c, lo que conduce a la muerte celular. [8] La actina , la gelsolina y la quinasa 2 activada por p21 PAK2 son otras tres proteínas que se miristoilan después de la escisión por la caspasa 3 , lo que conduce a la regulación positiva o negativa de la apoptosis. [8]
c-Src es un gen que codifica para el protooncogén tirosina-proteína quinasa Src, una proteína importante para el ciclo mitótico normal . Se fosforila y desfosforila para activar y desactivar la señalización. El protooncogén tirosina-proteína quinasa Src debe localizarse en la membrana plasmática para fosforilar otros objetivos posteriores; la miristoilación es responsable de esteevento de focalización de la membrana . El aumento de la miristoilación de c-Src puede conducir a una mayor proliferación celular y ser responsable de transformar células normales en células cancerosas . [5] [14] [18] La activación de c-Src puede conducir a las llamadas " señales distintivas del cáncer ", entre ellas la regulación positiva de la angiogénesis , la proliferación y la invasión . [19]

El VIH-1 es un retrovirus que depende de la miristoilación de una de sus proteínas estructurales para empaquetar con éxito su genoma, ensamblarlo y madurar en una nueva partícula infecciosa. La proteína de la matriz viral , el dominio más N -terminal de la poliproteína gag , está miristoilada. [20] Esta modificación de miristoilación dirige a gag a la membrana de la célula huésped. Utilizando el interruptor electrostático de miristoilo, [13] que incluye un parche básico en la proteína de la matriz, gag puede ensamblarse en balsas lipídicas en la membrana plasmática para el ensamblaje viral , la gemación y la maduración posterior. [18] Para prevenir la infectividad viral, la miristoilación de la proteína de la matriz podría convertirse en un buen objetivo farmacológico.
Ciertos NMT son objetivos terapéuticos para el desarrollo de fármacos contra infecciones bacterianas . Se ha demostrado que la miristoilación es necesaria para la supervivencia de varios hongos causantes de enfermedades , entre ellos C. albicans y C. neoformans . Además de las bacterias procariotas , los NMT de numerosos organismos eucariotas causantes de enfermedades también se han identificado como objetivos de fármacos . El funcionamiento adecuado de los NMT en los protozoos Leishmania major y Leishmania donovani ( leishmaniasis ), Trypanosoma brucei ( enfermedad del sueño africana ) y P. falciparum ( malaria ) es necesario para la supervivencia de los parásitos. Los inhibidores de estos organismos están bajo investigación actual. Se ha identificado un inhibidor de sulfonamida de pirazol que se une selectivamente a T. brucei , compitiendo por el sitio de unión del péptido , inhibiendo así la actividad enzimática y eliminando el parásito del torrente sanguíneo de ratones con enfermedad del sueño africana . [8]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )