Mycoplasma pneumoniae es una bacteria sin pared celular muy pequeñade la clase Mollicutes . Es un patógeno humano que causa la enfermedad neumonía por micoplasma , una forma de neumonía bacteriana atípica relacionada con la enfermedad de aglutininas frías . M. pneumoniae se caracteriza por la ausencia de una pared celular de peptidoglicano y la consiguiente resistencia a muchos agentes antibacterianos . La persistencia de las infecciones por M. pneumoniae incluso después del tratamiento se asocia con su capacidad para imitar la composición de la superficie de la célula huésped .
En 1898, Nocard y Roux aislaron un agente que se suponía causaba la neumonía del ganado y lo denominaron microbio de la peripneumonie [1] [2] [3] [4] [5] [6] Microorganismos de otras fuentes, con propiedades similares al organismo de la pleuroneumonía (PPO) del ganado, pronto pasaron a ser conocidos como organismos similares a la pleuroneumonía (PPLO), pero su verdadera naturaleza seguía siendo desconocida. [1] [2] [3] [4] Posteriormente se demostró que muchos PPLO eran la causa de neumonías y artritis en varios animales inferiores. [1] [7] [8] [9]
En 1944, Monroe Eaton utilizó huevos de gallina embrionados para cultivar un agente que se cree que es la causa de la neumonía atípica primaria (PAP) humana, comúnmente conocida como "neumonía andante". [10] Este organismo desconocido pasó a ser conocido como el "agente de Eaton". [11] En ese momento, el uso de huevos embrionados por parte de Eaton, luego utilizados para cultivar virus, apoyó la idea de que el agente de Eaton era un virus. Sin embargo, se sabía que la PAP era susceptible de tratamiento con antibióticos de amplio espectro , lo que hacía sospechar una etiología viral. [1] [2] [7] [12] [13]
Robert Chanock , un investigador del NIH que estudiaba el agente de Eaton como virus, visitó el Instituto Wistar de Filadelfia en 1961 para obtener un cultivo celular de una cepa de células humanas normales desarrollada por Leonard Hayflick . Se sabía que esta cepa celular era exquisitamente sensible para aislar y cultivar virus humanos. Chanock le contó a Hayflick su investigación sobre el agente de Eaton y su creencia de que su naturaleza viral era cuestionable. Aunque Hayflick sabía poco sobre las investigaciones actuales sobre este agente, su tesis doctoral se había realizado sobre enfermedades animales causadas por PPLO. Hayflick sabía que muchos animales inferiores padecían neumonías causadas por PPLO (que más tarde se denominarían micoplasmas ). Hayflick razonó que el agente de Eaton podría ser un micoplasma y no un virus. Chanock nunca había oído hablar de los micoplasmas y, a petición de Hayflick, le envió yema de huevo que contenía el agente de Eaton. [1] [4] [14] [15] [16] [17]
Utilizando una nueva formulación de agar y medio fluido que había ideado, [14] Hayflick aisló un micoplasma único de la yema del huevo. Chanock y Hayflick pronto demostraron que esto era el agente causante de la PAP. [14] [18] [19] [20] Cuando Emmy Klieneberger-Nobel del Instituto Lister de Londres, la principal autoridad mundial en estos organismos, conoció este descubrimiento, sugirió que el organismo se llamara Mycoplasma hayflickiae . [21] Hayflick objetó a favor de Mycoplasma pneumoniae . [22] [23]
Este microorganismo de vida libre más pequeño fue el primero en ser aislado y demostrado ser la causa de una enfermedad humana. Por su descubrimiento, Hayflick recibió el Premio Presidencial de la Organización Internacional de Micoplasmología. El microscopio invertido con el que Hayflick descubrió Mycoplasma pneumoniae se conserva en el Instituto Smithsonian . [20]
El término micoplasma ( mykes significa hongo y plasma significa formado) se deriva del crecimiento similar a un hongo de algunas especies de micoplasma. [6] Los micoplasmas fueron clasificados como Mollicutes (“mollis”, que significa blando y “cutis”, que significa piel) en 1960 debido a su pequeño tamaño y genoma , falta de pared celular , bajo contenido de G+C y necesidades nutricionales inusuales . [6] [24] M. pneumoniae también ha sido designada como una especie no fermentadora de arginina . [25] Los micoplasmas se clasifican además según la composición de la secuencia del ARNr 16s . Todos los micoplasmas del grupo pneumoniae poseen variaciones similares del ARNr 16s exclusivas del grupo, de las cuales M. pneumoniae tiene una variación del 6,3 % en las regiones conservadas , lo que sugiere micoplasmas formados por evolución degenerativa del grupo de eubacterias grampositivas que incluye bacilos y estreptococos . y lactobacilos . [6] [24] [25] M. pneumoniae es un miembro de la familia Mycoplasmataceae y del orden Mycoplasmatales . [6]
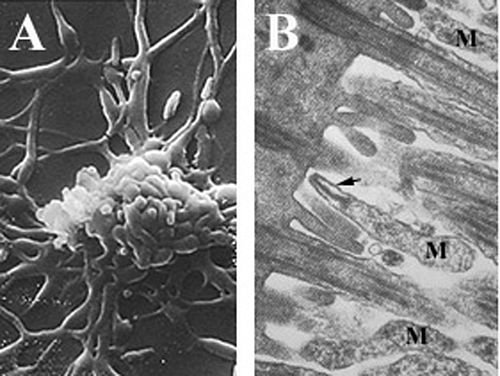
Los micoplasmas, que se encuentran entre los organismos autorreplicantes más pequeños , son especies parásitas que carecen de pared celular y espacio periplásmico , tienen genomas reducidos y actividad metabólica limitada . [6] [25] [26] Las células de Mycoplasma pneumoniae tienen una forma alargada que mide aproximadamente 0,1 a 0,2 μm (100 a 200 nm ) de ancho y 1 a 2 μm (1000 a 2000 nm) de largo. El tamaño extremadamente pequeño de las células significa que no se pueden examinar mediante microscopía óptica ; Se requiere un microscopio estereoscópico para observar la morfología de las colonias de M. pneumoniae , que suelen tener menos de 100 μm de longitud. [6] La incapacidad de sintetizar una pared celular de peptidoglicano se debe a la ausencia de genes que codifiquen su formación y da como resultado una mayor importancia en el mantenimiento de la estabilidad osmótica para evitar la desecación . [6] La falta de una pared celular también exige un mayor soporte de la membrana celular (reforzada con esteroles), que incluye un citoesqueleto rígido compuesto por una intrincada red de proteínas y, potencialmente, una cápsula extracelular para facilitar la adherencia a la célula huésped . [6] M. pneumoniae son las únicas células bacterianas que poseen colesterol en su membrana celular (obtenido del huésped) y poseen más genes que codifican variaciones de lipoproteínas de membrana que otros micoplasmas, [25] que se cree que están asociados con su parásito estilo de vida. Las células de M. pneumoniae también poseen un orgánulo de unión , que se utiliza en la motilidad de deslizamiento del organismo mediante un mecanismo desconocido. [6]
La secuenciación del genoma de M. pneumoniae en 1996 reveló que tiene un tamaño de 816.394 pb. [24] El genoma contiene 687 genes que codifican proteínas, de los cuales alrededor del 56,6% codifican enzimas metabólicas esenciales ; en particular los implicados en la glucólisis y la fermentación de ácidos orgánicos . [6] [24] [25] [27] En consecuencia , M. pneumoniae es muy susceptible a la pérdida de la función enzimática por mutaciones genéticas , ya que los únicos sistemas de amortiguación contra la pérdida funcional por mutaciones puntuales son el mantenimiento de la vía de las pentosas fosfato y el metabolismo de los nucleótidos. . [27] Se sugiere que la pérdida de función en otras vías se compensa mediante el metabolismo de la célula huésped. [27] Además de la posibilidad de pérdida de la función de la vía, el genoma reducido de M. pneumoniae carece por completo de una serie de vías, incluido el ciclo del TCA , la cadena respiratoria de transporte de electrones y las vías de biosíntesis de aminoácidos , ácidos grasos , colesterol y purinas y pirimidinas . [6] [25] [27] Estas limitaciones hacen que M. pneumoniae dependa de los sistemas de importación para adquirir componentes básicos esenciales de su huésped o del medio ambiente que no se pueden obtener a través de vías glucolíticas . [25] [27] Junto con la costosa producción de proteínas y ARN , una gran parte del metabolismo energético se ejerce para mantener los gradientes de protones (hasta 80%) debido a la alta relación superficie-volumen de las células de M. pneumoniae . Sólo entre el 12 y el 29 % del metabolismo energético se dirige al crecimiento celular , que es inusualmente bajo para las células bacterianas y se cree que es una adaptación de su estilo de vida parasitario. [27]
A diferencia de otras bacterias, M. pneumoniae utiliza el codón UGA para codificar el triptófano en lugar de utilizarlo como codón de terminación. [6] [24]
Mycoplasma pneumoniae tiene un metaboloma reducido en comparación con otras especies bacterianas . [28] Esto significa que el patógeno tiene menos reacciones metabólicas en comparación con otras especies bacterianas como B.subtilis y Escherichia coli . [28] [29]

Dado que Mycoplasma pneumoniae tiene un genoma reducido, tiene un número menor de vías generales y enzimas metabólicas, lo que contribuye a su metaboloma más lineal. [28] Un metaboloma lineal hace que Mycoplasma pneumoniae sea menos adaptable a factores externos. [28] Además, dado que Mycoplasma pneumoniae tiene un genoma reducido, la mayoría de sus enzimas metabólicas son esenciales. [28] Esto contrasta con otro organismo modelo, Escherichia coli , en el que sólo el 15% de sus enzimas metabólicas son esenciales. [28] En resumen, la topología lineal del metaboloma de Mycoplasma pneumoniae conduce a una eficiencia reducida en sus reacciones metabólicas, pero aún mantiene niveles similares de concentraciones de metabolitos, energía celular, adaptabilidad y expresión genética global. [28]
La tabla anterior muestra la longitud media del recorrido de los metabolomas de M. pneumoniae , E. coli , L. lactis y B. subtilis . [28] Este número describe, esencialmente, el número medio de reacciones que ocurren en el metaboloma. Mycoplasma pneumoniae , en promedio, tiene una gran cantidad de reacciones por vía dentro de su metaboloma en comparación con otras especies bacterianas modelo. [28]
Un efecto del metaboloma único de Mycoplasma pneumoniae es su mayor tiempo de duplicación. [28] Al patógeno le toma mucho más tiempo duplicarse en promedio en comparación con otras bacterias del organismo modelo. [28] Esto puede deberse al hecho de que el metaboloma de Mycoplasma pneumoniae es menos eficiente que el de Escherichia coli . [28]
El metaboloma de Mycoplasma pneumoniae también puede resultar informativo para analizar su patogénesis. [31] Un estudio exhaustivo de la red metabólica de este organismo ha llevado a la identificación de biomarcadores que potencialmente pueden revelar la presencia de las complicaciones extensas que la bacteria puede causar. [31] La metabolómica se utiliza cada vez más como una herramienta útil para la verificación de biomarcadores de patógenos infecciosos. [31]
Mycoplasma pneumoniae crece exclusivamente parasitando a mamíferos. Por lo tanto, la reproducción depende de la unión a una célula huésped. Según Waites y Talkington, la reproducción especializada se produce por “ fisión binaria , temporalmente ligada a la duplicación de su orgánulo de unión, que migra al polo opuesto de la célula durante la replicación y antes de la separación de nucleoides ”. [6] Las mutaciones que afectan la formación del orgánulo de unión no solo dificultan la motilidad y la división celular , sino que también reducen la capacidad de las células de M. pneumoniae para adherirse a la célula huésped. [25]

Mycoplasma pneumoniae parasita el epitelio del tracto respiratorio de los humanos. [6] Se cree que la adherencia a las células epiteliales respiratorias ocurre a través del orgánulo de unión, seguida de la evasión del sistema inmunológico del huésped mediante la localización intracelular y el ajuste de la composición de la membrana celular para imitar la membrana de la célula huésped. [ cita necesaria ]
La adherencia de M. pneumoniae a una célula huésped (por lo general una célula del tracto respiratorio , pero en ocasiones a un eritrocito o una célula del revestimiento urogenital ) es el evento iniciador de la enfermedad neumónica y los síntomas relacionados. [6] El orgánulo de unión especializado es una extensión celular polar , densa en electrones y alargada que facilita la motilidad y la adherencia a las células huésped. [6] [25] Está compuesto por un filamento central rodeado por un espacio intracitoplasmático , junto con una serie de adhesinas y proteínas estructurales y accesorias localizadas en la punta del orgánulo. [6] [25] Se sabe que una variedad de proteínas contribuyen a la formación y funcionalidad del orgánulo de unión, incluidas las proteínas accesorias HMW1–HMW5, P30, P56 y P90 que confieren estructura y soporte de adhesina, y P1, P30 y P116 que están directamente involucrados en el apego. [6] [32] [33] Esta red de proteínas participa no solo en el inicio de la formación y adhesión de orgánulos de unión, sino también en la motilidad . [33] La adhesina P1 (proteína sensible a la tripsina) es una proteína de 120 kDa altamente agrupada en la superficie de la punta del orgánulo de unión en micoplasmas virulentos . [6] [33] [34] Tanto la presencia de P1 como su concentración en la superficie celular son necesarias para la unión de M. pneumoniae a la célula huésped. Se ha demostrado que las células de M. pneumoniae tratadas con anticuerpos monoclonales específicos del extremo C inmunogénico de la adhesina P1 inhiben su capacidad para unirse a la superficie de la célula huésped en aproximadamente un 75 %, lo que sugiere que P1 es un componente importante en la adherencia. [6] [32] [33] Estos anticuerpos también disminuyeron la capacidad de la célula para deslizarse rápidamente, lo que puede contribuir a una menor adherencia al huésped al dificultar su capacidad para localizar una célula huésped. [32] Además, las mutaciones en P1 o la degradación por tratamiento con tripsina producen células avirulentas de M. pneumoniae . [6] La pérdida de proteínas en el citoesqueleto involucradas en la localización de P1 en la estructura de la punta, como HMW1-HMW3, también causa avirulencia.debido a la falta de agrupación de adhesinas. [33] [34] Otra proteína que se considera que desempeña un papel importante en la adherencia es la P30, ya que las células de M. pneumoniae con mutaciones en esta proteína o que han tenido anticuerpos generados contra la P30 son incapaces de adherirse a las células huésped. [6] [25] P30 no participa en la localización de P1 en la estructura de la punta, ya que P1 se transporta al orgánulo de unión en los mutantes P30, sino que puede funcionar como una adhesina accesoria de unión al receptor . [25] [34] Los mutantes de P30 también muestran características morfológicas distintas , como múltiples lóbulos y una forma redondeada en lugar de alargada, lo que sugiere que P30 puede interactuar con el citoesqueleto durante la formación del orgánulo de unión. [25] Varios componentes de la superficie de las células eucariotas han sido implicados en la adherencia de las células de M. pneumoniae al epitelio del tracto respiratorio . Entre ellos se encuentran los sialoglicoconjugados , los glicolípidos sulfatados , las glicoproteínas , la fibronectina y los receptores del ácido neuramínico . [6] [32] [35] Las lectinas en la superficie de las células bacterianas son capaces de unirse a cadenas de oligosacáridos en glicolípidos y glicoproteínas para facilitar la unión, además de las proteínas TU y piruvato deshidrogenasa E1 β , que se unen a la fibronectina. [6] [32]

Se sabe que Mycoplasma pneumoniae evade la detección del sistema inmunológico del huésped , resiste el tratamiento con antibióticos y cruza barreras mucosas , lo que puede deberse a su capacidad para fusionarse con las células del huésped y sobrevivir intracelularmente . [6] [26] Además de la estrecha proximidad física de M. pneumoniae y las células huésped, la falta de pared celular y componentes peculiares de la membrana celular , como el colesterol , pueden facilitar la fusión (1). La localización interna puede producir infecciones crónicas o latentes, ya que M. pneumoniae es capaz de persistir , sintetizar ADN y replicarse dentro de la célula huésped incluso después del tratamiento con antibióticos. [26] Se desconoce el mecanismo exacto de localización intracelular; sin embargo, el potencial de secuestro citoplasmático dentro del huésped explica la dificultad para eliminar por completo las infecciones por M. pneumoniae en los individuos afectados. [6]
Además de evadir el sistema inmunológico del huésped mediante localización intracelular, M. pneumoniae puede cambiar la composición de su membrana celular para imitar la membrana de la célula huésped y evitar la detección por parte de las células del sistema inmunológico . Las células de M. pneumoniae poseen una serie de antígenos proteicos y glicolípidos que provocan respuestas inmunitarias , pero la variación de estos antígenos de superficie permitiría que la infección persistiera el tiempo suficiente para que las células de M. pneumoniae se fusionaran con las células huésped y escaparan a la detección. La similitud entre las composiciones de M. pneumoniae y las membranas celulares humanas también puede dar lugar a respuestas autoinmunes en varios órganos y tejidos. [6]
El principal efecto citotóxico de M. pneumoniae es la alteración local de la estructura tisular y celular a lo largo del epitelio del tracto respiratorio debido a su proximidad a las células huésped. La unión de las bacterias a las células huésped puede provocar la pérdida de cilios , una reducción del metabolismo , la biosíntesis y la importación de macromoléculas y, eventualmente, las células infectadas pueden desprenderse del revestimiento epitelial . [6] M. pneumoniae produce un factor de virulencia único conocido como toxina del síndrome de dificultad respiratoria adquirida en la comunidad (CARDS). [36] Lo más probable es que la toxina CARDS ayude en la colonización y las vías patógenas de M. pneumoniae, lo que provoca inflamación y disfunción de las vías respiratorias. Además, la formación de peróxido de hidrógeno es un factor de virulencia clave en las infecciones por M. pneumoniae . [6] La unión de M. pneumoniae a los eritrocitos permite la difusión del peróxido de hidrógeno de la bacteria a la célula huésped sin desintoxicación por catalasa o peroxidasa , que puede dañar la célula huésped al reducir el glutatión , dañar las membranas lipídicas y provocar la desnaturalización de las proteínas . [6] [35] El daño local también puede ser el resultado de la adquisición de lactoferrina y la posterior formación de radicales hidroxilo , aniones superóxido y peróxido . [6] Los efectos citotóxicos de las infecciones por M. pneumoniae se traducen en síntomas comunes como tos e irritación pulmonar que pueden persistir durante meses después de que la infección haya desaparecido. La inflamación local y la hiperreactividad por la producción de citoquinas inducida por infección se han asociado con afecciones crónicas como el asma bronquial y también se han relacionado con la progresión de los síntomas en individuos con fibrosis quística y EPOC . [6]
Este artículo incorpora texto de dominio público de los CDC citado.