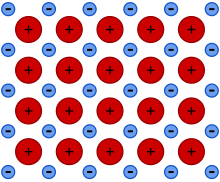
El enlace metálico es un tipo de enlace químico que surge de la fuerza de atracción electrostática entre los electrones de conducción (en forma de una nube de electrones deslocalizados ) y los iones metálicos cargados positivamente . Puede describirse como la compartición de electrones libres entre una estructura de iones cargados positivamente ( cationes ). El enlace metálico explica muchas propiedades físicas de los metales, como la resistencia , la ductilidad , la resistividad y conductividad térmica y eléctrica , la opacidad y el brillo . [1] [2] [3] [4]
El enlace metálico no es el único tipo de enlace químico que puede presentar un metal, incluso como sustancia pura. Por ejemplo, el galio elemental consta de pares de átomos unidos covalentemente tanto en estado líquido como sólido; estos pares forman una estructura cristalina con enlaces metálicos entre ellos. Otro ejemplo de enlace covalente metal-metal es el ion mercurioso ( Hg2+
2).
A medida que la química se convirtió en una ciencia, se hizo evidente que los metales formaban la mayoría de la tabla periódica de los elementos, y se lograron grandes avances en la descripción de las sales que se pueden formar en reacciones con ácidos . Con la llegada de la electroquímica , se hizo evidente que los metales generalmente se disuelven como iones con carga positiva, y las reacciones de oxidación de los metales se entendieron bien en su serie electroquímica. Surgió una imagen de los metales como iones positivos unidos por un océano de electrones negativos.
Con la llegada de la mecánica cuántica, esta imagen recibió una interpretación más formal en forma del modelo del electrón libre y su extensión posterior, el modelo del electrón casi libre . En ambos modelos, los electrones se ven como un gas que viaja a través de la estructura del sólido con una energía que es esencialmente isótropa, en el sentido de que depende del cuadrado de la magnitud , no de la dirección del vector de momento k . En el espacio k tridimensional, el conjunto de puntos de los niveles llenos más altos (la superficie de Fermi ) debería ser, por lo tanto, una esfera. En el modelo casi libre, las zonas de Brillouin en forma de caja se agregan al espacio k por el potencial periódico experimentado desde la estructura (iónica), rompiendo así ligeramente la isotropía.
La aparición de la difracción de rayos X y el análisis térmico hicieron posible estudiar la estructura de los sólidos cristalinos, incluidos los metales y sus aleaciones, y se desarrollaron los diagramas de fases . A pesar de todos estos avances, la naturaleza de los compuestos y aleaciones intermetálicos siguió siendo en gran medida un misterio y su estudio era a menudo meramente empírico. Los químicos generalmente evitaban todo aquello que no pareciera seguir las leyes de proporciones múltiples de Dalton ; y el problema se consideró dominio de una ciencia diferente, la metalurgia.
El modelo del electrón casi libre fue adoptado con entusiasmo por algunos investigadores en metalurgia, en particular por Hume-Rothery , en un intento de explicar por qué se formaban aleaciones intermetálicas con ciertas composiciones y otras no. Inicialmente, los intentos de Hume-Rothery tuvieron bastante éxito. Su idea era añadir electrones para inflar el globo esférico de Fermi dentro de la serie de cajas de Brillouin y determinar cuándo se llenaría una determinada caja. Esto predijo un número bastante grande de composiciones de aleación que se observaron más tarde. Tan pronto como se dispuso de la resonancia ciclotrón y se pudo determinar la forma del globo, se descubrió que el globo no era esférico como creía Hume-Rothery, excepto quizás en el caso del cesio . Esto reveló cómo un modelo puede a veces dar toda una serie de predicciones correctas, pero aún así estar equivocado en sus supuestos básicos.
El problema de los electrones casi libres obligó a los investigadores a modificar la suposición de que los iones fluían en un mar de electrones libres. Se desarrollaron varios modelos mecánicos cuánticos, como los cálculos de la estructura de bandas basados en orbitales moleculares y la teoría del funcional de la densidad . Estos modelos se apartan de los orbitales atómicos de los átomos neutros que comparten sus electrones o (en el caso de la teoría del funcional de la densidad) se apartan de la densidad total de electrones. Sin embargo, la imagen de los electrones libres ha seguido siendo la dominante en los cursos introductorios de metalurgia.
El modelo de estructura de bandas electrónicas se convirtió en un foco importante para el estudio de los metales y, más aún, de los semiconductores . Junto con los estados electrónicos, también se demostró que los estados vibracionales forman bandas. Rudolf Peierls demostró que, en el caso de una fila unidimensional de átomos metálicos (por ejemplo, hidrógeno), una inestabilidad inevitable rompería dicha cadena en moléculas individuales. Esto despertó el interés por la pregunta general: ¿cuándo es estable el enlace metálico colectivo y cuándo un enlace localizado ocupará su lugar? Se han realizado muchas investigaciones sobre el estudio de la agrupación de átomos metálicos.
Por más potente que haya resultado el modelo de estructura de bandas para describir el enlace metálico, sigue siendo una aproximación de un solo electrón a un problema de muchos cuerpos: los estados de energía de un electrón individual se describen como si todos los demás electrones formaran un fondo homogéneo. Investigadores como Mott y Hubbard se dieron cuenta de que el tratamiento de un solo electrón era quizás apropiado para los electrones s y p fuertemente deslocalizados ; pero para los electrones d , y más aún para los electrones f , la interacción con los electrones individuales cercanos (y los desplazamientos atómicos) puede llegar a ser más fuerte que la interacción deslocalizada que conduce a las bandas anchas. Esto proporcionó una mejor explicación de la transición de electrones desapareados localizados a electrones itinerantes que participan en el enlace metálico.
La combinación de dos fenómenos da lugar al enlace metálico: la deslocalización de los electrones y la disponibilidad de un número mucho mayor de estados de energía deslocalizados que de electrones deslocalizados. [ aclaración necesaria ] Esto último podría llamarse deficiencia de electrones .
El grafeno es un ejemplo de enlace metálico bidimensional. Sus enlaces metálicos son similares a los enlaces aromáticos en el benceno , el naftaleno , el antraceno , el ovaleno , etc.
La aromaticidad de los metales en los grupos metálicos es otro ejemplo de deslocalización, esta vez a menudo en disposiciones tridimensionales. Los metales llevan el principio de deslocalización a su extremo, y se podría decir que un cristal de un metal representa una única molécula sobre la que todos los electrones de conducción están deslocalizados en las tres dimensiones. Esto significa que dentro del metal generalmente no se pueden distinguir moléculas, de modo que el enlace metálico no es intramolecular ni intermolecular. Tal vez "no molecular" sería un término más adecuado. El enlace metálico es en su mayoría no polar, porque incluso en las aleaciones hay poca diferencia entre las electronegatividades de los átomos que participan en la interacción de enlace (y, en los metales elementales puros, ninguna en absoluto). Por lo tanto, el enlace metálico es una forma comunal extremadamente deslocalizada de enlace covalente. En cierto sentido, el enlace metálico no es un tipo "nuevo" de enlace en absoluto. Describe el enlace solo como presente en un trozo de materia condensada: ya sea un sólido cristalino, un líquido o incluso un vidrio. Los vapores metálicos, por el contrario, suelen ser atómicos ( Hg ) o, en ocasiones , contienen moléculas, como Na2 , unidas por un enlace covalente más convencional. Por eso no es correcto hablar de un único "enlace metálico". [ Aclaración necesaria ]
La deslocalización es más pronunciada para los electrones s y p . La deslocalización en el cesio es tan fuerte que los electrones se liberan virtualmente de los átomos de cesio para formar un gas restringido solo por la superficie del metal. Para el cesio, por lo tanto, la imagen de los iones Cs + unidos por un gas de electrones cargado negativamente es muy cercana a la precisión (aunque no perfectamente). [a] Para otros elementos, los electrones son menos libres, en el sentido de que aún experimentan el potencial de los átomos de metal, a veces con bastante fuerza. Requieren un tratamiento mecánico cuántico más intrincado (por ejemplo, enlace fuerte ) en el que los átomos se consideran neutrales, de manera muy similar a los átomos de carbono en el benceno. Para los electrones d y especialmente f , la deslocalización no es fuerte en absoluto y esto explica por qué estos electrones pueden continuar comportándose como electrones desapareados que conservan su espín, agregando propiedades magnéticas interesantes a estos metales.
Los átomos de metal contienen pocos electrones en sus capas de valencia en relación con sus períodos o niveles de energía . Son elementos deficientes en electrones y el hecho de compartirlos no cambia eso. Quedan muchos más estados de energía disponibles que electrones compartidos. Por lo tanto, se cumplen ambos requisitos para la conductividad: fuerte deslocalización y bandas de energía parcialmente llenas. Por lo tanto, dichos electrones pueden cambiar fácilmente de un estado de energía a uno ligeramente diferente. Por lo tanto, no solo se deslocalizan, formando un mar de electrones que permean la estructura, sino que también pueden migrar a través de la estructura cuando se aplica un campo eléctrico externo, lo que genera conductividad eléctrica. Sin el campo, hay electrones que se mueven por igual en todas las direcciones. Dentro de un campo de este tipo, algunos electrones ajustarán ligeramente su estado, adoptando un vector de onda diferente . En consecuencia, habrá más electrones que se mueven en una dirección que en otra y se producirá una corriente neta.
La libertad de los electrones para migrar también da a los átomos de metal, o a las capas de ellos, la capacidad de deslizarse unos sobre otros. A nivel local, los enlaces pueden romperse fácilmente y reemplazarse por otros nuevos después de una deformación. Este proceso no afecta mucho al enlace metálico común, lo que da lugar a la maleabilidad y ductilidad características de los metales . Esto es particularmente cierto para los elementos puros. En presencia de impurezas disueltas, las divisiones que normalmente se forman con facilidad pueden bloquearse y el material se vuelve más duro. El oro, por ejemplo, es muy blando en forma pura (24 quilates ), por lo que se prefieren las aleaciones en joyería.
Los metales también suelen ser buenos conductores del calor, pero los electrones de conducción contribuyen solo en parte a este fenómeno. Las vibraciones colectivas (es decir, deslocalizadas) de los átomos, conocidas como fonones , que viajan a través del sólido como una onda, son contribuyentes más importantes.
Sin embargo, una sustancia como el diamante , que conduce bastante bien el calor, no es un conductor eléctrico. Esto no es consecuencia de que no exista deslocalización en el diamante, sino simplemente de que el carbono no es deficiente en electrones.
La deficiencia de electrones es importante para distinguir el enlace metálico del enlace covalente más convencional. Por lo tanto, deberíamos modificar la expresión dada anteriormente a: El enlace metálico es una forma comunal extremadamente deslocalizada de enlace covalente deficiente en electrones [b] .
El radio metálico se define como la mitad de la distancia entre los dos iones metálicos adyacentes en la estructura metálica. Este radio depende de la naturaleza del átomo, así como de su entorno, específicamente del número de coordinación (CN), que a su vez depende de la temperatura y la presión aplicada.
Al comparar tendencias periódicas en el tamaño de los átomos, a menudo es deseable aplicar la llamada corrección de Goldschmidt, que convierte los radios atómicos a los valores que tendrían los átomos si estuvieran coordinados en 12. Dado que los radios metálicos son mayores para el número de coordinación más alto, la corrección para coordinaciones menos densas implica multiplicar por x , donde 0 < x < 1. Específicamente, para CN = 4, x = 0,88; para CN = 6, x = 0,96, y para CN = 8, x = 0,97. La corrección recibe el nombre de Victor Goldschmidt , quien obtuvo los valores numéricos citados anteriormente. [6]
Los radios siguen tendencias periódicas generales : disminuyen a lo largo del período debido al aumento de la carga nuclear efectiva , que no se compensa con el aumento del número de electrones de valencia ; pero los radios aumentan hacia abajo en el grupo debido a un aumento en el número cuántico principal . Entre los elementos 4d y 5d , se observa la contracción de los lantánidos : hay muy poco aumento del radio hacia abajo en el grupo debido a la presencia de orbitales f poco protectores .
Los átomos de los metales tienen una fuerte fuerza de atracción entre ellos. Se requiere mucha energía para superarla. Por lo tanto, los metales a menudo tienen puntos de ebullición altos, siendo el tungsteno (5828 K) extremadamente alto. Una excepción notable son los elementos del grupo del cinc : Zn, Cd y Hg. Sus configuraciones electrónicas terminan en ...n s 2 , que se asemeja a una configuración de gas noble, como la del helio , cada vez más a medida que se desciende en la tabla periódica, porque el diferencial de energía con los orbitales n p vacíos se hace mayor. Por lo tanto, estos metales son relativamente volátiles y se evitan en sistemas de ultra alto vacío .
De lo contrario, el enlace metálico puede ser muy fuerte, incluso en metales fundidos, como el galio . Aunque el galio se derrite con el calor de la mano justo por encima de la temperatura ambiente, su punto de ebullición no está lejos del del cobre. El galio fundido es, por lo tanto, un líquido muy no volátil, gracias a su fuerte enlace metálico.
La fuerte unión de los metales en forma líquida demuestra que la energía de un enlace metálico no depende en gran medida de la dirección del enlace; esta falta de direccionalidad del enlace es una consecuencia directa de la deslocalización de los electrones y se entiende mejor en contraste con la unión direccional de los enlaces covalentes. La energía de un enlace metálico es, por tanto, principalmente una función de la cantidad de electrones que rodean al átomo metálico, como lo ejemplifica el modelo de átomo embebido . [7] Esto generalmente da como resultado que los metales asuman estructuras cristalinas relativamente simples y compactas , como FCC, BCC y HCP.
Si se utilizan velocidades de enfriamiento suficientemente altas y una composición de aleación adecuada, la unión metálica puede ocurrir incluso en vidrios , que tienen estructuras amorfas.
Gran parte de la bioquímica está mediada por la interacción débil de iones metálicos y biomoléculas. Dichas interacciones, y sus cambios conformacionales asociados , se han medido mediante interferometría de polarización dual .
Los metales son insolubles en agua o disolventes orgánicos, a menos que experimenten una reacción con ellos. Por lo general, se trata de una reacción de oxidación que priva a los átomos de metal de sus electrones itinerantes, destruyendo el enlace metálico. Sin embargo, los metales a menudo son fácilmente solubles entre sí, manteniendo el carácter metálico de su enlace. El oro, por ejemplo, se disuelve fácilmente en mercurio, incluso a temperatura ambiente. Incluso en metales sólidos, la solubilidad puede ser extensa. Si las estructuras de los dos metales son las mismas, puede haber incluso una solubilidad sólida completa , como en el caso del electrum , una aleación de plata y oro. A veces, sin embargo, dos metales formarán aleaciones con estructuras diferentes a las de cualquiera de los dos progenitores. A estos materiales se les podría llamar compuestos metálicos . Pero, como los materiales con enlace metálico normalmente no son moleculares, la ley de proporciones integrales de Dalton no es válida; y a menudo se puede lograr un rango de proporciones estequiométricas. Es mejor abandonar conceptos como "sustancia pura" o "soluto" en tales casos y hablar de fases en su lugar. El estudio de dichas fases ha sido tradicionalmente más dominio de la metalurgia que de la química , aunque ambos campos se superponen considerablemente.
El enlace metálico en compuestos complejos no necesariamente involucra a todos los elementos constituyentes por igual. Es muy posible que haya uno o más elementos que no participen en absoluto. Uno podría imaginarse a los electrones de conducción fluyendo a su alrededor como un río alrededor de una isla o una gran roca. Es posible observar qué elementos participan: por ejemplo, observando los niveles centrales en un espectro de espectroscopia de fotoelectrones de rayos X (XPS). Si un elemento participa, sus picos tienden a estar sesgados.
Algunos materiales intermetálicos, por ejemplo, presentan cúmulos metálicos que recuerdan a las moléculas; y estos compuestos son más un tema de química que de metalurgia. La formación de los cúmulos podría verse como una forma de "condensar" (localizar) el enlace deficiente en electrones en enlaces de naturaleza más localizada. El hidrógeno es un ejemplo extremo de esta forma de condensación. A altas presiones es un metal . Se podría decir que el núcleo del planeta Júpiter se mantiene unido por una combinación de enlace metálico y alta presión inducida por la gravedad. Sin embargo, a presiones más bajas, el enlace se localiza por completo en un enlace covalente regular. La localización es tan completa que resulta el gas H 2 (más familiar) . Un argumento similar se aplica a un elemento como el boro. Aunque es deficiente en electrones en comparación con el carbono, no forma un metal. En cambio, tiene una serie de estructuras complejas en las que dominan los cúmulos icosaédricos B 12 . Las ondas de densidad de carga son un fenómeno relacionado.
Como estos fenómenos implican el movimiento de los átomos acercándose o alejándose entre sí, pueden interpretarse como el acoplamiento entre los estados electrónicos y vibracionales (es decir, los fonones) del material. Se cree que una interacción electrón-fonón diferente de este tipo conduce a un resultado muy diferente a bajas temperaturas, el de la superconductividad . En lugar de bloquear la movilidad de los portadores de carga mediante la formación de pares de electrones en enlaces localizados, se forman pares de Cooper que ya no experimentan ninguna resistencia a su movilidad.
La presencia de un océano de portadores de carga móviles tiene efectos profundos en las propiedades ópticas de los metales, que sólo pueden entenderse considerando los electrones como un colectivo , en lugar de considerar los estados de los electrones individuales involucrados en enlaces covalentes más convencionales.
La luz consiste en una combinación de un campo eléctrico y uno magnético. El campo eléctrico suele ser capaz de excitar una respuesta elástica de los electrones que participan en el enlace metálico. El resultado es que los fotones no pueden penetrar muy profundamente en el metal y normalmente se reflejan, aunque algunos también pueden ser absorbidos. Esto se aplica por igual a todos los fotones del espectro visible, por lo que los metales suelen ser de color blanco plateado o grisáceo con el reflejo especular característico del brillo metálico . El equilibrio entre la reflexión y la absorción determina qué tan blanco o qué tan gris es un metal, aunque el deslustre de la superficie puede oscurecer el brillo. La plata, un metal con alta conductividad, es uno de los más blancos.
Las excepciones notables son el cobre rojizo y el oro amarillento. La razón de su color es que hay un límite superior a la frecuencia de la luz a la que los electrones metálicos pueden responder fácilmente: la frecuencia del plasmón . En la frecuencia del plasmón, la función dieléctrica dependiente de la frecuencia del gas de electrones libres pasa de negativa (reflejo) a positiva (transmisión); los fotones de frecuencia más alta no se reflejan en la superficie y no contribuyen al color del metal. Hay algunos materiales, como el óxido de indio y estaño (ITO), que son conductores metálicos (en realidad semiconductores degenerados ) para los cuales este umbral está en el infrarrojo , [8] por lo que son transparentes en el visible, pero buenos reflectores en el infrarrojo.
En el caso de la plata, la frecuencia límite se encuentra en el ultravioleta lejano, mientras que en el caso del cobre y el oro está más cerca del visible. Esto explica los colores de estos dos metales. En la superficie de un metal pueden producirse efectos de resonancia, conocidos como plasmones de superficie . Son oscilaciones colectivas de los electrones de conducción, como una onda en el océano electrónico. Sin embargo, incluso si los fotones tienen suficiente energía, normalmente no tienen el impulso suficiente para poner en movimiento la onda. Por lo tanto, los plasmones son difíciles de excitar en un metal en masa. Por eso el oro y el cobre parecen metales brillantes, aunque con un toque de color. Sin embargo, en el oro coloidal el enlace metálico está confinado a una diminuta partícula metálica, lo que impide que la onda de oscilación del plasmón "se escape". Por lo tanto, la regla de selección del impulso se rompe y la resonancia del plasmón provoca una absorción extremadamente intensa en el verde, con un color púrpura-rojo resultante. Estos colores son órdenes de magnitud más intensos que las absorciones ordinarias observadas en tintes y similares, que involucran electrones individuales y sus estados de energía.