En cristalografía , el factor de empaquetamiento atómico (FPA) , eficiencia de empaquetamiento o fracción de empaquetamiento es la fracción de volumen en una estructura cristalina que está ocupada por partículas constituyentes. Es una cantidad adimensional y siempre menor que la unidad. En los sistemas atómicos , por convención, el FPA se determina asumiendo que los átomos son esferas rígidas. El radio de las esferas se toma como el valor máximo tal que los átomos no se superponen. Para cristales de un componente (aquellos que contienen solo un tipo de partícula), la fracción de empaquetamiento se representa matemáticamente por
donde N partícula es el número de partículas en la celda unitaria, V partícula es el volumen de cada partícula y V celda unitaria es el volumen ocupado por la celda unitaria. Se puede demostrar matemáticamente que para las estructuras de un componente, la disposición más densa de átomos tiene un APF de aproximadamente 0,74 (véase la conjetura de Kepler ), obtenido por las estructuras compactas . Para las estructuras de múltiples componentes (como las aleaciones intersticiales), el APF puede superar 0,74.
El factor de empaquetamiento atómico de una celda unitaria es relevante para el estudio de la ciencia de los materiales , donde explica muchas propiedades de los materiales. Por ejemplo, los metales con un factor de empaquetamiento atómico alto tendrán una mayor "trabajabilidad" (maleabilidad o ductilidad ), de manera similar a cómo un camino es más liso cuando las piedras están más juntas, lo que permite que los átomos de metal se deslicen entre sí con mayor facilidad.
A continuación se enumeran los empaquetamientos esféricos comunes que adoptan los sistemas atómicos junto con su fracción de empaquetamiento correspondiente.
La mayoría de los metales adoptan la estructura HCP, FCC o BCC. [2]

En un empaquetamiento cúbico simple, el número de átomos por celda unitaria es uno. El lado de la celda unitaria tiene una longitud de 2 r , donde r es el radio del átomo.

En una celda unitaria cúbica centrada en las caras, el número de átomos es cuatro. Se puede trazar una línea desde la esquina superior de un cubo en diagonal hasta la esquina inferior del mismo lado del cubo, que es igual a 4 r . Utilizando la geometría y la longitud del lado, a se puede relacionar con r como:
Conociendo esto y la fórmula del volumen de una esfera , es posible calcular el APF de la siguiente manera:

La celda unitaria primitiva de la estructura cristalina cúbica centrada en el cuerpo contiene varias fracciones tomadas de nueve átomos (si las partículas del cristal son átomos): uno en cada esquina del cubo y un átomo en el centro. Debido a que el volumen de cada uno de los ocho átomos de las esquinas se comparte entre ocho celdas adyacentes, cada celda BCC contiene el volumen equivalente de dos átomos (uno central y otro en la esquina).
Cada átomo de la esquina toca al átomo del centro. Una línea que se dibuja desde una esquina del cubo a través del centro y hasta la otra esquina pasa por 4 r , donde r es el radio de un átomo. Por geometría, la longitud de la diagonal es √ 3 . Por lo tanto, la longitud de cada lado de la estructura BCC se puede relacionar con el radio del átomo mediante
Conociendo esto y la fórmula del volumen de una esfera , es posible calcular el APF de la siguiente manera:
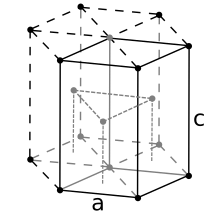
Para la estructura compacta hexagonal , la derivación es similar. Aquí, la celda unitaria (equivalente a 3 celdas unitarias primitivas) es un prisma hexagonal que contiene seis átomos (si las partículas en el cristal son átomos). De hecho, tres son los átomos en la capa intermedia (dentro del prisma); además, para las capas superior e inferior (en las bases del prisma), el átomo central se comparte con la celda adyacente, y cada uno de los seis átomos en los vértices se comparte con otras seis celdas adyacentes. Por lo tanto, el número total de átomos en la celda es 3 + (1/2) × 2 + (1/6) × 6 × 2 = 6. Cada átomo toca a otros doce átomos. Ahora sea la longitud del lado de la base del prisma y su altura. Este último es el doble de la distancia entre capas adyacentes, es decir , el doble de la altura del tetraedro regular cuyos vértices están ocupados por (por ejemplo) el átomo central de la capa inferior, dos átomos adyacentes no centrales de la misma capa y un átomo de la capa intermedia "descansando" sobre los tres anteriores. Obviamente, el borde de este tetraedro es . Si , entonces su altura se puede calcular fácilmente como , y, por lo tanto, . Entonces, el volumen de la celda unitaria hcp resulta ser (3/2) √ 3 , es decir 24 √ 2 .
Es posible entonces calcular el APF de la siguiente manera: