Ctenophora ( / t ə ˈ n ɒ f ər ə / ; SG : ctenophore / ˈ t ɛ n ə f ɔːr , ˈ t iː n ə -/ ; del griego antiguo κτείς (kteis) 'peine' y φέρω (pherō) ' llevar') [6] comprenden un filo de invertebrados marinos , comúnmente conocidos como medusas peine , que habitan en las aguas marinas de todo el mundo. Se destacan por los grupos de cilios que utilizan para nadar (comúnmente conocidos como "peines"), y son los animales más grandes que nadan con la ayuda de cilios.
Dependiendo de la especie, los ctenóforos adultos varían desde unos pocos milímetros hasta 1,5 m (5 pies) de tamaño. Sólo se han validado entre 100 y 150 especies, y posiblemente otras 25 no hayan sido descritas ni nombradas completamente.
Sus cuerpos están formados por una masa de gelatina, con una capa de dos células de espesor en el exterior y otra que recubre la cavidad interna. El filo tiene una amplia gama de formas corporales, incluidos los cídípidos con forma de huevo con un par de tentáculos retráctiles que capturan a sus presas, los platicténidos planos generalmente sin peine y los beroides de boca grande , que se alimentan de otros ctenóforos.
Casi todos los ctenóforos funcionan como depredadores , capturando presas que van desde larvas microscópicas y rotíferos hasta adultos de pequeños crustáceos ; las excepciones son los juveniles de dos especies, que viven como parásitos de las salpas de las que se alimentan los adultos de su especie.
A pesar de sus cuerpos blandos y gelatinosos, en lagerstätten aparecen fósiles que se cree que representan ctenóforos que se remontan al Cámbrico temprano , hace unos 525 millones de años. La posición de los ctenóforos en el "árbol de la vida" ha sido debatida durante mucho tiempo en estudios de filogenética molecular. Los biólogos propusieron que los ctenóforos constituyen el segundo linaje animal ramificado más antiguo, siendo las esponjas el grupo hermano de todos los demás animales multicelulares (Hipótesis de la hermana de Porifera). [7] Otros biólogos sostienen que los ctenóforos emergieron antes que las esponjas (Hipótesis de la hermana de Ctenophora), que a su vez aparecieron antes de la división entre cnidarios y bilaterales . [8] [9] Pisani y cols. volvió a analizar los datos y sugirió que los algoritmos informáticos utilizados para el análisis fueron engañados por la presencia de genes de ctenóforos específicos que eran marcadamente diferentes de los de otras especies. [10] [11] Análisis de seguimiento realizado por Whelan et al. (2017) [12] brindaron más apoyo a la hipótesis de Ctenophora Sister, y la cuestión sigue siendo una cuestión de disputa taxonómica. [13] [14] Schultz y cols. (2023) encontraron cambios irreversibles en la sintenia en la hermana de Ctenophora, la Myriazoa , constituida por el resto de animales. [15]
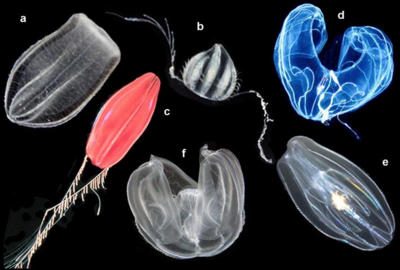
Entre los filos de animales, los ctenóforos son más complejos que las esponjas , casi tan complejos como los cnidarios ( medusas , anémonas de mar , etc.) y menos complejos que los bilaterianos (que incluyen a casi todos los demás animales). A diferencia de las esponjas, tanto los ctenóforos como los cnidarios tienen:
Los ctenóforos se distinguen del resto de animales por tener coloblastos , que son pegajosos y se adhieren a las presas, aunque algunas especies de ctenóforos carecen de ellos. [17] [18]
Al igual que las esponjas y los cnidarios, los cnidarios tienen dos capas principales de células que intercalan una capa intermedia de material gelatinoso, que se llama mesoglea en los cnidarios y ctenóforos; Los animales más complejos tienen tres capas celulares principales y ninguna capa intermedia gelatinosa. De ahí que los ctenóforos y cnidarios hayan sido tradicionalmente etiquetados como diploblásticos , junto con las esponjas. [17] [19] Tanto los ctenóforos como los cnidarios tienen un tipo de músculo que, en animales más complejos, surge de la capa celular media , [20] y como resultado algunos libros de texto recientes clasifican a los ctenóforos como triploblásticos , [21] mientras que otros Todavía los consideramos diploblásticos. [17] Las medusas peine tienen más de 80 tipos de células diferentes , superando el número de otros grupos como placozoos, esponjas, cnidarios y algunos bilaterales de ramificación profunda. [22]
Con un tamaño de aproximadamente 1 milímetro (0,04 pulgadas) a 1,5 metros (5 pies), [21] [23] los ctenóforos son los animales no coloniales más grandes que utilizan cilios ("pelos") como su principal método de locomoción. [21] La mayoría de las especies tienen ocho tiras, llamadas filas de peines, que corren a lo largo de sus cuerpos y tienen bandas de cilios en forma de peine, llamadas "ctenos", apiladas a lo largo de las filas de peines de modo que cuando los cilios baten, los de cada peine Toca el peine de abajo. [21] El nombre "ctenophora" significa "peine", del griego κτείς (forma de raíz κτεν- ) que significa "peine" y el sufijo griego -φορος que significa "llevar". [24]
Para un filo con relativamente pocas especies, los ctenóforos tienen una amplia gama de planes corporales. [21] Las especies costeras deben ser lo suficientemente resistentes para resistir las olas y las partículas de sedimento arremolinadas, mientras que algunas especies oceánicas son tan frágiles que es muy difícil capturarlas intactas para su estudio. [18] Además, las especies oceánicas no se conservan bien, [18] y se conocen principalmente por fotografías y notas de observadores. [29] Por lo tanto, hasta hace poco la mayor atención se ha concentrado en tres géneros costeros : Pleurobrachia , Beroe y Mnemiopsis . [18] [30] Al menos dos libros de texto basan sus descripciones de ctenóforos en el cídípido Pleurobrachia . [17] [21]
Dado que el cuerpo de muchas especies es casi radialmente simétrico , el eje principal es oral a aboral (desde la boca hasta el extremo opuesto). Sin embargo, dado que sólo dos de los canales cerca del estatocisto terminan en poros anales , los ctenóforos no tienen simetría especular, aunque muchos tienen simetría rotacional. En otras palabras, si el animal gira en semicírculo se ve igual que cuando empezó. [31]
El filo Ctenophore tiene una amplia gama de formas corporales, incluidos los platicténidos aplanados de aguas profundas , en los que los adultos de la mayoría de las especies carecen de crestas, y los beroides costeros , que carecen de tentáculos y se alimentan de otros ctenóforos mediante el uso de enormes bocas armadas con grupos. de cilios grandes y rígidos que actúan como dientes.

Al igual que los de los cnidarios ( medusas , anémonas de mar , etc.), los cuerpos de los ctenóforos consisten en una mesoglea gelatinosa relativamente gruesa intercalada entre dos epitelios , capas de células unidas por conexiones intercelulares y por una membrana basal fibrosa que secretar . [17] [21] Los epitelios de los ctenóforos tienen dos capas de células en lugar de una, y algunas de las células de la capa superior tienen varios cilios por célula. [21]
La capa exterior de la epidermis (piel exterior) consta de: células sensoriales; células que secretan moco , que protege el cuerpo; y células intersticiales, que pueden transformarse en otros tipos de células. En partes especializadas del cuerpo, la capa externa también contiene coloblastos , que se encuentran a lo largo de la superficie de los tentáculos y se utilizan para capturar presas, o células que tienen múltiples cilios grandes, para la locomoción. La capa interna de la epidermis contiene una red nerviosa y células mioepiteliales que actúan como músculos . [21]
La cavidad interna forma: una boca que normalmente puede cerrarse mediante músculos; una faringe ("garganta"); una zona más amplia en el centro que actúa como estómago ; y un sistema de canales internos. Estos se ramifican a través de la mesoglea hasta las partes más activas del animal: la boca y faringe; las raíces de los tentáculos, si están presentes; a lo largo de la parte inferior de cada fila de peines; y cuatro ramas alrededor del complejo sensorial en el extremo más alejado de la boca; dos de estas cuatro ramas terminan en poros anales . La superficie interna de la cavidad está revestida por un epitelio , la gastrodermis . La boca y la faringe tienen cilios y músculos bien desarrollados. En otras partes del sistema de canales, la gastrodermis es diferente en los lados más cercanos y más alejados del órgano que irriga. El lado más cercano está compuesto por células nutritivas altas que almacenan nutrientes en vacuolas (compartimentos internos), células germinales que producen óvulos o espermatozoides y fotocitos que producen bioluminiscencia . El lado más alejado del órgano está cubierto de células ciliadas que hacen circular el agua a través de los canales, puntuados por rosetas ciliares, poros que están rodeados por verticilos dobles de cilios y se conectan a la mesoglea. [21]
Cuando se traga una presa, ésta se licua en la faringe mediante enzimas y contracciones musculares de la faringe. La suspensión resultante es transportada a través del sistema de canales mediante el batir de los cilios y es digerida por las células nutritivas. Las rosetas ciliares de los canales pueden ayudar a transportar nutrientes a los músculos de la mesoglea. Los poros anales pueden expulsar pequeñas partículas no deseadas, pero la mayor parte de la materia no deseada se regurgita por la boca. [21]
Se sabe poco sobre cómo los ctenóforos eliminan los productos de desecho producidos por las células. Las rosetas ciliares de la gastrodermis pueden ayudar a eliminar los desechos de la mesoglea y también pueden ayudar a ajustar la flotabilidad del animal bombeando agua dentro o fuera de la mesoglea. [21]
La superficie exterior suele tener ocho filas de peines, llamados platos natatorios, que se utilizan para nadar. Las filas están orientadas para ir desde cerca de la boca (el "polo oral") hasta el extremo opuesto (el "polo aboral") y están espaciadas más o menos uniformemente alrededor del cuerpo, [17] aunque los patrones de espaciado varían según la especie y en la mayoría de las especies, las hileras de peines se extienden sólo una parte de la distancia desde el polo aboral hacia la boca. Los "peines" (también llamados "ctenes" o "placas de peine") atraviesan cada fila y cada uno consta de miles de cilios inusualmente largos, de hasta 2 milímetros (0,08 pulgadas). A diferencia de los cilios y flagelos convencionales, que tienen una estructura de filamentos dispuestos en un patrón de 9 + 2, estos cilios están dispuestos en un patrón de 9 + 3, donde se sospecha que el filamento extracompacto tiene una función de soporte. [32] Estos normalmente baten para que el golpe de propulsión se aleje de la boca, aunque también pueden invertir la dirección. De ahí que los ctenóforos suelen nadar en la dirección en la que come la boca, a diferencia de las medusas . [21] Al intentar escapar de los depredadores, una especie puede acelerar hasta seis veces su velocidad normal; [33] algunas otras especies invierten la dirección como parte de su comportamiento de escape, invirtiendo el movimiento de potencia de los cilios de la placa en peine.
No se sabe cómo los ctenóforos controlan su flotabilidad, pero los experimentos han demostrado que algunas especies dependen de la presión osmótica para adaptarse al agua de diferentes densidades. [34] Sus fluidos corporales normalmente están tan concentrados como el agua de mar. Si entran en agua salobre menos densa, las rosetas ciliares de la cavidad corporal pueden bombearla hacia la mesoglea para aumentar su volumen y disminuir su densidad, para evitar hundirse. Por el contrario, si pasan de agua de mar salobre a agua de mar pura, las rosetas pueden bombear agua fuera de la mesoglea para reducir su volumen y aumentar su densidad. [21]
Los ctenóforos no tienen cerebro ni sistema nervioso central , sino que tienen una red nerviosa subepidérmica (más bien como una telaraña) que forma un anillo alrededor de la boca y es más densa cerca de estructuras como las hileras de peines, la faringe, los tentáculos (si están presentes) y los órganos sensoriales. complejo más alejado de la boca. [21] La comunicación entre las células nerviosas utiliza dos métodos diferentes; Se ha descubierto que algunas de las neuronas tienen conexiones sinápticas , pero las neuronas de la red nerviosa se distinguen mucho por estar fusionadas en un sincitio , en lugar de estar conectadas mediante sinapsis. Algunos animales fuera de los ctenóforos también tienen células nerviosas fusionadas, pero nunca hasta el punto de formar una red nerviosa completa. [35] [36] [37] Los fósiles muestran que las especies del Cámbrico tenían un sistema nervioso más complejo, con nervios largos que se conectaban con un anillo alrededor de la boca. El único ctenóforo conocido con nervios largos en la actualidad es Euplokamis del orden Cydippida. [38] Sus células nerviosas surgen de las mismas células progenitoras que los coloblastos. [39]
Además, hay una red nerviosa mesogleal menos organizada que consta de neuritas individuales. La característica sensorial más grande es el órgano aboral (en el extremo opuesto a la boca), que está subrayado por su propia red nerviosa. [40] El componente principal de este órgano es un estatocisto , un sensor del equilibrio que consiste en un estatolito, un pequeño grano de carbonato de calcio, sostenido por cuatro haces de cilios , llamados "equilibradores", que detectan su orientación. El estatocisto está protegido por una cúpula transparente formada por cilios largos e inmóviles. Un ctenóforo no intenta automáticamente mantener el estatolito descansando por igual sobre todos los equilibradores. Más bien, su respuesta está determinada por el "estado de ánimo" del animal, es decir, el estado general del sistema nervioso. Por ejemplo, si un ctenóforo con tentáculos arrastrados captura a su presa, a menudo colocará algunas hileras de peines al revés, girando la boca hacia la presa. [21]
La investigación apoya la hipótesis de que las larvas ciliadas de cnidarios y bilaterales comparten un origen antiguo y común. [41] El órgano apical de las larvas participa en la formación del sistema nervioso. [42] El órgano aboral de las medusas peine no es homólogo del órgano apical de otros animales y, por tanto, la formación de su sistema nervioso tiene un origen embrionario diferente. [43]
Las células nerviosas de los ctenóforos y el sistema nervioso tienen una bioquímica diferente en comparación con otros animales. Por ejemplo, carecen de los genes y enzimas necesarios para fabricar neurotransmisores como la serotonina , la dopamina , el óxido nítrico , la octopamina , la noradrenalina y otros, que se observan en todos los demás animales con sistema nervioso, y los genes codifican los receptores para cada uno de estos. Faltan neurotransmisores. [44] La catalasa monofuncional (CAT), una de las tres familias principales de enzimas antioxidantes que se dirigen al peróxido de hidrógeno , una importante molécula de señalización para la actividad sináptica y neuronal, también está ausente, muy probablemente debido a la pérdida de genes. [45] Se ha descubierto que utilizan L-glutamato como neurotransmisor y tienen una variedad inusualmente alta de receptores de glutamato ionotrópicos y genes para la síntesis y el transporte de glutamato en comparación con otros metazoos. [46] El contenido genómico de los genes del sistema nervioso es el más pequeño conocido de cualquier animal y podría representar los requisitos genéticos mínimos para un sistema nervioso funcional. [47] El hecho de que partes del sistema nervioso presenten neuronas fusionadas directamente, sin sinapsis, sugiere que los ctenóforos podrían formar un grupo hermano de otros metazoos, habiendo desarrollado un sistema nervioso de forma independiente. [37] Si los ctenóforos son el grupo hermano de todos los demás metazoos, es posible que los sistemas nerviosos se hayan perdido en las esponjas y los placozoos, o que hayan surgido más de una vez entre los metazoos. [48]

Los ctenóforos cídípidos tienen cuerpos más o menos redondeados, a veces casi esféricos y otras veces más cilíndricos o con forma de huevo; la "grosella espinosa" costera común, Pleurobrachia , a veces tiene un cuerpo en forma de huevo con la boca en el extremo estrecho, [21] aunque algunos individuos son más uniformemente redondos. Desde lados opuestos del cuerpo se extiende un par de tentáculos largos y delgados, cada uno alojado en una funda en la que se puede retirar. [17] Algunas especies de cídípidos tienen cuerpos aplanados en diversas medidas, de modo que son más anchos en el plano de los tentáculos. [21]
Los tentáculos de los ctenóforos cídípidos suelen estar bordeados de tentillas ("pequeños tentáculos"), aunque algunos géneros tienen tentáculos simples sin estas ramas laterales. Los tentáculos y la tentilla están densamente cubiertos de coloblastos microscópicos que capturan a sus presas pegándose a ellas. Los coloblastos son células especializadas en forma de hongo en la capa externa de la epidermis y tienen tres componentes principales: una cabeza abovedada con vesículas (cámaras) que contienen adhesivo; un tallo que ancla la célula en la capa inferior de la epidermis o en la mesoglea; y un hilo en espiral que se enrolla alrededor del tallo y se une a la cabeza y a la raíz del tallo. La función del hilo en espiral es incierta, pero puede absorber la tensión cuando la presa intenta escapar y así evitar que el coloblasto se rompa. [21]
Además de los coloblastos, los miembros del género Haeckelia , que se alimentan principalmente de medusas , incorporan los nematocitos urticantes de sus víctimas en sus propios tentáculos; algunos nudibranquios que se alimentan de cnidarios incorporan de manera similar nematocitos en sus cuerpos para defenderse. [49] La tentilla de Euplokamis difiere significativamente de la de otros cídípidos: contienen músculo estriado , un tipo de célula desconocido en el filo Ctenophora; y se enrollan cuando están relajados, mientras que la tentilla de todos los demás ctenóforos conocidos se alarga cuando está relajada. Las tentillas de Euplokamis tienen tres tipos de movimientos que se utilizan para capturar presas: pueden moverse muy rápidamente (en 40 a 60 milisegundos ); pueden retorcerse, lo que puede atraer a sus presas comportándose como pequeños gusanos planctónicos; y se enroscan alrededor de la presa. El movimiento único es un movimiento de desenrollamiento impulsado por la contracción del músculo estriado . El movimiento de contoneo lo producen los músculos lisos , pero de un tipo muy especializado. Enrollarse alrededor de la presa se logra en gran medida mediante el regreso de la tentilla a su estado inactivo, pero las espirales pueden apretarse mediante el músculo liso. [50]
Hay ocho filas de peines que van desde cerca de la boca hasta el extremo opuesto y están espaciados uniformemente alrededor del cuerpo. [17] Los "peines" golpean en un ritmo metacrónico bastante parecido al de una ola mexicana . [51] De cada equilibrador en el estatocisto sale un surco ciliar debajo de la cúpula y luego se divide para conectarse con dos filas de peines adyacentes, y en algunas especies corre a lo largo de las filas de peines. Esto forma un sistema mecánico para transmitir el ritmo desde los peines a los equilibradores, a través de perturbaciones de agua creadas por los cilios. [52]
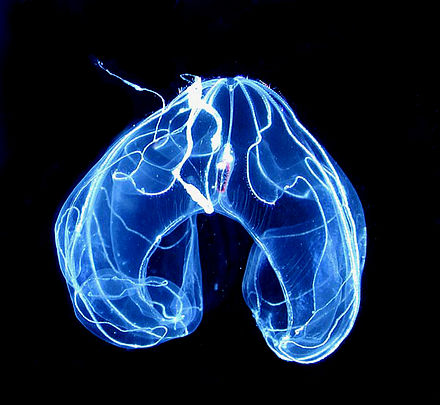
El Lobata tiene un par de lóbulos, que son extensiones musculares del cuerpo en forma de copa que se proyectan más allá de la boca. Sus discretos tentáculos se originan en las comisuras de la boca, discurren en surcos intrincados y se extienden sobre la superficie interna de los lóbulos (en lugar de quedar muy atrás, como en Cydippida). Entre los lóbulos a cada lado de la boca, muchas especies de lóbulos tienen cuatro aurículas, proyecciones gelatinosas bordeadas de cilios que producen corrientes de agua que ayudan a dirigir presas microscópicas hacia la boca. Esta combinación de estructuras permite a los lóbulos alimentarse continuamente de presas planctónicas suspendidas . [21]
Los lóbulos tienen ocho hileras de crestas que se originan en el polo aboral y generalmente no se extienden más allá del cuerpo hasta los lóbulos; en especies con (cuatro) aurículas, los cilios que bordean las aurículas son extensiones de los cilios en cuatro de las filas de peines. La mayoría de los lóbulos son bastante pasivos cuando se mueven a través del agua, utilizando los cilios en sus filas de peines para la propulsión, [21] aunque Leucothea tiene aurículas largas y activas cuyos movimientos también contribuyen a la propulsión. Los miembros de los géneros lobulados Bathocyroe y Ocyropsis pueden escapar del peligro golpeando sus lóbulos, de modo que el chorro de agua expulsado los hace retroceder muy rápidamente. [53] A diferencia de los cídípidos, los movimientos de las crestas de los lóbulos están coordinados por nervios más que por perturbaciones del agua creadas por los cilios; sin embargo, los peines en la misma fila baten en el mismo estilo de onda mexicano que las filas de peines coordinadas mecánicamente de cídípidos y beroides. [52] Esto puede haber permitido que los lóbulos crecieran más que los cídípidos y tuvieran formas menos parecidas a huevos. [51]
Una especie inusual descrita por primera vez en 2000, Lobatolampea tetragona , ha sido clasificada como lobada, aunque los lóbulos son "primitivos" y el cuerpo tiene forma de medusa cuando flota y de disco cuando descansa en el fondo del mar. [29]

Los Beroida , también conocidos como Nuda , no tienen apéndices alimentarios, pero su gran faringe , justo dentro de la boca grande y llenando la mayor parte del cuerpo en forma de saco, tiene "macrocilias" en el extremo oral. Estos haces fusionados de varios miles de cilios grandes son capaces de "morder" piezas de presa que son demasiado grandes para tragarlas enteras (casi siempre otros ctenóforos). [54] Frente al campo de macrocilias, en los "labios" de la boca en algunas especies de Beroe , hay un par de tiras estrechas de células epiteliales adhesivas en la pared del estómago que "cierran" la boca cuando el animal no se está alimentando. , formando conexiones intercelulares con la tira adhesiva opuesta. Este cierre hermético agiliza la parte delantera del animal cuando persigue a su presa. [55]
El Ganeshida tiene un par de pequeños lóbulos orales y un par de tentáculos. El cuerpo tiene una sección transversal circular en lugar de ovalada y la faringe se extiende sobre las superficies internas de los lóbulos. [21]
Los Thalassocalycida , descubiertos sólo en 1978 y conocidos de una sola especie, [56] tienen forma de medusa, con cuerpos acortados en la dirección oral-aboral y cortas hileras de crestas en la superficie más alejada de la boca, originadas cerca de la boca. el polo aboral. Capturan presas mediante movimientos de la campana y posiblemente utilizando dos tentáculos cortos. [21]
Las Cestida ("animales del cinturón") son animales planctónicos en forma de cinta, con la boca y el órgano aboral alineados en el medio de los bordes opuestos de la cinta. Hay un par de hileras de peines a lo largo de cada borde aboral y una tentilla que emerge de un surco a lo largo del borde oral, que fluye hacia atrás a través de la mayor parte de la superficie del cuerpo en forma de ala. Los céstidos pueden nadar ondulando sus cuerpos y también mediante el batir de sus crestas. Hay dos especies conocidas, con distribución mundial en aguas cálidas y templadas cálidas: Cestum veneris (" cinta de Venus ") se encuentra entre los ctenóforos más grandes: hasta 1,5 metros (4,9 pies) de largo y puede ondular lenta o bastante rápidamente. . Velamen paralelo , que normalmente mide menos de 20 centímetros (0,66 pies) de largo, puede moverse mucho más rápido en lo que se ha descrito como un "movimiento rápido". [21] [57]
La mayoría de los Platyctenida tienen cuerpos ovalados que están aplanados en la dirección oral-aboral, con un par de tentáculos con tentillas en la superficie aboral. Se aferran a las superficies y se arrastran por ellas evertiendo la faringe y usándola como un "pie" muscular. Todas menos una de las especies de platicténidos conocidas carecen de hileras de peines. [21] Los platicténidos suelen tener colores crípticos, viven en rocas, algas o en las superficies corporales de otros invertebrados y, a menudo, se revelan por sus largos tentáculos con muchas ramas laterales, que se ven saliendo de la parte posterior del ctenóforo hacia la corriente.

Los adultos de la mayoría de las especies pueden regenerar tejidos dañados o extirpados, [58] aunque sólo los platicténidos se reproducen mediante clonación , separando de los bordes de sus cuerpos planos fragmentos que se desarrollan en nuevos individuos. [21]
El último ancestro común (LCA) de los ctenóforos fue hermafrodita . [59] Algunos son hermafroditas simultáneos, que pueden producir óvulos y espermatozoides al mismo tiempo, mientras que otros son hermafroditas secuenciales, en los que los óvulos y los espermatozoides maduran en diferentes momentos. No hay metamorfosis . [60] Se sabe que al menos tres especies han evolucionado con sexos separados ( dioecia ); Ocyropsis crystallina y Ocyropsis maculata en el género Ocyropsis y Bathocyroe fosteri en el género Bathocyroe . [61] Las gónadas están ubicadas en las partes de la red de canales internos debajo de las filas de peines, y los óvulos y los espermatozoides se liberan a través de los poros de la epidermis. La fertilización es generalmente externa , pero los platicténidos utilizan la fertilización interna y mantienen los huevos en cámaras de cría hasta que eclosionan. Ocasionalmente se ha observado autofertilización en especies del género Mnemiopsis , [21] y se cree que la mayoría de las especies hermafroditas son autofértiles. [18]
El desarrollo de los óvulos fecundados es directo; no existe una forma larvaria distintiva. Los juveniles de todos los grupos son generalmente planctónicos , y la mayoría de las especies se parecen a cídípidos adultos en miniatura, y desarrollan gradualmente sus formas corporales adultas a medida que crecen. En el género Beroe , sin embargo, los juveniles tienen bocas grandes y, al igual que los adultos, carecen de tentáculos y vainas de tentáculos. En algunos grupos, como los platicténidos planos que habitan en el fondo, los juveniles se comportan más como verdaderas larvas. Viven entre el plancton y, por lo tanto, ocupan un nicho ecológico diferente al de sus padres, y sólo alcanzan la forma adulta mediante una ontogenia más radical . [21] después de caer al fondo del mar. [18]
Al menos en algunas especies, los ctenóforos juveniles parecen capaces de producir pequeñas cantidades de óvulos y esperma mientras están muy por debajo del tamaño adulto, y los adultos producen óvulos y esperma mientras tienen suficiente alimento. Si se quedan sin alimento, primero dejan de producir óvulos y espermatozoides y luego disminuyen de tamaño. Cuando mejora el suministro de alimentos, vuelven a crecer hasta alcanzar el tamaño normal y luego reanudan la reproducción. Estas características hacen que los ctenóforos sean capaces de aumentar sus poblaciones muy rápidamente. [18] Los miembros de Lobata y Cydippida también tienen una forma de reproducción llamada disogenia; dos estados sexualmente maduros, primero como larva y luego como juveniles y adultos. Durante su etapa como larva son capaces de liberar gametos periódicamente. Una vez finalizado su primer período reproductivo, no volverán a producir más gametos hasta más tarde. Una población de Mertensia ovum en el Mar Báltico central se ha vuelto pedogenética y está formada únicamente por larvas sexualmente maduras de menos de 1,6 mm. [62] [63]
En Mnemiopsis leidyi , la NOS está presente tanto en tejidos adultos como se expresa diferencialmente en etapas embrionarias posteriores, lo que sugiere la participación del NO en los mecanismos del desarrollo. [64]

La mayoría de los ctenóforos que viven cerca de la superficie son en su mayoría incoloros y casi transparentes. Sin embargo, algunas especies de vida más profunda están fuertemente pigmentadas, por ejemplo la especie conocida como "Tortugas rojas" [65] (ver ilustración aquí), que aún no ha sido descrita formalmente. [18] Los platicténidos generalmente viven adheridos a otros organismos del fondo marino y, a menudo, tienen colores similares a los de estos organismos huéspedes. [18] El intestino del género Bathocyroe de aguas profundas es rojo, lo que oculta la bioluminiscencia de los copépodos que ha tragado. [53]
Las hileras de panales de la mayoría de los ctenóforos planctónicos producen un efecto de arco iris, que no es causado por la bioluminiscencia sino por la dispersión de la luz a medida que los panales se mueven. [18] [66] La mayoría de las especies también son bioluminiscentes, pero la luz suele ser azul o verde y solo se puede ver en la oscuridad. [18] Sin embargo, algunos grupos importantes, incluidos todos los platicténidos conocidos y el género cydippid Pleurobrachia , son incapaces de bioluminiscencia. [67]
Cuando algunas especies, incluidas Bathyctena chuni , Euplokamis stationis y Eurhamphaea vexilligera , son perturbadas, producen secreciones (tinta) que brillan en longitudes de onda muy parecidas a las de sus cuerpos. Los juveniles brillarán más intensamente en relación con el tamaño de su cuerpo que los adultos, cuya luminiscencia se difunde sobre sus cuerpos. Una investigación estadística detallada no ha sugerido la función de la bioluminiscencia de los ctenóforos ni ha producido ninguna correlación entre su color exacto y cualquier aspecto del entorno de los animales, como la profundidad o si viven en aguas costeras o en medio del océano. [68]
En los ctenóforos, la bioluminiscencia es causada por la activación de proteínas activadas por calcio llamadas fotoproteínas en células llamadas fotocitos , que a menudo están confinadas a los canales meridionales que subyacen a las ocho filas de peines. En el genoma de Mnemiopsis leidyi diez genes codifican fotoproteínas. Estos genes se coexpresan con genes de opsina en los fotocitos en desarrollo de Mnemiopsis leidyi , lo que plantea la posibilidad de que la producción y la detección de luz puedan funcionar juntas en estos animales. [69]

Los ctenóforos se encuentran en la mayoría de los ambientes marinos: desde aguas polares a -2°C hasta los trópicos a 30°C; cerca de las costas y en medio del océano; desde las aguas superficiales hasta las profundidades del océano a más de 7000 metros. [70] Los mejor comprendidos son los géneros Pleurobrachia , Beroe y Mnemiopsis , ya que estas formas planctónicas costeras se encuentran entre las más probables de recolectar cerca de la costa. [30] [53] No se han encontrado ctenóforos en agua dulce.
En 2013, se registró Mnemiopsis en el lago Birket Qarun y en 2014 en el lago El Rayan II, ambos cerca de Faiyum en Egipto, donde fueron introducidos accidentalmente por el transporte de alevines de pescado (salmonetes). Aunque muchas especies prefieren aguas salobres como estuarios y lagunas costeras en conexión abierta con el mar, este fue el primer registro en un ambiente interior. Ambos lagos son salinos, siendo Birket Qarun hipersalino, y muestra que algunos ctenóforos pueden establecerse en ambientes límpicos salinos sin conexión con el océano. A largo plazo no se espera que las poblaciones sobrevivan. Los dos factores limitantes en los lagos salinos son la disponibilidad de alimentos y una dieta variada, y las altas temperaturas durante los veranos calurosos. Debido a que al mismo tiempo se introdujo un isópodo parásito, Livoneca redmanii, es difícil decir qué parte del impacto ecológico de las especies invasoras es causado por el ctenóforo únicamente. [71] [72] [73]
Los ctenóforos pueden ser abundantes durante los meses de verano en algunos lugares costeros, pero en otros lugares son poco comunes y difíciles de encontrar.
En las bahías donde se encuentran en cantidades muy elevadas, la depredación de los ctenóforos puede controlar las poblaciones de pequeños organismos zooplanctónicos como los copépodos , que de otro modo podrían acabar con el fitoplancton (plantas planctónicas), que son una parte vital de las cadenas alimentarias marinas .
Casi todos los ctenóforos son depredadores : no hay vegetarianos y sólo un género es parcialmente parásito . [53] Si la comida es abundante, pueden comer 10 veces su propio peso por día. [74] Mientras que Beroe se alimenta principalmente de otros ctenóforos, otras especies de aguas superficiales se alimentan de zooplancton (animales planctónicos) que varían en tamaño desde lo microscópico, incluidas larvas de moluscos y peces, hasta pequeños crustáceos adultos como copépodos , anfípodos e incluso krill . Los miembros del género Haeckelia se alimentan de medusas e incorporan los nematocistos (células urticantes) de sus presas en sus propios tentáculos en lugar de coloblastos . [18] Los ctenóforos han sido comparados con las arañas en su amplia gama de técnicas para capturar presas: algunos cuelgan inmóviles en el agua usando sus tentáculos como "telarañas", algunos son depredadores de emboscada como las arañas saltadoras Salticid y algunos cuelgan una gota pegajosa en el extremo de un hilo fino, como lo hacen las arañas boleadoras . Esta variedad explica la amplia gama de formas corporales en un filo con bastante pocas especies. [53] La Lampea "cídípida" de dos tentáculos se alimenta exclusivamente de salpas , parientes cercanos de las ascidias que forman grandes colonias flotantes en forma de cadenas, y los juveniles de Lampea se adhieren como parásitos a las salpas que son demasiado grandes para tragarlas. [53] Los miembros del género cídípido Pleurobrachia y el lobulado Bolinopsis a menudo alcanzan altas densidades de población en el mismo lugar y momento porque se especializan en diferentes tipos de presas: los largos tentáculos de Pleurobrachia capturan principalmente nadadores relativamente fuertes, como copépodos adultos, mientras que Bolinopsis generalmente se alimenta de nadadores más pequeños y débiles, como rotíferos y larvas de moluscos y crustáceos . [75]
Los ctenóforos solían ser considerados "callejones sin salida" en las cadenas alimentarias marinas porque se pensaba que su baja proporción de materia orgánica a sal y agua los convertía en una dieta pobre para otros animales. También suele ser difícil identificar los restos de ctenóforos en las entrañas de posibles depredadores, aunque a veces los panales permanecen intactos el tiempo suficiente para proporcionar una pista. Una investigación detallada del salmón chum , Oncorhynchus keta , demostró que estos peces digieren los ctenóforos 20 veces más rápido que un peso igual de camarones , y que los ctenóforos pueden proporcionar una buena dieta si hay suficientes cerca. Los beroides se alimentan principalmente de otros ctenóforos. Algunas medusas y tortugas comen grandes cantidades de ctenóforos, y las medusas pueden acabar temporalmente con las poblaciones de ctenóforos. Dado que los ctenóforos y las medusas suelen tener grandes variaciones estacionales en su población, la mayoría de los peces que se alimentan de ellos son generalistas y pueden tener un mayor efecto sobre las poblaciones que los especialistas en medusas. Esto queda subrayado por la observación de peces herbívoros que se alimentan deliberadamente de zooplancton gelatinoso durante las floraciones en el Mar Rojo. [76] Las larvas de algunas anémonas de mar son parásitos de los ctenóforos, al igual que las larvas de algunos gusanos planos que parasitan a los peces cuando alcanzan la edad adulta. [77]
La mayoría de las especies son hermafroditas y los juveniles de al menos algunas especies son capaces de reproducirse antes de alcanzar el tamaño y la forma adultos. Esta combinación de hermafroditismo y reproducción temprana permite que poblaciones pequeñas crezcan a un ritmo explosivo.

Los ctenóforos pueden equilibrar los ecosistemas marinos al evitar que una sobreabundancia de copépodos se coma todo el fitoplancton (plantas planctónicas), [78] que son los productores marinos dominantes de materia orgánica a partir de ingredientes no orgánicos. [79]
Por otra parte, a finales de los años 1980, el ctenóforo del Atlántico occidental Mnemiopsis leidyi fue introducido accidentalmente en el Mar Negro y el Mar de Azov a través de los tanques de lastre de los barcos, y se le ha culpado de provocar fuertes caídas en las capturas de peces al comerse tanto larvas como pequeños crustáceos que de otro modo alimentarían a los peces adultos. [78] Mnemiopsis está bien equipada para invadir nuevos territorios (aunque esto no se predijo hasta después de que colonizó con tanto éxito el Mar Negro), ya que puede reproducirse muy rápidamente y tolerar una amplia gama de temperaturas y salinidades del agua . [80] El impacto se vio incrementado por la sobrepesca crónica y por la eutrofización que dio a todo el ecosistema un impulso a corto plazo, causando que la población de Mnemiopsis aumentara incluso más rápido de lo normal [81] – y sobre todo por la ausencia de depredadores eficientes en estos ctenóforos introducidos. [80] Las poblaciones de Mnemiopsis en esas áreas finalmente quedaron bajo control mediante la introducción accidental del ctenóforo norteamericano Beroe ovata , que se alimenta de Mnemiopsis , [82] y por un enfriamiento del clima local de 1991 a 1993, [81] que ralentizó significativamente El metabolismo del animal. [80] Sin embargo, parece poco probable que la abundancia de plancton en el área se restablezca a los niveles anteriores a Mnemiopsis . [83]
A finales de la década de 1990 apareció Mnemiopsis en el mar Caspio . Beroe ovata llegó poco después y se espera que reduzca, pero no elimine, el impacto de Mnemiopsis allí. Mnemiopsis también llegó al Mediterráneo oriental a finales de los años 1990 y ahora parece estar prosperando en el Mar del Norte y el Mar Báltico . [18]
El número de especies de ctenóforos vivos conocidas es incierto ya que muchas de las nombradas y descritas formalmente han resultado ser idénticas a especies conocidas con otros nombres científicos. Claudia Mills estima que hay entre 100 y 150 especies válidas que no están duplicadas, y que al menos otras 25, en su mayoría formas de aguas profundas, han sido reconocidas como distintas pero aún no analizadas con suficiente detalle como para respaldar una descripción y denominación formales. [sesenta y cinco]
Los primeros escritores combinaron ctenóforos con cnidarios en un solo filo llamado Coelenterata debido a las similitudes morfológicas entre los dos grupos. Al igual que los cnidarios, los cuerpos de los ctenóforos consisten en una masa de gelatina, con una capa de células en el exterior y otra que recubre la cavidad interna. En los ctenóforos, sin embargo, estas capas tienen dos células de profundidad, mientras que las de los cnidarios tienen solo una célula de profundidad. Los ctenóforos también se parecen a los cnidarios en que dependen del flujo de agua a través de la cavidad corporal tanto para la digestión como para la respiración, así como en que tienen una red nerviosa descentralizada en lugar de un cerebro. Los estudios genómicos han sugerido que las neuronas de Ctenophora, que difieren en muchos aspectos de las neuronas de otros animales, evolucionaron independientemente de las de los otros animales, [84] y la creciente conciencia de las diferencias entre las medusas peine y otras celentaratas ha persuadido a más recientes autores para clasificar los dos como filos separados . La posición de los ctenóforos en el árbol genealógico evolutivo de los animales ha sido debatida durante mucho tiempo, y la opinión mayoritaria en la actualidad, basada en la filogenética molecular , es que los cnidarios y los bilaterianos están más estrechamente relacionados entre sí que cualquiera de ellos con los ctenóforos.

La clasificación tradicional divide los ctenóforos en dos clases , los que tienen tentáculos ( Tentaculata ) y los que no los tienen ( Nuda ). La Nuda contiene sólo un orden ( Beroida ) y familia ( Beroidae ), y dos géneros , Beroe (varias especies) y Neis (una especie). [sesenta y cinco]
Los Tentaculata se dividen en los siguientes ocho órdenes : [65]
A pesar de sus cuerpos frágiles y gelatinosos, en Lagerstätten se han encontrado fósiles que se cree que representan ctenóforos (aparentemente sin tentáculos pero con muchas más hileras de peines que las formas modernas) ya en el Cámbrico temprano , hace unos 515 millones de años . Sin embargo, un análisis filogenético molecular reciente concluye que el ancestro común se originó hace aproximadamente 350 millones de años ± 88 millones de años, lo que contrasta con estimaciones anteriores que sugieren que ocurrió hace 66 millones de años después del evento de extinción Cretácico-Paleógeno . [85]
Debido a sus cuerpos blandos y gelatinosos, los ctenóforos son extremadamente raros como fósiles, y los fósiles que han sido interpretados como ctenóforos se han encontrado sólo en lagerstätten , lugares donde el ambiente era excepcionalmente adecuado para la preservación del tejido blando. Hasta mediados de la década de 1990 sólo se conocían dos ejemplares suficientemente buenos para el análisis, ambos miembros del grupo de la corona, del período Devónico temprano (Emsiano) . Luego se encontraron tres supuestas especies adicionales en Burgess Shale y otras rocas canadienses de edad similar, hace unos 505 millones de años , a mediados del período Cámbrico . Los tres carecían de tentáculos pero tenían entre 24 y 80 hileras de peines, mucho más que las 8 típicas de las especies vivas. También parecen haber tenido estructuras similares a órganos internos diferentes a todo lo que se encuentra en los ctenóforos vivos. Una de las especies fósiles reportadas por primera vez en 1996 tenía una boca grande, aparentemente rodeada por un borde doblado que pudo haber sido musculoso. [4] La evidencia de China un año después sugiere que tales ctenóforos estaban muy extendidos en el Cámbrico, pero tal vez muy diferentes de las especies modernas; por ejemplo, las hileras de peines de un fósil estaban montadas en paletas prominentes. [86] El fósil más joven de una especie fuera del grupo de la corona es la especie Daihuoides del Devónico tardío y pertenece a un grupo basal que se suponía se había extinguido más de 140 millones de años antes. [87]
El Eoandrómeda de Ediacara podría supuestamente representar una gelatina en forma de peine. [2] Tiene simetría óctuple, con ocho brazos espirales que se asemejan a las filas en forma de peine de un ctenóforo. Si efectivamente es un ctenóforo, sitúa al grupo cerca del origen de Bilateria. [88] El fósil Stromatoveris , con forma de fronda sésil del Cámbrico temprano , procedente del lagerstätte de Chengjiang en China y que data de hace unos 515 millones de años , es muy similar al Vendobionta del período Ediacárico anterior . De-Gan Shu, Simon Conway Morris et al. encontró en sus ramas lo que consideraban hileras de cilios, utilizados para su alimentación por filtración . Sugirieron que Stromatoveris era una "tía" evolutiva de los ctenóforos, y que los ctenóforos se originaron a partir de animales sésiles cuyos descendientes se convirtieron en nadadores y cambiaron los cilios de un mecanismo de alimentación a un sistema de propulsión. [89] Otros fósiles del Cámbrico que apoyan la idea de que los ctenóforos evolucionaron a partir de formas sésiles son Dinomischus , Daihua , Xianguangia y Siphusauctum , que también vivieron en el fondo marino, tenían esqueletos orgánicos y tentáculos cubiertos de cilios que rodeaban su boca, que han sido encontrados por cladistas. análisis como miembros del grupo madre de ctenóforos [90] [91]
Fósiles del Cámbrico de 520 millones de años de antigüedad, también hallados en Chengjiang, China, muestran una clase de ctenóforo ahora completamente extinta, llamada " Scleroctenophora ", que tenía un esqueleto interno complejo con largas espinas. [92] El esqueleto también sostenía ocho aletas de cuerpo blando, que podrían haberse utilizado para nadar y posiblemente alimentarse. Una forma, Thaumactena , tenía un cuerpo aerodinámico parecido al de los gusanos flecha y podría haber sido un nadador ágil. [5]
La relación filogenética de los ctenóforos con el resto de los metazoos es muy importante para nuestra comprensión de la evolución temprana de los animales y el origen de la multicelularidad. Ha sido el foco de debate durante muchos años. Se supone que los ctenóforos son el linaje hermano de Bilateria , [93] [94] hermana de Cnidaria , [95] [96] [97] [98] hermana de Cnidaria , Placozoa y Bilateria , [99] [100 ] [101] y hermana de todos los demás animales. [8] [102]
Walter Garstang en su libro Larval Forms and Other Zoological Verses ( Mülleria and the Ctenophore ) incluso expresó la teoría de que los ctenóforos descendían de una larva neoténica de Mülleria de un policlado .
Una serie de estudios que observaron la presencia y ausencia de miembros de familias de genes y vías de señalización (p. ej., homeoboxes , receptores nucleares , la vía de señalización Wnt y canales de sodio ) mostraron evidencia congruente con los dos últimos escenarios, de que los ctenóforos son hermanos a Cnidaria , Placozoa y Bilateria o hermana de todos los demás filos animales. [103] [104] [105] [106] Varios estudios más recientes que comparan genomas secuenciados completos de ctenóforos con otros genomas animales secuenciados también han apoyado a los ctenóforos como el linaje hermano de todos los demás animales. [107] [27] [108] [109] Esta posición sugeriría que los tipos de células neurales y musculares se perdieron en los principales linajes animales (por ejemplo, Porifera y Placozoa ) o evolucionaron de forma independiente en el linaje de ctenóforos. [107]
Otros investigadores han argumentado que la ubicación de Ctenophora como hermana de todos los demás animales es una anomalía estadística causada por la alta tasa de evolución en los genomas de los ctenóforos, y que Porifera (esponjas) es, en cambio, el taxón animal que diverge más temprano. [101] [110] [111] [112] [113] También tienen tasas extremadamente altas de evolución mitocondrial , [114] y el contenido de ARN/proteína más pequeño conocido del genoma de ADNmt en animales. [115] Como tal, Ctenophora parece ser un clado diploblástico basal . De acuerdo con este último punto, el análisis de un alineamiento de secuencias muy grande en la escala taxonómica de los metazoos (1.719 proteínas que totalizan aproximadamente 400.000 posiciones de aminoácidos) mostró que los ctenóforos emergen como el segundo linaje animal con ramificaciones más tempranas, y las esponjas son el grupo hermano. a todos los demás animales multicelulares. [7] Además, la investigación sobre los genes de mucina , que permiten que un animal produzca moco, muestra que las esponjas nunca los han tenido, mientras que todos los demás animales, incluidas las medusas, parecen compartir genes con un origen común. [116] Y se ha revelado que a pesar de todas sus diferencias, las neuronas ctenóforas comparten la misma base que las neuronas cnidarias después de que los hallazgos muestran que las neuronas que expresan péptidos son probablemente ancestrales de los neurotransmisores químicos. [117]
Otro estudio más rechaza firmemente la hipótesis de que las esponjas son el grupo hermano de todos los demás animales existentes y establece la ubicación de Ctenophora como el grupo hermano de todos los demás animales, y el desacuerdo con el último artículo mencionado se explica por problemas metodológicos en los análisis en ese trabajar. [12] Ni los ctenóforos ni las esponjas poseen vías HIF , [118] su genoma expresa solo un tipo de canal de calcio dependiente de voltaje a diferencia de otros animales que tienen tres tipos, [119] y son los únicos filos animales conocidos que carecen de una verdadera genes hox . [27] Algunas especies de otros filos; la larva de pilidium nemertino , la larva de la especie forónida Phoronopsis harmeri y la larva del gusano bellota Schizocardium californicum , tampoco dependen de los genes hox en su desarrollo larval, pero los necesitan durante la metamorfosis para alcanzar su forma adulta. [120] [121] [122] Los genes innexin , que codifican proteínas utilizadas para la comunicación intercelular en animales, también parecen haber evolucionado de forma independiente en los ctenóforos. [123]
Dado que todos los ctenóforos modernos, excepto los beroides, tienen larvas parecidas a cídípidos, se ha asumido ampliamente que su último ancestro común también se parecía a cídípidos, con un cuerpo en forma de huevo y un par de tentáculos retráctiles. El análisis puramente morfológico de Richard Harbison en 1985 concluyó que los cídípidos no son monofiléticos, en otras palabras, no contienen todos y sólo los descendientes de un único ancestro común que era en sí mismo un cídípido. En cambio, descubrió que varias familias de cídípidos eran más similares a miembros de otros órdenes de ctenóforos que a otros cídípidos. También sugirió que el último ancestro común de los ctenóforos modernos era parecido a un cídípido o a un beroide. [125] Un análisis de filogenia molecular realizado en 2001, utilizando 26 especies, incluidas 4 descubiertas recientemente, confirmó que los cídípidos no son monofiléticos y concluyó que el último ancestro común de los ctenóforos modernos era parecido a los cídípidos. También encontró que las diferencias genéticas entre estas especies eran muy pequeñas, tan pequeñas que las relaciones entre Lobata, Cestida y Thalassocalycida seguían siendo inciertas. Esto sugiere que el último ancestro común de los ctenóforos modernos fue relativamente reciente y tal vez sobrevivió a la extinción del Cretácico-Paleógeno hace 65,5 millones de años , mientras que otros linajes perecieron. Cuando el análisis se amplió para incluir representantes de otros filos , se concluyó que los cnidarios probablemente están más estrechamente relacionados con los bilaterales que cualquier grupo con los ctenóforos, pero que este diagnóstico es incierto. [124] Un clado que incluye Mertensia , Charistephane y Euplokamis puede ser el linaje hermano de todos los demás ctenóforos. [126] [12]
Los tiempos de divergencia estimados a partir de datos moleculares indicaron aproximadamente cuántos millones de años atrás (Mya) se diversificaron los clados principales: 350 Mya para Cydippida en relación con otras Ctenophora, y 260 Mya para Platyctenida en relación con Beroida y Lobata. [12]
{{cite book}}: |journal=ignorado ( ayuda )