Las sustancias poliméricas extracelulares ( EPS ) son polímeros naturales de alto peso molecular secretados por microorganismos en su entorno. [1] Las EPS establecen la integridad funcional y estructural de las biopelículas y se consideran el componente fundamental que determina las propiedades fisicoquímicas de una biopelícula. [2] Las EPS en la matriz de las biopelículas proporcionan soporte compositivo y protección a las comunidades microbianas de los entornos hostiles. [3] Los componentes de las EPS pueden ser de diferentes clases de polisacáridos, lípidos, ácidos nucleicos, proteínas, lipopolisacáridos y minerales.
Los EPS están compuestos principalmente de polisacáridos (exopolisacáridos) y proteínas , pero incluyen otras macromoléculas como ADN , lípidos y sustancias húmicas . Los EPS son el material de construcción de los asentamientos bacterianos y permanecen adheridos a la superficie externa de la célula o se secretan en su medio de crecimiento . Estos compuestos son importantes en la formación de biopelículas y la adhesión de las células a las superficies. Los EPS constituyen entre el 50% y el 90% de la materia orgánica total de una biopelícula . [2] [4] [5]
Los exopolisacáridos (a veces también abreviados como EPS ; azúcares EPS de ahí en adelante) son las partes basadas en azúcar de los EPS. Los microorganismos sintetizan un amplio espectro de polisacáridos multifuncionales que incluyen polisacáridos intracelulares , polisacáridos estructurales y polisacáridos extracelulares o exopolisacáridos. [6] Los exopolisacáridos generalmente consisten en monosacáridos y algunos sustituyentes no carbohidratos (como acetato , piruvato , succinato y fosfato ).
Los exopolisacáridos son secretados por microorganismos, incluidas las microalgas , al entorno circundante durante su crecimiento o propagación. [7] Pueden estar unidos de forma laxa a la pared celular o excretarse al medio ambiente. [8] [9] Muchas microalgas, especialmente una variedad de algas rojas y cianobacterias , son productoras de exopolisacáridos estructuralmente diversos. Además, los exopolisacáridos están involucrados en las interacciones entre células, la adhesión y la formación de biopelículas . [10] [11]
Los exopolisacáridos se utilizan ampliamente en la industria alimentaria como espesantes y aditivos gelificantes, que mejoran la calidad y la textura de los alimentos. [12] Actualmente, los exopolisacáridos han recibido mucha atención por sus propiedades antibacterianas , antioxidantes y anticancerígenas , que conducen al desarrollo de candidatos farmacéuticos prometedores. [13] [14] Dado que los exopolisacáridos se liberan en el medio de cultivo, se pueden recuperar y purificar fácilmente. [15] En un capítulo del libro de referencia se discutieron diferentes estrategias utilizadas para la extracción económica y otros procesamientos posteriores. [16]
Los minerales, resultado de los procesos de biomineralización regulados por el medio ambiente o las bacterias, también son componentes esenciales de los exopolisacáridos. Proporcionan integridad estructural a la matriz del biofilm y actúan como un andamio para proteger a las células bacterianas de las fuerzas de corte y los productos químicos antimicrobianos. [17] Se descubrió que los minerales en EPS contribuyen a la morfogénesis de las bacterias y la integridad estructural de la matriz. Por ejemplo, en los biofilms de Bacillus subtilis , Mycobacterium smegmatis y Pseudomonas aeruginosa , la calcita ( CaCO 3 ) contribuye a la integridad de la matriz. Los minerales también se asocian con condiciones médicas. En los biofilms de Proteus mirabilis , Proteus vulgaris y Providencia rettgeri , los minerales calcio y magnesio causan incrustaciones en el catéter. [18]
Una revisión de 2013 describió polisacáridos sulfatados sintetizados por 120 microalgas marinas, la mayoría de las cuales son EPS. Estos heteropolímeros consisten principalmente en galactosa , glucosa y xilosa en diferentes proporciones excepto los de Gyrodinium impudicum , que son homopolímeros. [19] La mayoría de los EPS de las cianobacterias también son heteropolímeros aniónicos complejos que contienen de seis a diez monosacáridos diferentes, uno o más ácidos urónicos y varios sustituyentes funcionales como metilo, acetato, piruvato, grupos sulfato y proteínas. [20] Por ejemplo, los EPS de Arthrospira platensis son heteropolímeros con fracciones de proteína (55%) y una composición polisacárida compleja, que contiene siete azúcares neutros: glucosa, ramnosa, fructosa, galactosa, xilosa, arabinosa y manosa, así como dos ácidos urónicos, ácido galacturónico y ácido glucurónico. [21]
Dunaliella salina es un alga verde unicelular con una excepcional tolerancia a la halotolerancia . [22] El estrés salino induce la secreción de sustancias poliméricas extracelulares de D. salina . Se especula que la liberación de mezclas complejas de polielectrolitos macromoleculares con un alto contenido de polisacáridos contribuye a la estrategia de supervivencia de D. salina en concentraciones de sal variables. Se detectaron cuatro monosacáridos (galactosa, glucosa, xilosa y fructosa) en el hidrolizado de EPS de D. salina bajo estrés salino. [23] [24] Por el contrario, los polisacáridos solubles en agua liberados por Chlorella pyrenoidosa contienen galactosa, arabinosa , manosa , ribosa , xilosa, fucosa y ramnosa ; su liberación depende de la actividad fotosintética celular y del estado reproductivo. [25]
Aunque los EPS de microalgas tienen muchas aplicaciones potenciales, su bajo rendimiento es una de las principales limitaciones para su escalado en la industria. El tipo y la cantidad de EPS obtenidos a partir de un determinado cultivo de microalgas dependen de varios factores, como el diseño del sistema de cultivo, las condiciones nutricionales y de cultivo, así como el proceso de recuperación y purificación. Por lo tanto, la configuración y optimización de los sistemas de producción son fundamentales para el desarrollo futuro de aplicaciones.
Algunos ejemplos de aumento exitoso del rendimiento de EPS incluyen:
Se sugirió que los co-cultivos de microalgas y otros microorganismos se pueden utilizar de manera más universal como una tecnología para aumentar la producción de EPS, ya que los microorganismos pueden responder a los socios de interacción secretando EPS como una estrategia durante condiciones desfavorables. [29] [30]

Las exoenzimas son enzimas secretadas por microorganismos, como bacterias y hongos , para funcionar fuera de sus células. Estas enzimas son fundamentales para descomponer moléculas grandes del entorno en otras más pequeñas que los microorganismos pueden absorber (transportar a sus células) y utilizar para crecer y obtener energía.
Varios estudios han demostrado que la actividad de las enzimas extracelulares en la ecología microbiana acuática es de origen algal. [31] [32] Estas exoenzimas liberadas por las microalgas incluyen fosfatasas alcalinas , quitinasas , β-d-glucosidasas , proteasas , etc. y pueden influir en el crecimiento de microorganismos, la señalización química y el ciclo biogeoquímico en los ecosistemas. [33] El estudio de estas exoenzimas puede ayudar a optimizar la estrategia de suplementos nutricionales en la acuicultura. Sin embargo, solo se aislaron y purificaron algunas de las enzimas. En la literatura citada se destacan clases de enzimas destacadas seleccionadas. [34]
Se ha descubierto que las microalgas verdes Chlamydomonas coccoides y Dunaliella sp. [35] y Chlorella sphaerkii (una clorofita marina unicelular) producen proteasas extracelulares. [35] La diatomea Chaetoceros didymus libera cantidades sustanciales de proteasas al medio, esta producción es inducida por la presencia de la bacteria lítica Kordia algicida y está relacionada con la resistencia de esta alga contra los efectos de esta bacteria. [36] Algunas proteasas son de importancia funcional en los ciclos de vida virales, por lo que son objetivos atractivos para el desarrollo de fármacos . [37]
Las ficobiliproteínas son proteínas solubles en agua que captan la luz y que producen las cianobacterias y varias algas. Estos pigmentos se han estudiado como marcadores fluorescentes, colorantes alimentarios, cosméticos y agentes de diagnóstico inmunológico. La mayoría de estos pigmentos se sintetizan y acumulan intracelularmente. Como excepción, las cianobacterias Oscillatoria y Scytonema sp. liberan una proteína extracelular similar a la ficoeritrina de 250 kDa. Este pigmento inhibe el crecimiento de las algas verdes Chlorella fusca y Chlamydomonas y puede utilizarse potencialmente como alguicida. [38]
Los fenoles son un grupo importante de ecotoxinas debido a su toxicidad y persistencia. [39] Muchos microorganismos pueden degradar contaminantes aromáticos y utilizarlos como fuente de energía, [40] y la capacidad de las microalgas para degradar una multitud de compuestos aromáticos, incluidos los compuestos fenólicos, es cada vez más reconocida. Algunas microalgas, incluidas Chlamydomonas sp., Chlorella sp., Scenedesmus sp. y Anabaena sp., pueden degradar varios fenoles como pentaclorofenol, p -nitrofenol y ácidos naftalenosulfónicos. [41] [42] Aunque las vías de degradación metabólica no se comprenden completamente, las enzimas que incluyen la fenoloxidasa lacasa (EC 1.10.3.2) y enzimas similares a lacasa están involucradas en la oxidación de sustratos aromáticos. [40] [43] [44] Estas exoenzimas pueden aplicarse potencialmente en la degradación ambiental de contaminantes fenólicos.
Los inhibidores de proteasas son una clase de compuestos que inhiben la actividad de las proteasas (enzimas responsables de la ruptura de los enlaces peptídicos en las proteínas ). Estos inhibidores son cruciales en diversos procesos biológicos y aplicaciones terapéuticas, ya que las proteasas desempeñan papeles clave en numerosas funciones fisiológicas, entre ellas la digestión, la respuesta inmunitaria, la coagulación sanguínea y la señalización celular.
Un inhibidor de la proteasa de cisteína extracelular, ECPI-2, se purificó a partir del medio de cultivo de Chlorella sp. El inhibidor tuvo un efecto inhibidor contra la actividad proteolítica de la papaína , ficina y quimopapaína . ECPI-2 contiene 33,6% de residuos de carbohidratos que pueden ser responsables de la estabilidad de la enzima en condiciones neutras o ácidas. Estas proteínas inhibidoras de Chlorella pueden sintetizarse para proteger a las células de ataques de, por ejemplo, virus o herbívoros. [45] En comparación con los compuestos orgánicos, los fármacos peptídicos tienen una toxicidad relativamente baja para el cuerpo humano. El desarrollo de inhibidores peptídicos como fármacos es, por tanto, un tema de investigación atractivo en la química médica actual. [46] Los inhibidores de la proteasa son agentes atractivos en el tratamiento de enfermedades específicas; por ejemplo, la elastasa es de importancia crítica en enfermedades como el enfisema pulmonar , lo que motiva una mayor investigación sobre los inhibidores de la proteasa de microalgas como valiosas estructuras principales en el desarrollo farmacéutico. [47]
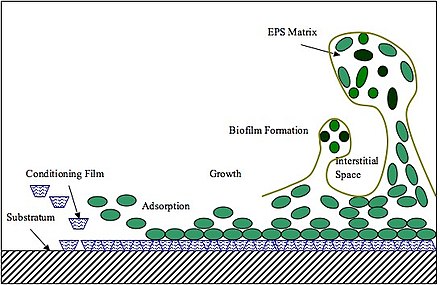
El primer paso en la formación de biopelículas es la adhesión. La adhesión bacteriana inicial a las superficies implica las interacciones adhesina-receptor. Ciertos polisacáridos, lípidos y proteínas en la matriz funcionan como agentes adhesivos. Los EPS también promueven la cohesión célula-célula (incluido el reconocimiento entre especies) para facilitar la agregación microbiana y la formación de biopelículas. [48] En general, la matriz basada en EPS media el ensamblaje de biopelículas de la siguiente manera. Primero, la formación de EPS tiene lugar en el sitio de adhesión, se producirá en superficies bacterianas o se secretará en la superficie de unión y formará una matriz polimérica inicial que promueve la colonización microbiana y el agrupamiento celular. A continuación, la producción continua de EPS expande aún más la matriz en 3 dimensiones mientras se forma un núcleo de células bacterianas. El núcleo bacteriano proporciona un marco de soporte y facilita el desarrollo de agrupaciones 3D y la agregación de microcolonias. [49] Estudios sobre P. aeruginosa , B. subtilis , V. cholerae y S. mutans sugirieron que la transición desde la agrupación celular inicial a la microcolonia parece estar conservada entre diferentes organismos modelo formadores de biopelículas. [49] Como ejemplo, S. mutans produce exoenzimas, llamadas glucosiltransferasas (Gtfs), que sintetizan glucanos in situ utilizando azúcares de la dieta del huésped como sustratos. Las Gtfs incluso se unen a las bacterias que no sintetizan Gtfs y, por lo tanto, facilitan la coadhesión entre especies y entre reinos. [50]
Posteriormente, a medida que se establece la biopelícula, el EPS proporciona estabilidad física y resistencia a la eliminación mecánica, a los antimicrobianos y a la inmunidad del huésped. Los exopolisacáridos y el ADN ambiental (eDNA) contribuyen a la viscoelasticidad de las biopelículas maduras, de modo que el desprendimiento de la biopelícula del sustrato será un desafío incluso bajo una tensión de corte de fluido sostenida o una alta presión mecánica. [51] Además de la resistencia mecánica, el EPS también promueve la protección contra los antimicrobianos y una mayor tolerancia a los fármacos. [52] Los antimicrobianos no pueden difundirse a través de la barrera del EPS, lo que da como resultado un acceso limitado de los fármacos a las capas más profundas de la biopelícula. [53] Además, los agentes cargados positivamente se unirán al EPS cargado negativamente, lo que contribuye a la tolerancia antimicrobiana de las biopelículas y permite la inactivación o degradación de los antimicrobianos por las enzimas presentes en la matriz de la biopelícula. El EPS también funciona como reservorio local de nutrientes de varias biomoléculas, como los polisacáridos fermentables. [54] Un estudio sobre V. cholerae en 2017 sugirió que debido a las diferencias de presión osmótica en las biopelículas de V. cholerae , las colonias microbianas se hinchan físicamente, maximizando así su contacto con superficies nutritivas y, por lo tanto, la absorción de nutrientes. [55]
El EPS se encuentra en la matriz de otras biopelículas microbianas, como las biopelículas de microalgas . La formación de la biopelícula y la estructura del EPS comparten muchas similitudes con las bacterianas. La formación de la biopelícula comienza con la absorción reversible de células flotantes a la superficie. Seguido de la producción de EPS, la adsorción se volverá irreversible. El EPS colonizará las células en la superficie con enlaces de hidrógeno. La replicación de los colonizadores tempranos se verá facilitada por la presencia de moléculas orgánicas en la matriz que proporcionarán nutrientes a las células de las algas. A medida que los colonizadores se reproducen, la biopelícula crece y se convierte en una estructura tridimensional. [56] Las biopelículas de microalgas constan de un 90% de EPS y un 10% de células de algas. El EPS de algas tiene componentes similares al bacteriano; está formado por proteínas, fosfolípidos, polisacáridos, ácidos nucleicos, sustancias húmicas, ácidos urónicos y algunos grupos funcionales, como los grupos fosfórico, carboxílico, hidroxilo y amino. Las células de algas consumen EPS como fuente de energía y carbono. [57] Además, los EPS los protegen de la deshidratación y refuerzan la adhesión de las células a la superficie. En las biopelículas de algas, los EPS tienen dos subcategorías: los EPS solubles (sEPS) y los EPS ligados (bEPS), siendo los primeros los que se distribuyen en el medio y los segundos los que se adhieren a las células de las algas. [58] Los EPS ligados se pueden subdividir en EPS fuertemente ligados (TB-EPS) y EPS débilmente ligados (LB-EPS). Varios factores contribuyen a la composición de los EPS, entre ellos la especie, el tipo de sustrato, la disponibilidad de nutrientes, la temperatura, el pH y la intensidad de la luz. [59]
Los exopolisacáridos pueden facilitar la unión de bacterias fijadoras de nitrógeno a las raíces de las plantas y las partículas del suelo, lo que media una relación simbiótica . [60] Esto es importante para la colonización de las raíces y la rizosfera , que es un componente clave de las redes alimentarias del suelo y el ciclo de nutrientes en los ecosistemas . También permite una invasión e infección exitosas de la planta huésped . [60] Las sustancias poliméricas extracelulares bacterianas pueden ayudar en la biorremediación de metales pesados , ya que tienen la capacidad de adsorber cationes metálicos, entre otras sustancias disueltas . [61] Esto puede ser útil en el tratamiento de sistemas de aguas residuales , ya que las biopelículas pueden unirse y eliminar metales como el cobre , el plomo , el níquel y el cadmio . [61] La afinidad de unión y la especificidad del metal de los EPS varían, dependiendo de la composición del polímero, así como de factores como la concentración y el pH . [61] En un contexto geomicrobiológico , se ha observado que los EPS afectan la precipitación de minerales, particularmente carbonatos . [62] Los EPS también pueden unirse y atrapar partículas en suspensiones de biopelículas, lo que puede restringir la dispersión y el ciclo de los elementos. [62] La estabilidad de los sedimentos puede aumentarse mediante EPS, ya que influye en la cohesión , la permeabilidad y la erosión del sedimento. [62] Existe evidencia de que la capacidad de adhesión y unión de metales de los EPS afecta las tasas de lixiviación de minerales tanto en contextos ambientales como industriales. [62] Estas interacciones entre los EPS y el entorno abiótico permiten que los EPS tengan un gran impacto en el ciclo biogeoquímico . Las interacciones depredador-presa entre las biopelículas y los bacterívoros , como el nematodo que habita en el suelo Caenorhabditis elegans , se han estudiado ampliamente. A través de la producción de una matriz pegajosa y la formación de agregados, las biopelículas de Yersinia pestis pueden impedir la alimentación al obstruir la boca de C. elegans . [63]Además, las biopelículas de Pseudomonas aeruginosa pueden impedir la movilidad deslizante de C. elegans , denominada " fenotipo de pantano ", lo que da como resultado que C. elegans quede atrapado dentro de las biopelículas y evite la exploración de los nematodos para alimentarse de biopelículas susceptibles. [64] Esto redujo significativamente la capacidad del depredador para alimentarse y reproducirse, promoviendo así la supervivencia de las biopelículas.
Los exopolisacáridos capsulares pueden proteger a las bacterias patógenas contra la desecación y la depredación , y contribuir a su patogenicidad . [60] Las bacterias sésiles fijadas y agregadas en biopelículas son menos vulnerables en comparación con las bacterias planctónicas a la deriva , ya que la matriz de EPS puede actuar como una barrera de difusión protectora. [65] Las características físicas y químicas de las células bacterianas pueden verse afectadas por la composición de EPS, lo que influye en factores como el reconocimiento celular, la agregación y la adhesión en sus entornos naturales. [65]
Hasta ahora, la producción de microalgas industriales a partir de biomasa se ha aplicado ampliamente en campos que van desde alimentos y piensos hasta productos químicos de alto valor para aplicaciones farmacéuticas y ecológicas. [66] [67] [68]
Aunque el cultivo comercial de microalgas se ha vuelto cada vez más popular, solo la biomasa de algas se procesa para obtener los productos actuales, mientras que grandes volúmenes de medios libres de algas no se explotan en cultivos de flujo continuo y después de la cosecha de biomasa de cultivos por lotes. El reciclaje de medios para ahorrar costos de cultivo enfrenta el gran riesgo de inhibición del crecimiento. Grandes volúmenes de medios usados dan lugar a contaminación ambiental y costos de suministro de agua y nutrición en el cultivo cuando los medios se descartan directamente al medio ambiente. Por lo tanto, la aplicación de métodos de reciclaje motivados por la generación simultánea de productos de alto valor a partir de medios usados tiene potencial desde perspectivas comerciales y ambientales. [29]
En las industrias nutracéuticas, Arthrospira ( Spirulina ) y Chlorella son las especies más importantes en la comercialización como alimentos saludables y suplementos nutricionales con varios beneficios para la salud, incluyendo la mejora de la actividad del sistema inmunológico, efectos antitumorales y promoción del crecimiento animal, debido a sus abundantes proteínas, vitaminas, polisacáridos activos y otros compuestos importantes. [69] Los carotenoides de microalgas, con β-caroteno de Dunaliella y astaxantina de Haematococcus, se producen comercialmente en procesos a gran escala. Los productos derivados de microalgas se desarrollan actualmente con éxito para su uso en cosméticos y productos farmacéuticos. [70] [71] Los ejemplos incluyen los polisacáridos de cianobacterias utilizados en productos de cuidado personal de la piel y extractos de Chlorella sp. que contienen oligopéptidos que pueden promover la firmeza de la piel. [72] En las industrias farmacéuticas se han identificado candidatos a fármacos con actividades antiinflamatorias, anticancerígenas y antiinfecciosas. [73] Por ejemplo, la adenosina de Phaeodactylum tricornutum puede actuar como un agente antiarrítmico para el tratamiento de la taquicardia y el metabolito del alga verde caulerpin aparece en estudios de actividades antituberculosas. [74] [75]
Además, algunos polisacáridos extracelulares de microalgas tienen diversas bioactividades que incluyen actividad antitumoral, antiinflamatoria y antiviral, lo que ofrece perspectivas prometedoras para aplicaciones farmacéuticas. [76]
Las microalgas como Isochrysis galbana, Nannochlor opsisoculata , Chaetoceros muelleri , Chaetoceros gracilis y P. tricornutum se han utilizado durante mucho tiempo en la acuicultura como fuentes de alimento directo o indirecto en criaderos para proporcionar excelentes condiciones nutricionales para los juveniles tempranos de peces, mariscos y camarones de cultivo. [77] [78]
Además, la capa de EPS actúa como una trampa de nutrientes, facilitando el crecimiento bacteriano . [65] Los exopolisacáridos de algunas cepas de bacterias del ácido láctico , por ejemplo, Lactococcus lactis subsp. cremoris , aportan una textura gelatinosa a los productos lácteos fermentados (por ejemplo, Viili ), y estos polisacáridos también son digeribles. [79] [80] Un ejemplo del uso industrial de los exopolisacáridos es la aplicación de dextrano en el panettone y otros panes de la industria de la panadería. [81]
La B. subtilis ha ganado interés por sus propiedades probióticas debido a su biopelícula que le permite mantener eficazmente un microambiente favorable en el tracto gastrointestinal. Para sobrevivir al paso por el tracto gastrointestinal superior, la B. subtilis produce una matriz extracelular que la protege de entornos estresantes como el ambiente altamente ácido del estómago. [82]
La producción de microalgas oleaginosas se está volviendo atractiva como fuente alternativa de biocombustibles con potencial para satisfacer la demanda mundial de bioenergía renovable. [83] La recuperación mejorada de petróleo (EOR) utilizando biopolímeros extracelulares de microalgas puede ser un futuro campo de aplicación. [84]
En los últimos años, se ha descubierto que los azúcares EPS de las bacterias marinas aceleran la limpieza de los derrames de petróleo. [85] Durante el derrame de petróleo de Deepwater Horizon en 2010, estas bacterias productoras de EPS pudieron crecer y multiplicarse rápidamente. [85] Más tarde se descubrió que sus azúcares EPS disolvieron el petróleo y formaron agregados de petróleo en la superficie del océano, lo que aceleró el proceso de limpieza. [85] Estos agregados de petróleo también proporcionaron una valiosa fuente de nutrientes para otras comunidades microbianas marinas. Esto permitió a los científicos modificar y optimizar el uso de azúcares EPS para limpiar derrames de petróleo . [85]
Durante el crecimiento, las microalgas producen y secretan metabolitos como acetato o glicerol en el medio. [86] Los metabolitos extracelulares (EM) de las microalgas tienen importantes significados ecológicos. Por ejemplo, las microalgas marinas liberan una gran cantidad de sustancias orgánicas disueltas (DOS), que sirven como fuentes de energía para los heterótrofos en interacciones simbióticas entre algas y bacterias. [87] Las excreciones en el espacio pericelular determinan, en gran medida, el curso de las interacciones alelopáticas entre las microalgas y otros microorganismos. [88] Algunos compuestos alelopáticos de las microalgas se utilizan como herbicidas respetuosos con el medio ambiente o agentes de biocontrol con perspectivas directas para su uso biotecnológico. [89]
En B. subtilis , se ha demostrado que el componente de la matriz proteica, TasA, y el exopolisacárido son esenciales para una colonización eficaz de las raíces de las plantas de Arabidopsis y tomate. [52] También se sugirió que TasA desempeña un papel importante en la mediación de la agregación entre especies con estreptococos. [90]
Debido a la creciente necesidad de encontrar una alternativa más eficiente y respetuosa con el medio ambiente a los métodos convencionales de eliminación de residuos, las industrias están prestando más atención a la función de las bacterias y sus azúcares EPS en la biorremediación . [91]
Los investigadores encontraron que agregar azúcares EPS de cianobacterias a las aguas residuales elimina metales pesados como cobre , cadmio y plomo . [91] Los azúcares EPS por sí solos pueden interactuar físicamente con estos metales pesados y absorberlos a través de la biosorción . [91] La eficiencia de eliminación se puede optimizar tratando los azúcares EPS con diferentes ácidos o bases antes de agregarlos a las aguas residuales. [91] Algunos suelos contaminados contienen altos niveles de hidrocarburos aromáticos policíclicos (HAP); los EPS de la bacteria Zoogloea sp . y el hongo Aspergillus niger son eficientes para eliminar estos compuestos tóxicos. [92] Los EPS contienen enzimas como la oxidorreductasa y la hidrolasa , que son capaces de degradar los HAP. [92] La cantidad de degradación de HAP depende de la concentración de EPS agregados al suelo. Este método demuestra ser de bajo costo y altamente eficiente. [92]
La aplicación de nanopartículas (NP) es una de las técnicas prometedoras más novedosas para atacar las biopelículas debido a su alta relación superficie-volumen, su capacidad para penetrar en las capas más profundas de las biopelículas y la capacidad de liberar agentes antimicrobianos de forma controlada. El estudio de las interacciones NP-EPS podría proporcionar una comprensión más profunda sobre cómo desarrollar nanopartículas más efectivas. [3] Se han desarrollado nanotransportadores de "liberación inteligente" que pueden penetrar en las biopelículas y ser activados por microambientes patógenos para administrar medicamentos o compuestos multifuncionales, como nanopartículas catalíticas para aptámeros, dendrímeros y péptidos bioactivos) para alterar las EPS y la viabilidad o actividad metabólica de las bacterias incrustadas. Algunos factores que alterarían los potenciales de las NP para transportar agentes antimicrobianos al interior de la biopelícula incluyen las interacciones fisicoquímicas de las NP con los componentes de las EPS, las características de los espacios de agua (poros) dentro de la matriz de las EPS y la viscosidad de la matriz de las EPS. [93] El tamaño y las propiedades de la superficie (carga y grupos funcionales) de las nanopartículas son los principales determinantes de la penetración y la interacción con los EPS. [3] Otra posible estrategia antibiofilm es la terapia con fagos. Se ha sugerido que los bacteriófagos, virus que invaden células huésped bacterianas específicas, son agentes eficaces para penetrar en los biofilms. [18] Para alcanzar la máxima eficacia para erradicar los biofilms, las estrategias terapéuticas deben dirigirse tanto a los componentes de la matriz del biofilm como a los microorganismos incrustados para dirigirse al complejo microambiente del biofilm. [18]
Este artículo incorpora texto de Lu Liu, Georg Pohnert y Dong Wei disponible bajo la licencia CC BY 4.0.