

La germinación es el proceso por el cual un organismo crece a partir de una semilla o espora . El término se aplica al brote de una plántula a partir de una semilla de una angiosperma o gimnosperma , al crecimiento de una espora a partir de una espora , como las esporas de hongos , helechos, bacterias , y al crecimiento del tubo polínico a partir del grano de polen de una planta con semillas .


.jpg/440px-Raapstelen_gekiemde_zaden_(Brassica_campestris_germinating_seeds).jpg)
La germinación es, por lo general, el crecimiento de una planta contenida dentro de una semilla que da lugar a la formación de la plántula. También es el proceso de reactivación de la maquinaria metabólica de la semilla que da lugar a la aparición de la radícula y la plúmula . La semilla de una planta vascular es un pequeño paquete producido en un fruto o cono tras la unión de las células reproductoras masculinas y femeninas . Todas las semillas completamente desarrolladas contienen un embrión y, en la mayoría de las especies vegetales, algún depósito de reservas alimenticias, envuelto en una cubierta seminal. Las semillas latentes son semillas viables que no germinan porque requieren estímulos internos o ambientales específicos para reanudar su crecimiento. En condiciones adecuadas, la semilla comienza a germinar y el embrión reanuda su crecimiento, desarrollándose hasta convertirse en una plántula. [ aclaración necesaria ]

La alteración del suelo puede provocar un crecimiento vigoroso de las plantas al exponer las semillas que ya se encuentran en el suelo a cambios en los factores ambientales, cuando la germinación puede haberse visto inhibida previamente por la profundidad de las semillas o por un suelo demasiado compacto. Esto se observa a menudo en las tumbas después de un entierro. [1]
La germinación de las semillas depende de condiciones internas y externas. Los factores externos más importantes incluyen la temperatura adecuada , el agua , el oxígeno o el aire y, a veces, la luz o la oscuridad . [2] Varias plantas requieren diferentes variables para una germinación exitosa de las semillas. A menudo, esto depende de la variedad de semilla individual y está estrechamente relacionado con las condiciones ecológicas del hábitat natural de una planta . Para algunas semillas, su futura respuesta de germinación se ve afectada por las condiciones ambientales durante la formación de la semilla; la mayoría de las veces, estas respuestas son tipos de latencia de la semilla .
La mayoría de las hortalizas anuales más comunes tienen temperaturas de germinación óptimas entre 24 y 32 °C (75 y 90 °F), aunque muchas especies (por ejemplo, los rábanos o las espinacas ) pueden germinar a temperaturas significativamente más bajas, tan bajas como 4 °C (40 °F), lo que permite cultivarlas a partir de semillas en climas más fríos. Las temperaturas subóptimas dan lugar a tasas de éxito más bajas y a períodos de germinación más prolongados.

Algunas semillas vivas están en estado latente y necesitan más tiempo y/o deben estar sujetas a condiciones ambientales específicas antes de que germinen. La latencia de la semilla puede originarse en diferentes partes de la semilla, por ejemplo, dentro del embrión; en otros casos, está involucrada la cubierta de la semilla. La ruptura de la latencia a menudo implica cambios en las membranas, iniciados por señales de ruptura de la latencia. Esto generalmente ocurre solo dentro de las semillas hidratadas. [6] Los factores que afectan la latencia de la semilla incluyen la presencia de ciertas hormonas vegetales, en particular el ácido abscísico , que inhibe la germinación, y la giberelina , que termina la latencia de la semilla. En la elaboración de cerveza , las semillas de cebada se tratan con giberelina para asegurar una germinación uniforme de las semillas para la producción de malta de cebada . [2]
En algunas definiciones, la aparición de la radícula marca el final de la germinación y el comienzo del "establecimiento", un período en el que se utilizan las reservas de alimentos almacenadas en la semilla. La germinación y el establecimiento como organismo independiente son fases críticas en la vida de una planta, cuando son más vulnerables a las lesiones, las enfermedades y el estrés hídrico. [2] El índice de germinación se puede utilizar como indicador de fitotoxicidad en los suelos. La mortalidad entre la dispersión de las semillas y la finalización del establecimiento puede ser tan alta que muchas especies se han adaptado para producir grandes cantidades de semillas. [ cita requerida ]

En agricultura y jardinería , la tasa de germinación describe cuántas semillas de una especie , variedad o lote de semillas de una planta en particular es probable que germinen durante un período determinado. Es una medida del tiempo de germinación y generalmente se expresa como un porcentaje, por ejemplo, una tasa de germinación del 85% indica que aproximadamente 85 de cada 100 semillas probablemente germinarán en condiciones adecuadas durante el período de germinación dado. La tasa de germinación de las semillas está determinada por la composición genética de las semillas, las características morfológicas y los factores ambientales. [ cita requerida ] La tasa de germinación es útil para calcular la cantidad de semillas necesarias para un área determinada o una cantidad deseada de plantas. Para los fisiólogos y científicos de semillas, la "tasa de germinación" es el recíproco del tiempo que tarda el proceso de germinación en completarse a partir del momento de la siembra . Por otro lado, la cantidad de semillas capaces de completar la germinación en una población (es decir, lote de semillas) se conoce como capacidad de germinación .
La salinidad del suelo es uno de los factores de estrés que pueden limitar la tasa de germinación. El estrés ambiental activa algunas actividades relacionadas con el estrés [CuZn- superóxido dismutasa (SOD), Mn-SOD, L-ascorbato oxidasa (AO), ADN polimerasa Delta 1 (POLD)-1, Chaperon (CHAPE) y proteína de choque térmico (HSP)-21], la estabilidad de la plantilla genética y la activación de pigmentos fotosintéticos. [7] La aplicación de glutamina exógena limita este proceso. Las investigaciones realizadas en semillas de cebolla muestran una reducción en el tiempo medio de germinación, un aumento en el coeficiente de velocidad de germinación, el índice de germinación y el porcentaje de germinación después de la administración de glutamina exógena a las plantas. [7]
La calidad de las semillas se deteriora con la edad, y esto está asociado con la acumulación de daño genómico. [8] Durante la germinación, se activan procesos de reparación para lidiar con el daño acumulado en el ADN . [9] En particular, se pueden reparar roturas de cadena simple y doble en el ADN. [10] La quinasa de punto de control de daño del ADN ATM tiene un papel importante en la integración de la progresión a través de la germinación con respuestas de reparación a los daños del ADN acumulados por la semilla envejecida. [11]

La parte de la planta que emerge primero de la semilla es la raíz embrionaria, llamada radícula o raíz primaria. Permite que la plántula se ancle en el suelo y comience a absorber agua. Después de que la raíz absorbe agua, emerge un brote embrionario de la semilla. Este brote consta de tres partes principales: los cotiledones (hojas de la semilla), la sección del brote debajo de los cotiledones ( hipocótilo ) y la sección del brote encima de los cotiledones ( epicótilo ). La forma en que emerge el brote difiere entre los grupos de plantas. [2]
La germinación epigea (o germinación epigea) es un término botánico que indica que la germinación se produce por encima del suelo. En la germinación epigea, el hipocótilo se alarga y forma un gancho, tirando en lugar de empujar los cotiledones y el meristemo apical a través del suelo. Una vez que llega a la superficie, se endereza y tira de los cotiledones y la punta de los brotes de las plántulas en crecimiento hacia el aire. Los frijoles , el tamarindo y la papaya son ejemplos de plantas que germinan de esta manera. [2]
La germinación también puede realizarse por germinación hipogea (o germinación hipogea), donde el epicótilo se alarga y forma el gancho. En este tipo de germinación, los cotiledones quedan bajo tierra donde finalmente se descomponen. Los guisantes, los garbanzos y el mango, por ejemplo, germinan de esta manera. [12]
En las semillas de las monocotiledóneas , la radícula y el cotiledón del embrión están cubiertos por una coleorriza y un coleóptilo , respectivamente. La coleorriza es la primera parte que crece fuera de la semilla, seguida por la radícula. Luego, el coleóptilo es empujado hacia arriba a través del suelo hasta que alcanza la superficie. Allí, deja de alargarse y surgen las primeras hojas. [2]
Cuando una semilla germina sin pasar por las cuatro etapas de desarrollo de la semilla, es decir, etapa globular, forma de corazón, forma de torpedo y etapa cotiledonal, se conoce como germinación precoz. [ cita requerida ]
Otro evento de germinación durante el ciclo de vida de las gimnospermas y las plantas con flores es la germinación de un grano de polen después de la polinización . Al igual que las semillas, los granos de polen se deshidratan severamente antes de ser liberados para facilitar su dispersión de una planta a otra. Consisten en una capa protectora que contiene varias células (hasta 8 en las gimnospermas, 2-3 en las plantas con flores). Una de estas células es una célula tubular. Una vez que el grano de polen aterriza en el estigma de una flor receptiva (o un cono femenino en las gimnospermas), absorbe agua y germina. La germinación del polen se facilita por la hidratación en el estigma, así como por la estructura y fisiología del estigma y el estilo. [2] El polen también puede ser inducido a germinar in vitro (en una placa de Petri o un tubo de ensayo). [13] [14]
Durante la germinación, la célula del tubo se alarga hasta convertirse en un tubo polínico . En la flor, el tubo polínico crece hacia el óvulo , donde descarga el esperma producido en el grano de polen para la fertilización. El grano de polen germinado con sus dos células espermáticas es el microgametofito masculino maduro de estas plantas. [2]
Dado que la mayoría de las plantas tienen órganos reproductores masculinos y femeninos en sus flores, existe un alto riesgo de autopolinización y, por lo tanto, de endogamia . Algunas plantas utilizan el control de la germinación del polen como una forma de prevenir esta autopolinización. La germinación y el crecimiento del tubo polínico implican una señalización molecular entre el estigma y el polen. En la autoincompatibilidad en plantas , el estigma de ciertas plantas puede reconocer molecularmente el polen de la misma planta y evitar que germine. [15]
La germinación también puede referirse a la aparición de células a partir de esporas en reposo y al crecimiento de hifas o talos esporulados a partir de esporas en hongos , algas y algunas plantas.
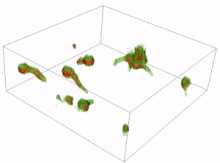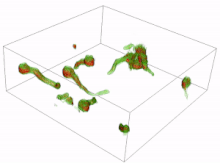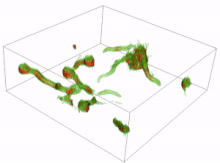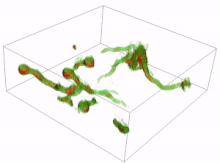
Los conidios son esporas de hongos que se reproducen asexualmente (sin la fusión de gametos) y germinan en condiciones específicas. A partir de los conidios que germinan se pueden formar diversas células. Las más comunes son los tubos germinativos que crecen y se desarrollan hasta convertirse en hifas. La formación inicial y la posterior elongación del tubo germinativo en el hongo Aspergillus niger se han capturado en 3D mediante microscopía holográfica . Otro tipo de célula es el tubo de anastomosis conidial (CAT); estos se diferencian de los tubos germinativos en que son más delgados, más cortos, carecen de ramas, presentan un crecimiento determinado y se dirigen uno hacia el otro. Cada célula tiene forma tubular, pero el tubo de anastomosis conidial forma un puente que permite la fusión entre conidios. [16] [17]
En las esporas en reposo , la germinación implica el agrietamiento de la pared celular gruesa de la espora latente. Por ejemplo, en los zigomicetos , el zigosporangio de pared gruesa se agrieta y la zigospora en su interior da lugar al esporangióforo emergente. En los mohos mucilaginosos , la germinación se refiere al surgimiento de células ameboides a partir de la espora endurecida. Después de agrietarse la capa de la espora, el desarrollo posterior implica la división celular, pero no necesariamente el desarrollo de un organismo multicelular (por ejemplo, en las amebas de vida libre de los mohos mucilaginosos). [2]
En plantas como las briofitas , los helechos y algunas otras, las esporas germinan en gametofitos independientes . En las briofitas (por ejemplo, musgos y hepáticas ), las esporas germinan en protonemas , similares a las hifas de los hongos, a partir de las cuales crece el gametofito. En los helechos , los gametofitos son pequeños prótalos en forma de corazón que a menudo se pueden encontrar debajo de una planta adulta que desprende esporas. [2]
Las esporas bacterianas pueden ser exosporas o endosporas , que son estructuras latentes producidas por varias bacterias diferentes. Tienen una actividad metabólica nula o muy baja y se forman en respuesta a condiciones ambientales adversas. [18] Permiten la supervivencia y no son una forma de reproducción. [19] En condiciones adecuadas, la espora germina para producir una bacteria viable. Las endosporas se forman dentro de la célula madre, mientras que las exosporas se forman en el extremo de la célula madre como un brote. [20]
Como se mencionó anteriormente, la luz puede ser un factor ambiental que estimula el proceso de germinación. La semilla debe poder determinar cuándo es el momento perfecto para germinar y lo hace detectando señales ambientales. Una vez que comienza la germinación, los nutrientes almacenados que se han acumulado durante la maduración comienzan a digerirse, lo que luego respalda la expansión celular y el crecimiento general. [21] Dentro de la germinación estimulada por la luz, el fitocromo B (PHYB) es el fotorreceptor responsable de las etapas iniciales de la germinación. Cuando hay luz roja, PHYB se convierte en su forma activa y se mueve del citoplasma al núcleo, donde regula positivamente la degradación de PIF1 . PIF1, factor de interacción con fitocromo 1, regula negativamente la germinación al aumentar la expresión de proteínas que reprimen la síntesis de giberelina (GA), una hormona importante en el proceso de germinación. [22] Otro factor que promueve la germinación es HFR1, que se acumula en la luz de alguna manera y forma heterodímeros inactivos con PIF1. [23]
Aunque no se conoce el mecanismo exacto, el óxido nítrico (NO) también desempeña un papel en esta vía. Se cree que el NO reprime la expresión del gen PIF1 y estabiliza HFR1 de alguna manera para apoyar el inicio de la germinación. [21] Bethke et al. (2006) expusieron semillas latentes de Arabidopsis al gas NO y en los siguientes 4 días, el 90% de las semillas rompieron la latencia y germinaron. Los autores también analizaron cómo el NO y el GA afectan el proceso de vacuolación de las células de aleurona que permiten el movimiento de nutrientes para ser digeridos. Un mutante de NO resultó en la inhibición de la vacuolación, pero cuando más tarde se agregó GA, el proceso se activó nuevamente, lo que llevó a la creencia de que el NO es anterior al GA en la vía. El NO también puede conducir a la disminución de la sensibilidad del ácido abscísico (ABA), una hormona vegetal en gran parte responsable de la latencia de las semillas. [24] El equilibrio entre GA y ABA es importante. Cuando los niveles de ABA son más altos que los de GA, eso conduce a semillas latentes y cuando los niveles de GA son más altos, las semillas germinan. [25] El cambio entre la latencia y la germinación de las semillas debe ocurrir en un momento en que la semilla tenga las mejores posibilidades de sobrevivir y una señal importante que inicia el proceso de germinación de la semilla y el crecimiento general de la planta es la luz. [ cita requerida ]
Un estudio extenso de las tasas de germinación de una gran variedad de semillas en diferentes condiciones experimentales, incluidas las variaciones de temperatura y el entorno químico.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )