Zygomycota , u hongos cigotos , es una antigua división o filo del reino Fungi . Los miembros ahora son parte de dos filos : Mucoromycota y Zoopagomycota . [1] Se conocen aproximadamente 1060 especies. [2] En su mayoría son de hábitat terrestre, viven en el suelo o en material vegetal o animal en descomposición. Algunos son parásitos de plantas, insectos y animales pequeños, mientras que otros forman relaciones simbióticas con plantas. [3] Las hifas de los zigomicetos pueden ser cenocíticas , formando septos solo donde se forman los gametos o para aislar las hifas muertas. Zygomycota ya no se reconoce porque no se creía que fuera verdaderamente monofilético . [1]

El nombre Zygomycota se refiere a los zigosporangios que forman característicamente los miembros de este clado, en los que se forman esporas esféricas resistentes durante la reproducción sexual . Zygos es la palabra griega para "unión" o " yugo ", en referencia a la fusión de dos hebras de hifas que produce estas esporas, y -mycota es un sufijo que se refiere a una división de hongos. [4]

El término "espora" se utiliza para describir una estructura relacionada con la propagación y dispersión. Las esporas de zigomicetos pueden formarse tanto por medios sexuales como asexuales. Antes de la germinación, la espora se encuentra en estado latente. Durante este período, la tasa metabólica es muy baja y puede durar desde unas pocas horas hasta muchos años. Existen dos tipos de latencia . La latencia exógena está controlada por factores ambientales como la temperatura o la disponibilidad de nutrientes. La latencia endógena o constitutiva depende de las características de la propia espora; por ejemplo, las características metabólicas. En este tipo de latencia, la germinación puede verse impedida incluso si las condiciones ambientales favorecen el crecimiento.
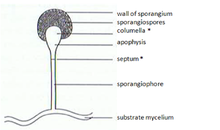
En los zigomicetos, las mitosporas (esporangiosporas) se forman asexualmente. Se forman en estructuras especializadas, los mitosporangios (esporangios), que contienen de unos pocos a varios miles de esporas, dependiendo de la especie. Los mitosporangios son transportados por hifas especializadas, los mitosporangióforos (esporangióforos). Estas hifas especializadas suelen mostrar gravitropismo negativo y fototropismo positivo, lo que permite una buena dispersión de las esporas. La pared de los esporangios es delgada y se destruye fácilmente por estímulos mecánicos (por ejemplo, gotas de lluvia que caen, animales que pasan), lo que lleva a la dispersión de las mitosporas maduras. Las paredes de estas esporas contienen esporopolenina en algunas especies. La esporopolenina se forma a partir de β-caroteno y es muy resistente a la degradación biológica y química. Las esporas de los zigomicetos también pueden clasificarse con respecto a su persistencia:
Las clamidosporas son esporas asexuales diferentes de las esporangiosporas. La función principal de las clamidosporas es la persistencia del micelio y se liberan cuando este se degrada. Las clamidosporas no tienen mecanismo de dispersión. En los zigomicetos la formación de clamidosporas suele ser intercalar, aunque también puede ser terminal. De acuerdo con su función las clamidosporas tienen una pared celular gruesa y están pigmentadas.
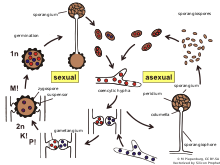
Los zigóforos son hifas aéreas quimiotrópicas que son los órganos sexuales de los zigomicetos, excepto en Phycomyces, en los que no son aéreas sino que se encuentran en el sustrato. Tienen dos tipos de apareamiento diferentes (+) y (-). Los tipos de apareamiento opuestos crecen uno hacia el otro debido a las feromonas volátiles emitidas por la hebra opuesta, principalmente ácido trispórico y sus precursores. Una vez que dos tipos de apareamiento opuestos han hecho contacto inicial, dan lugar a una zigospora a través de múltiples pasos.
Una vez que se ha producido el contacto entre los zigóforos, sus paredes se adhieren entre sí, se aplanan y luego el sitio de contacto se denomina tabique de fusión. Las puntas del zigóforo se distienden y forman lo que se denomina progametangios. Un tabique se desarrolla mediante una extensión gradual hacia adentro hasta que separa los gametangios terminales de la base progametangios. En este punto, el zigóforo se denomina suspensor. Las vesículas se acumulan en el tabique de fusión, momento en el que comienza a disolverse. Un poco antes de que el tabique de fusión se disuelva por completo, la pared externa primaria comienza a engrosarse. Esto se puede ver como manchas oscuras en la pared primaria a medida que el tabique de fusión se disuelve. Estas manchas oscuras en la pared eventualmente se convertirán en estructuras verrugosas que conforman el espesor de la pared de la zigófora. A medida que la zigófora se agranda, también lo hacen las estructuras verrugosas hasta que quedan contiguas alrededor de toda la célula. En este punto, la microscopía electrónica ya no puede penetrar la pared. Con el tiempo, las verrugas atraviesan la pared primaria y se oscurecen, lo que probablemente esté causado por la melanina .
La meiosis suele ocurrir antes de la germinación de la zigospora y existen algunos tipos principales de comportamiento nuclear diferenciables. El tipo 1 es cuando los núcleos se fusionan rápidamente, en unos pocos días, lo que da como resultado una zigospora madura con núcleos haploides . El tipo 2 es cuando algunos núcleos no se aparean y, en cambio, se degeneran; la meiosis se retrasa hasta la germinación. El tipo 3 es cuando los núcleos haploides continúan dividiéndose mitóticamente y luego algunos se asocian en grupos y otros no. Esto da como resultado que se encuentren núcleos diploides y haploides en el esporangio germinal .
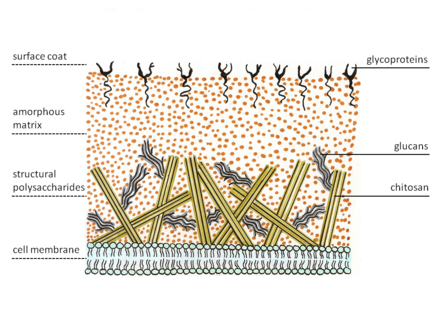
Los zigomicetos presentan una estructura especial de pared celular. La mayoría de los hongos tienen quitina como polisacárido estructural , mientras que los zigomicetos sintetizan quitosano , el homopolímero desacetilado de la quitina. La quitina está formada por N -acetilglucosamina unida mediante enlaces β-1,4. Las hifas fúngicas crecen en la punta. Por lo tanto, las vesículas especializadas, los quitosomas, llevan los precursores de la quitina y su enzima sintetizadora, la quitina sintetasa , al exterior de la membrana mediante exocitosis . La enzima de la membrana cataliza la formación de enlaces glucosídicos a partir del sustrato de azúcar nucleótido, uridina difosfo- N -acetil-D-glucosamina. La cadena de polisacárido naciente es entonces escindida por la enzima quitina desacetilasa . La enzima cataliza la escisión hidrolítica del grupo N -acetamido en la quitina. Después de esto, la cadena de polímero de quitosano forma microfibrillas. Estas fibras están incrustadas en una matriz amorfa que consiste en proteínas, glucanos (que supuestamente reticulan las fibras de quitosano), manoproteínas, lípidos y otros compuestos. [5] [6]
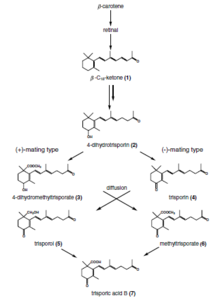
El ácido trispórico es un compuesto terpenoide C-18 que se sintetiza a través de las vías del β-caroteno y el retinol en los zigomicetos. Es un compuesto feromónico responsable de la diferenciación sexual en esas especies de hongos. [7]
El ácido trispórico fue descubierto en 1964 como un metabolito que causó una mayor producción de caroteno en Blakeslea trispora . Más tarde se demostró que era la hormona que provocó la producción de zigóforos en Mucor mucedo . [8] El micólogo y genetista estadounidense Albert Francis Blakeslee descubrió que algunas especies de Mucorales eran autoestériles ( heterotálicas ), en las que las interacciones de dos cepas, designadas (+) y (-), son necesarias para el inicio de la actividad sexual. Hans Burgeff de la Universidad de Goettingen descubrió que esta interacción se debía al intercambio de sustancias de bajo peso molecular que se difundían a través del sustrato y la atmósfera. Este trabajo constituyó la primera demostración de la actividad de las hormonas sexuales en cualquier hongo. La elucidación del control hormonal de la interacción sexual en los Mucorales se extiende a lo largo de 60 años e involucró a micólogos y bioquímicos de Alemania, Italia, los Países Bajos, el Reino Unido y los EE. UU. [8]
El reconocimiento de parejas sexuales compatibles en los zigomicetos se basa en una vía de biosíntesis cooperativa del ácido trispórico. Los primeros derivados trispóricos y el ácido trispórico inducen la hinchazón de dos hifas potenciales, llamadas por ello zigóforos, y un gradiente químico de estas moléculas inductoras da como resultado un crecimiento mutuo. Estos progametangios entran en contacto entre sí y forman una fuerte conexión. En la siguiente etapa, se establecen septos para limitar el desarrollo de la zigospora a partir del micelio vegetativo y de esta manera los zigóforos se convierten en hifas suspensoras y se forman los gametangios. Después de la disolución de la pared de fusión, el citoplasma y una gran cantidad de núcleos de ambos gametangios se mezclan. Un proceso de selección (no estudiado) da como resultado una reducción de los núcleos y tiene lugar la meiosis (también sin estudiar hasta ahora). Se producen varias modificaciones de la pared celular, así como la incorporación de esporopolenina (responsable del color oscuro de las esporas), dando lugar a una zigospora madura.
El ácido trispórico, como punto final de esta vía de reconocimiento, solo puede producirse en presencia de ambos miembros compatibles, que producen enzimáticamente precursores de trisporoides para que sean utilizados posteriormente por el potencial compañero sexual. La especificidad de especie de estas reacciones se obtiene, entre otras cosas, mediante la segregación espacial, las características fisicoquímicas de los derivados (volatilidad y sensibilidad a la luz), las modificaciones químicas de los trisporoides y la regulación transcripcional/postranscripcional.
Los trisporoides también se utilizan en la mediación del reconocimiento entre parásito y hospedador. Un ejemplo es la interacción hospedador-parásito de naturaleza parasexual observada entre Parasitella parasitica , un micoparásito facultativo de zigomicetos, y Absidia glauca . Esta interacción es un ejemplo de parasitismo de fusión biotrófica, porque la información genética se transfiere al hospedador. Se observan muchas similitudes morfológicas en comparación con la formación de zigosporas, pero la espora madura se llama sikyospora y es parásita. Durante este proceso, el hospedador Absidia glauca produce estructuras similares a agallas . Esto, junto con más evidencia, ha llevado a suponer que los trisporoides no son estrictamente específicos de la especie, pero que podrían representar el principio general del reconocimiento de apareamiento en Mucorales. [9]
La regulación de la luz se ha investigado en los zigomicetos Phycomyces blakesleeanus , Mucor circinelloides y Pilobolus crystallinus . Por ejemplo, en Pilobolus crystallinus la luz es responsable del mecanismo de dispersión y los esporangióforos de Phycomyces blakesleeanus crecen hacia la luz. Cuando la luz, particularmente la luz azul, está involucrada en la regulación del desarrollo de los hongos, dirige el crecimiento de las estructuras fúngicas y activa las vías metabólicas. Por ejemplo, los zigomicetos usan la luz como señal para promover la reproducción vegetativa y el crecimiento de hifas aéreas para facilitar la dispersión de esporas.
El fototropismo de los hongos se ha estudiado en detalle utilizando como modelo el cuerpo fructífero, el esporangióforo, de Phycomyces . Phycomyces tiene un sistema fotorreceptor complejo. Es capaz de reaccionar a diferentes intensidades de luz y longitudes de onda. A diferencia de la reacción positiva a la luz azul, también existe una reacción negativa a la luz ultravioleta. También se observaron reacciones a la luz roja.
Los dos genes de las enzimas fitoeno desaturasa (carB) y fitoeno sintasa/caroteno ciclasa bifuncional (carRA en Phycomyces , carRP en Mucor ) son responsables de la síntesis de betacaroteno. El producto del gen crgA, que se encontró en Mucor, suprime la formación de caroteno al inhibir la acumulación de ARNm de carB y carRP.
El zigomiceto P. blakesleeanus construye dos tipos de esporangióforos, los macróforos y los micróforos, que difieren en tamaño. La formación de estos esporangióforos funciona con diferentes fluencias de luz y, por lo tanto, con fotorreceptores específicos. La luz también regula la esporulación asexual. En Mucor , el producto del gen crgA actúa como activador. Por el contrario, el desarrollo sexual de Phycomyces se inhibe por la luz debido a un sistema de fotorreceptores especializado.
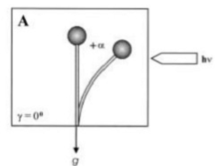
El gravitropismo es un movimiento de rotación o crecimiento de una planta u hongo en respuesta a la gravedad. Está igualmente extendido en ambos reinos. Los estatolitos son necesarios tanto en hongos como en plantas para el mecanismo de detección de la gravedad. Los esporangióforos de Zygomycota se originan a partir de "hifas basales" especializadas y pasan por varias etapas de desarrollo distintivas hasta que se liberan las esporas asexuales maduras. Además del fototropismo positivo, los esporangióforos son dirigidos por una respuesta gravitrópica negativa a una posición adecuada para la dispersión y distribución de las esporas. Ambas respuestas son reacciones de crecimiento, es decir, la flexión es causada por el crecimiento diferencial en los respectivos flancos opuestos del esporangióforo y se influyen mutuamente. El único modelo para el mecanismo de la reacción gravitrópica de Phycomyces se basa en la flotabilidad de la vacuola dentro del citoplasma circundante. [10] Se propone que la distribución asimétrica resultante del citoplasma genera un mayor crecimiento de la pared en el lado inferior de los esporangióforos ubicados horizontalmente, ya que en la capa citoplasmática más gruesa que se forma allí, el número de vesículas que secretan material de la pared celular sería mayor que en el lado superior. La flexión gravitrópica comienza después de aproximadamente 15 a 30 minutos en los esporangióforos ubicados horizontalmente y continúa hasta que, aproximadamente 12 a 14 horas después, la punta del esporangióforo ha recuperado su posición vertical original. Por lo general, la respuesta gravitrópica es más débil en comparación con la fototrófica. Sin embargo, en ciertas condiciones, se podría establecer el equilibrio y las respuestas son comparables. En plantas y hongos, el fototropismo y el gravitropismo interactúan de manera compleja. Durante la irradiación continua con luz unilateral, el esporangióforo (cuerpo fructífero) del hongo zigomiceto, Phycomyces blakesleeanus, alcanza un ángulo de curvatura de equilibrio fotogravitrópico en el que los estímulos gravitrópicos y fototrópicos se equilibran entre sí (Fig. 1, ángulo de curvatura +α, debido a la irradiación de luz [11] ).

En Phycomyces blakesleeanus , los esporangióforos de tipo salvaje contienen grandes cristales paracristalinos octaédricos, fácilmente visibles, con un tamaño de hasta 5×5×5 μm. Generalmente, se encuentran cerca de la vacuola principal en grupos que constan de más de diez cristales. A menudo se asocian a los transeptos vacuolares. Se puede observar una sedimentación con una velocidad de aproximadamente 100 μm/s cuando los esporangióforos están inclinados. El deslizamiento durante la sedimentación o el tirón de las membranas vacuolares y los transeptos sirve como una señal intercelular para una probable respuesta del citoesqueleto, y eso activa los receptores ubicados en la membrana celular. Estos receptores a su vez desencadenan una cadena de eventos que finalmente conduce al crecimiento asimétrico de la pared celular. Los estudios del ángulo de flexión del crecimiento de los esporangióforos de tipo salvaje y de cepas mutantes han demostrado que las cepas mutantes que no tienen cristales exhiben una respuesta gravitrópica reducida. [11]
El complejo de glóbulos lipídicos apicales también está involucrado en la gravipercepción. Estos lípidos se agrupan en estructuras celulares, complejos de glóbulos lipídicos, aproximadamente 0,1 mm por debajo de la punta del ápice. (Fig. 2) Los glóbulos migran a la columela cuando se forma el esporangio. En la etapa madura, se cree que este complejo actúa como un gravirreceptor debido a su flotabilidad. Los mutantes que carecen de este complejo lipídico muestran una respuesta gravitrópica muy reducida. [10]
Históricamente, todos los hongos que producen una zigospora se consideraban relacionados y se colocaban en Zygomycota. El uso de la filogenética molecular ha revelado cada vez más que esta agrupación es parafilética . [1] Sin embargo, el rango (es decir, filo o subfilo) de estos clados está en disputa. Lo que sigue es una filogenia de hongos con los subfilos zigomicetos derivados de Spatafora et al. (2016) [1] con ambos posibles nombres de filo.
Muchas especies de zigomicetos pueden utilizarse en importantes procesos industriales. En la tabla se presenta un resumen de ellas.

Los zigomicetos pueden crecer en una amplia gama de ambientes. La mayoría de ellos son mesófilos (crecen a 10–40 °C con un óptimo de 20–35 °C), pero algunos, como Mucor miehei o Mucor pusillus , son termófilos con una temperatura mínima de crecimiento de aproximadamente 20 °C y máxima que se extiende hasta 60 °C. Otros, como Mucor hiemalis, pueden crecer a temperaturas inferiores a 0 °C.
Algunas especies del orden Mucorales pueden crecer en condiciones anaeróbicas, mientras que la mayoría de ellas requieren condiciones aeróbicas. Además, mientras que la mayoría de los zigomicetos solo crecen en condiciones de alta actividad hídrica, algunos de ellos pueden crecer en concentraciones de sal de al menos el 15%. La mayoría de las especies de Mucor crecen rápidamente en agar a temperatura ambiente, llenando la placa de Petri en 2-3 días con su micelio aéreo grueso. Cuando se incuban en un cultivo líquido en condiciones semianaeróbicas, varias especies crecen en un estado similar al de las levaduras. La formación de zigosporas puede estimularse a temperaturas de incubación más altas (30-40 °C).

El crecimiento de Zygomycota en agar sólido puede producir colonias fibrosas bajas o muy altas que llenan rápidamente toda la placa de Petri. Su color puede variar desde blanco puro hasta tonos de gris o marrón. En cultivos antiguos, se observan esporangios pigmentados de forma oscura. Todo depende de la especie y del medio utilizado. En cultivo líquido, los Zygomycota suelen formar una masa blanda y no producen esporas. Esto se debe a que no pueden desarrollar hifas aéreas.
Los zigomicetos crecen bien en la mayoría de los medios de cultivo de hongos estándar , como el agar dextrosa Sabouraud. También pueden crecer en medios selectivos y no selectivos. También se pueden utilizar medios mínimos, medios complementarios y medios de inducción. La mayoría de los zigomicetos son sensibles a la cicloheximida (actidiona) y este agente no debe utilizarse en los medios de cultivo.
Un ejemplo común de zigomiceto es el moho negro del pan ( Rhizopus stolonifer ), un miembro de los Mucorales . Se extiende sobre la superficie del pan y otras fuentes de alimentos, enviando hifas hacia adentro para absorber nutrientes. En su fase asexual desarrolla esporangios negros bulbosos en las puntas de las hifas verticales, cada uno de los cuales contiene cientos de esporas haploides .
Como en la mayoría de los zigomicetos, la reproducción asexual es la forma más común de reproducción. La reproducción sexual en Rhizopus stolonifer , como en otros zigomicetos, ocurre cuando las hifas haploides de diferentes tipos de apareamiento están muy próximas entre sí. El crecimiento de los gametangios comienza después de que los gametangios entran en contacto, y ocurre la plasmogamia , o la fusión del citoplasma. La cariogamia , que es la fusión de los núcleos, sigue de cerca. Los zigosporangios son entonces diploides . Los zigosporangios suelen tener paredes gruesas, son muy resistentes a las dificultades ambientales y metabólicamente inertes. Sin embargo, cuando las condiciones mejoran, germinan para producir un esporangio o hifas vegetativas . La meiosis ocurre durante la germinación del zigosporangio, por lo que las esporas o hifas resultantes son haploides. Crece en condiciones cálidas y húmedas.
Algunos zigomicetos dispersan sus esporas de una manera más precisa que simplemente dejándolas flotar sin rumbo en las corrientes de aire. Pilobolus , un hongo que crece en el estiércol animal, dobla sus esporangióforos hacia la luz con la ayuda de un pigmento sensible a la luz ( beta-caroteno ) y luego los "dispara" con un chorro explosivo de citoplasma a alta presión . Los esporangios pueden lanzarse hasta a 2 m, colocándolos lejos del estiércol y, con suerte, sobre la vegetación que será comida por un herbívoro, para eventualmente ser depositados con el estiércol en otro lugar. Se han desarrollado diferentes mecanismos para la descarga forzada de esporas entre los miembros del orden de los zigomicetos Entomophthorales .
La evolución del conidio a partir de la esporangiospora es la principal diferencia definitoria entre zigomicetos y ascomicetos . [12] La evolución de las esporangiosporas típicas de los zigomicetos a conidios similares a los encontrados en los ascomicetos puede modelarse mediante una serie de formas observadas en los zigomicetos. Muchos zigomicetos producen múltiples esporangiosporas dentro de un solo esporangio. Algunos han desarrollado múltiples esporangiosporas pequeñas que contienen pocas esporangiosporas. En algunos casos, puede haber tan solo tres esporas en cada esporangiolum, y algunas especies tienen esporangiosporas que contienen solo una espora. Choanephora , un zigomiceto, tiene un esporangiolum que contiene una espora con una pared de esporangio que es visible en la base del esporangio. Esta estructura es similar a un conidio, que tiene dos paredes celulares fusionadas, una pared interna de esporas y una pared externa de esporangio.