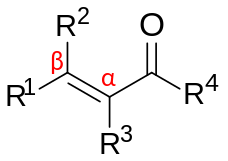
Los compuestos carbonílicos α,β-insaturados son compuestos orgánicos con la estructura general (O=CR)−C α =C β -R. [1] [2] Dichos compuestos incluyen enonas y enales , pero también ácidos carboxílicos y los ésteres y amidas correspondientes. En estos compuestos, el grupo carbonilo está conjugado con un alqueno (de ahí el adjetivo insaturado ). A diferencia del caso de los carbonilos sin un grupo alqueno flanqueante, los compuestos carbonílicos α,β-insaturados son susceptibles al ataque de los nucleófilos en el carbono β. Este patrón de reactividad se denomina vinílogo . Ejemplos de carbonilos insaturados son acroleína (propenal), óxido de mesitilo , ácido acrílico y ácido maleico . Los carbonilos insaturados se pueden preparar en el laboratorio en una reacción aldólica y en la reacción de Perkin .
Los compuestos carbonílicos α,β-insaturados se pueden subclasificar según la naturaleza de los grupos carbonilo y alqueno.

Los compuestos carbonílicos α,β-insaturados que presentan un carbonilo conjugado con un alqueno que es terminal, o vinílico , contienen el grupo acriloilo ( H 2 C =CH−C(= O )−); es el grupo acilo derivado del ácido acrílico . El nombre IUPAC preferido para el grupo es prop-2-enoilo , y también se conoce como acrilo o simplemente (e incorrectamente) como acrilo . Los compuestos que contienen un grupo acriloilo pueden denominarse "compuestos acrílicos".
Un ácido α,β-insaturado es un tipo de compuesto carbonílico α,β-insaturado que consiste en un alqueno conjugado con un ácido carboxílico . [3] El ejemplo más simple es el ácido acrílico (CH 2 = CHCO 2 H). Estos compuestos son propensos a la polimerización, dando lugar a la gran área de plásticos de poliacrilato . Los polímeros de acrilato se derivan de, pero no contienen, el grupo acrilato. [4] El grupo carboxilo del ácido acrílico puede reaccionar con amoníaco para formar acrilamida , o con un alcohol para formar un éster de acrilato . La acrilamida y el acrilato de metilo son ejemplos comercialmente importantes de amidas α,β-insaturadas y ésteres α,β-insaturados, respectivamente. También polimerizan fácilmente. El ácido acrílico, sus ésteres y sus derivados de amida presentan el grupo acriloilo.
Los dicarbonilos α,β-insaturados también son comunes. Los compuestos originales son el ácido maleico y el isómero ácido fumárico . El ácido maleico forma ésteres, una imida y un anhídrido, es decir, maleato de dietilo , maleimida y anhídrido maleico . El ácido fumárico, como fumarato, es un intermediario en el ciclo del ácido cítrico de Krebs , que es de gran importancia en la bioenergía.
Una enona (o alquenona ) es un compuesto orgánico que contiene grupos funcionales alqueno y cetona . En una enona α,β-insaturada, el alqueno está conjugado con el grupo carbonilo de la cetona. [3] La enona más simple es la metil vinil cetona (butenona, CH 2 = CHCOCH 3 ). Las enonas se producen típicamente usando una condensación aldólica o condensación de Knoevenagel . Algunas enonas comercialmente significativas producidas por condensaciones de acetona son el óxido de mesitilo ( dímero de acetona) y la forona y la isoforona ( trímeros ). [5] En el reordenamiento de Meyer-Schuster , el compuesto de partida es un alcohol propargílico . Otro método para acceder a carbonilos α,β-insaturados es a través de la eliminación de selenóxido . Las enonas cíclicas se pueden preparar a través de la reacción de Pauson-Khand .

Las enonas cíclicas incluyen ciclopropenona , ciclobutenona, [6] ciclopentenona , ciclohexenona y cicloheptenona. [7]
Un enal (o alquenal ) es un compuesto orgánico que contiene grupos funcionales alqueno y aldehído . En un enal α,β-insaturado, el alqueno está conjugado con el grupo carbonilo del aldehído (grupo formilo). [3] El enal más simple es la acroleína (CH2 = CHCHO). Otros ejemplos incluyen cis -3-hexenal (esencia de césped cortado) y cinamaldehído (esencia de canela).
Los carbonilos α,β-insaturados son electrofílicos tanto en el carbono carbonílico como en el carbono β. Dependiendo de las condiciones, los nucleófilos atacan ambos sitios . Las adiciones al alqueno se denominan adiciones conjugadas . Un tipo de adición conjugada es la adición de Michael , que se utiliza comercialmente en la conversión de óxido de mesitilo en isoforona . Debido a su conjugación extendida, los carbonilos α,β-insaturados son propensos a la polimerización. En términos de escala industrial, la polimerización domina el uso de carbonilos α,β-insaturados. Nuevamente, debido a su carácter electrofílico, la porción alqueno de los carbonilos α,β-insaturados es un buen dienófilo en las reacciones de Diels-Alder . Pueden ser activados aún más por ácidos de Lewis, que se unen al oxígeno del carbonilo. Los carbonilos α,β-insaturados son buenos ligandos para complejos metálicos de baja valencia, siendo algunos ejemplos Fe(bda)(CO) 3 y tris(dibencilidenoacetona)dipaladio(0) .
Los carbonilos α,β-insaturados se hidrogenan fácilmente. La hidrogenación puede dirigirse selectivamente al carbonilo o al alqueno ( reducción conjugada ), o a ambos grupos funcionales.
Las enonas experimentan la reacción de ciclización de Nazarov y la reacción de Rauhut-Currier (dimerización).
Los tioésteres α,β-insaturados son intermediarios en varios procesos enzimáticos. Dos ejemplos destacados son la coumaroil-coenzima A y la crotonil-coenzima A. Surgen por la acción de las acil-CoA deshidrogenasas . [8] El dinucleótido de flavina y adenina (FAD) es un cofactor necesario.

Dado que los compuestos α,β-insaturados son electrófilos y agentes alquilantes, muchos compuestos carbonílicos α,β-insaturados son tóxicos. El compuesto depurador endógeno glutatión protege de forma natural de los electrófilos tóxicos en el cuerpo. Algunos fármacos (amifostina, N -acetilcisteína ) que contienen grupos tiol pueden proteger de esta alquilación dañina.