
En química , las aminas ( / ə ˈ m iː n , ˈ æ m iː n / , [1] [2] UK también / ˈ eɪ m iː n / [3] ) son compuestos y grupos funcionales que contienen un átomo de nitrógeno básico con un par solitario . Formalmente, las aminas son derivados del amoníaco ( NH 3 ), en donde uno o más átomos de hidrógeno han sido reemplazados por un sustituyente como un grupo alquilo o arilo [4] (estos pueden llamarse respectivamente alquilaminas y arilaminas; las aminas en las que ambos tipos de sustituyentes están unidos a un átomo de nitrógeno pueden llamarse alquilarilaminas). Las aminas importantes incluyen aminoácidos , aminas biógenas , trimetilamina y anilina . Los derivados inorgánicos del amoníaco también se denominan aminas, como la monocloramina ( NClH 2 ). [5]
El sustituyente −NH 2 se llama grupo amino. [6]
La notación química de las aminas contiene la letra "R", donde "R" no es un elemento, sino un "grupo R" que significa "resto de la molécula" y en las aminas podría ser un solo átomo de hidrógeno o carbono, o podría ser una cadena de hidrocarburos.
Los compuestos con un átomo de nitrógeno unido a un grupo carbonilo , por lo que tienen la estructura R−C(=O)−NR′R″ , se denominan amidas y tienen propiedades químicas diferentes de las aminas.
Las aminas se pueden clasificar según la naturaleza y el número de sustituyentes en el nitrógeno . Las aminas alifáticas contienen solo sustituyentes H y alquilo. Las aminas aromáticas tienen el átomo de nitrógeno conectado a un anillo aromático .
Las aminas, tanto alquílicas como arílicas, se organizan en tres subcategorías (ver tabla) según el número de átomos de carbono adyacentes al nitrógeno (cuántos átomos de hidrógeno de la molécula de amoníaco son reemplazados por grupos hidrocarburos ): [6] [7]
Una cuarta subcategoría está determinada por la conectividad de los sustituyentes unidos al nitrógeno:
También es posible tener cuatro sustituyentes orgánicos en el nitrógeno. Estas especies no son aminas sino cationes de amonio cuaternario y tienen un centro de nitrógeno cargado. Las sales de amonio cuaternario existen con muchos tipos de aniones .
Las aminas se nombran de varias formas. Normalmente, el compuesto recibe el prefijo "amino-" o el sufijo "-amina". El prefijo " N- " indica una sustitución en el átomo de nitrógeno. Un compuesto orgánico con múltiples grupos amino se denomina diamina , triamina , tetraamina , etc.
Las aminas inferiores se nombran con el sufijo -amina .

Las aminas superiores tienen el prefijo amino como grupo funcional. Sin embargo, la IUPAC no recomienda esta convención, [8] sino que prefiere la forma alcanamina, por ejemplo, butan-2-amina.

La formación de enlaces de hidrógeno influye de forma significativa en las propiedades de las aminas primarias y secundarias. Por ejemplo, las aminas de metilo y etilo son gases en condiciones estándar, mientras que los alcoholes de metilo y etilo correspondientes son líquidos. Las aminas tienen un olor característico a amoníaco, mientras que las aminas líquidas tienen un olor característico a pescado y desagradable.
El átomo de nitrógeno tiene un par de electrones solitario que puede unirse a H + para formar un ion amonio R3NH + . El par de electrones solitario está representado en este artículo por dos puntos encima o al lado del N. La solubilidad en agua de las aminas simples se mejora mediante la unión de hidrógeno que involucra a estos pares de electrones solitarios. Normalmente, las sales de compuestos de amonio exhiben el siguiente orden de solubilidad en agua: amonio primario ( RNH+
3) > amonio secundario ( R
2NUEVA HAMPSHIRE+
2) > amonio terciario (R 3 NH + ). Las aminas alifáticas pequeñas muestran una solubilidad significativa en muchos disolventes , mientras que las que tienen sustituyentes grandes son lipofílicas. Las aminas aromáticas, como la anilina , tienen sus electrones de pares solitarios conjugados en el anillo de benceno, por lo que su tendencia a participar en enlaces de hidrógeno se ve disminuida. Sus puntos de ebullición son altos y su solubilidad en agua es baja.
Por lo general, la presencia de un grupo funcional amina se deduce mediante una combinación de técnicas, que incluyen espectrometría de masas, así como espectroscopias de RMN e IR. Las señales de RMN de 1 H para aminas desaparecen tras el tratamiento de la muestra con D 2 O. En su espectro infrarrojo , las aminas primarias exhiben dos bandas de NH, mientras que las aminas secundarias exhiben solo una. [6] En sus espectros de IR, las aminas primarias y secundarias exhiben bandas de estiramiento de NH distintivas cerca de 3300 cm -1 . Algo menos distintivas son las bandas que aparecen por debajo de 1600 cm -1 , que son más débiles y se superponen con los modos CC y CH . Para el caso de la propilamina , el modo de tijera HNH aparece cerca de 1600 cm -1 , el estiramiento CN cerca de 1000 cm -1 y la curva R 2 N-H cerca de 810 cm -1 . [9]

Las aminas de alquilo se caracterizan por tener centros de nitrógeno tetraédricos. Los ángulos CNC y CNH se aproximan al ángulo idealizado de 109°. Las distancias CN son ligeramente más cortas que las distancias CC. La barrera de energía para la inversión de nitrógeno del estereocentro es de aproximadamente 7 kcal/mol para una trialquilamina. La interconversión se ha comparado con la inversión de un paraguas abierto en un viento fuerte.
Las aminas del tipo NHRR' y NRR′R″ son quirales : el centro de nitrógeno lleva cuatro sustituyentes contando el par solitario. Debido a la baja barrera a la inversión, las aminas del tipo NHRR' no pueden obtenerse con pureza óptica. Para las aminas terciarias quirales, NRR′R″ solo puede resolverse cuando los grupos R, R' y R″ están restringidos en estructuras cíclicas como las aziridinas N -sustituidas ( las sales de amonio cuaternario son resolubles).
En las aminas aromáticas ("anilinas"), el nitrógeno suele ser casi plano debido a la conjugación del par solitario con el sustituyente arilo. La distancia CN es correspondientemente más corta. En la anilina, la distancia CN es la misma que la distancia CC. [10]
Al igual que el amoníaco, las aminas son bases . [11] En comparación con los hidróxidos de metales alcalinos, las aminas son más débiles.
La basicidad de las aminas depende de:
Debido a los efectos inductivos, se podría esperar que la basicidad de una amina aumente con el número de grupos alquilo en la amina. Las correlaciones son complicadas debido a los efectos de solvatación que son opuestos a las tendencias de los efectos inductivos. Los efectos de solvatación también dominan la basicidad de las aminas aromáticas (anilinas). Para las anilinas, el par solitario de electrones en el nitrógeno se deslocaliza en el anillo, lo que resulta en una disminución de la basicidad. Los sustituyentes en el anillo aromático y sus posiciones relativas al grupo amino también afectan la basicidad, como se ve en la tabla.
La solvatación afecta significativamente la basicidad de las aminas. Los grupos NH interactúan fuertemente con el agua, especialmente en iones amonio. En consecuencia, la basicidad del amoniaco se mejora en 10 11 por solvatación. La basicidad intrínseca de las aminas, es decir, la situación en la que la solvatación no es importante, se ha evaluado en la fase gaseosa. En la fase gaseosa, las aminas exhiben las basicidades predichas a partir de los efectos liberadores de electrones de los sustituyentes orgánicos. Por lo tanto, las aminas terciarias son más básicas que las aminas secundarias, que son más básicas que las aminas primarias, y finalmente el amoniaco es menos básico. El orden de pK b (basicidades en agua) no sigue este orden. De manera similar, la anilina es más básica que el amoniaco en la fase gaseosa, pero diez mil veces menos en solución acuosa. [14]
En disolventes polares apróticos como el DMSO , el DMF y el acetonitrilo , la energía de solvatación no es tan alta como en disolventes polares próticos como el agua y el metanol. Por este motivo, la basicidad de las aminas en estos disolventes apróticos está determinada casi exclusivamente por los efectos electrónicos.
Las aminas de alquilo de importancia industrial se preparan a partir de amoníaco mediante alquilación con alcoholes: [5]
A diferencia de la reacción de aminas con alcoholes, la reacción de aminas y amoniaco con haluros de alquilo se utiliza para la síntesis en el laboratorio:
En tales reacciones, que son más útiles para los yoduros y bromuros de alquilo, el grado de alquilación es difícil de controlar, de modo que se obtienen mezclas de aminas primarias, secundarias y terciarias, así como sales de amonio cuaternario. [5]
La selectividad se puede mejorar mediante la reacción de Delépine , aunque rara vez se emplea a escala industrial. La selectividad también se garantiza en la síntesis de Gabriel , que implica la reacción de organohaluros con ftalimida de potasio .
Los haluros de arilo son mucho menos reactivos con las aminas y, por ello, son más controlables. Una forma popular de preparar aminas de arilo es la reacción de Buchwald-Hartwig .
Los alquenos disustituidos reaccionan con HCN en presencia de ácidos fuertes para dar formamidas, que pueden descarbonilarse. Este método, la reacción de Ritter , se utiliza industrialmente para producir aminas terciarias como la terc-octilamina. [5]
La hidroaminación de alquenos también es una práctica muy extendida. La reacción está catalizada por ácidos sólidos a base de zeolita . [5]
Mediante el proceso de hidrogenación , los grupos funcionales que contienen N insaturado se reducen a aminas utilizando hidrógeno en presencia de un catalizador de níquel. Los grupos adecuados incluyen nitrilos , azidas , iminas que incluyen oximas , amidas y nitro . En el caso de los nitrilos, las reacciones son sensibles a las condiciones ácidas o alcalinas, que pueden causar la hidrólisis del grupo −CN . LiAlH 4 se emplea más comúnmente para la reducción de estos mismos grupos a escala de laboratorio.
Muchas aminas se producen a partir de aldehídos y cetonas mediante aminación reductora , que puede realizarse de forma catalítica o estequiométrica.
La anilina ( C 6 H 5 NH 2 ) y sus derivados se preparan por reducción de los nitroaromáticos. En la industria, el hidrógeno es el reductor preferido, mientras que en el laboratorio se emplean a menudo el estaño y el hierro.
Existen muchos métodos para la preparación de aminas, muchos de ellos bastante especializados.
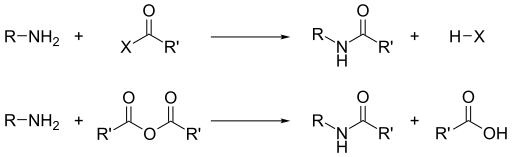
Aparte de su basicidad, la reactividad dominante de las aminas es su nucleofilia . [16] La mayoría de las aminas primarias son buenos ligandos para los iones metálicos para dar complejos de coordinación . Las aminas se alquilan mediante haluros de alquilo. Los cloruros de acilo y los anhídridos de ácido reaccionan con aminas primarias y secundarias para formar amidas (la " reacción de Schotten-Baumann ").
De manera similar, con los cloruros de sulfonilo se obtienen sulfonamidas . Esta transformación, conocida como reacción de Hinsberg , es una prueba química para detectar la presencia de aminas.
Como las aminas son básicas, neutralizan los ácidos para formar las sales de amonio correspondientes R 3 NH + . Cuando se forman a partir de ácidos carboxílicos y aminas primarias y secundarias, estas sales se deshidratan térmicamente para formar las amidas correspondientes .
Las aminas sufren sulfamación tras el tratamiento con trióxido de azufre o fuentes del mismo:
Las aminas reaccionan con el ácido nitroso para formar sales de diazonio. Las sales de diazonio alquílico tienen poca importancia porque son demasiado inestables. Los miembros más importantes son derivados de aminas aromáticas como la anilina ("fenilamina") (A = arilo o naftilo):
Las anilinas y las naftilaminas forman sales de diazonio más estables , que pueden aislarse en forma cristalina. [17] Las sales de diazonio experimentan una variedad de transformaciones útiles que implican la sustitución del grupo N 2 por aniones. Por ejemplo, el cianuro cuproso da los nitrilos correspondientes:
Los arildiazonios se acoplan con compuestos aromáticos ricos en electrones, como el fenol, para formar compuestos azoicos . Estas reacciones se aplican ampliamente en la producción de colorantes. [18]
La formación de iminas es una reacción importante. Las aminas primarias reaccionan con cetonas y aldehídos para formar iminas . En el caso del formaldehído (R' = H), estos productos suelen existir como trímeros cíclicos : La reducción de estas iminas da lugar a aminas secundarias:
De manera similar, las aminas secundarias reaccionan con cetonas y aldehídos para formar enaminas :
Los iones mercúricos oxidan reversiblemente las aminas terciarias con un hidrógeno α a iones iminio : [19]
A continuación se ofrece una descripción general de las reacciones de las aminas:
Las aminas son omnipresentes en biología. La descomposición de aminoácidos libera aminas, como es bien sabido en el caso del pescado en descomposición que huele a trimetilamina . Muchos neurotransmisores son aminas, entre ellas la epinefrina , la norepinefrina , la dopamina , la serotonina y la histamina . Los grupos amino protonados ( –NH+
3) son las fracciones cargadas positivamente más comunes en las proteínas , específicamente en el aminoácido lisina . [20] El ADN polimérico aniónico normalmente está unido a varias proteínas ricas en aminas. [21] Además, el amonio primario cargado terminal en la lisina forma puentes salinos con grupos carboxilato de otros aminoácidos en polipéptidos , que es una de las principales influencias en las estructuras tridimensionales de las proteínas. [22]
Las hormonas derivadas de la modificación de aminoácidos se denominan hormonas amínicas. Normalmente, se modifica la estructura original del aminoácido de modo que se elimina un grupo –COOH, o carboxilo, mientras que el grupo –NH+
3, o grupo amina, permanece. Las hormonas amínicas se sintetizan a partir de los aminoácidos triptófano o tirosina . [23]
Las aminas aromáticas primarias se utilizan como materia prima para la fabricación de colorantes azoicos . Reaccionan con ácido nitroso para formar sal de diazonio, que puede experimentar una reacción de acoplamiento para formar un compuesto azoico. Como los compuestos azoicos son muy coloreados, se utilizan ampliamente en las industrias de teñido, como:
La mayoría de los fármacos y candidatos a fármacos contienen grupos funcionales amina: [24]
La monoetanolamina acuosa (MEA), la diglicolamina (DGA), la dietanolamina (DEA), la diisopropanolamina (DIPA) y la metildietanolamina (MDEA) se utilizan ampliamente en la industria para eliminar el dióxido de carbono (CO2 ) y el sulfuro de hidrógeno (H2S ) de los flujos de gas natural y de procesos de refinería. También se pueden utilizar para eliminar el CO2 de los gases de combustión y los gases de combustión y pueden tener potencial para la reducción de los gases de efecto invernadero . Los procesos relacionados se conocen como endulzamiento . [26]
Las aminas se utilizan a menudo como agentes de curado de resinas epoxi. [27] [28] Estas incluyen dimetiletilamina , ciclohexilamina y una variedad de diaminas como 4,4-diaminodiciclohexilmetano. [5] Las aminas multifuncionales como tetraetilenpentamina y trietilentetramina también se utilizan ampliamente en esta capacidad. [29] La reacción procede por el par solitario de electrones en el nitrógeno de la amina que ataca el carbono más externo en el anillo de oxirano de la resina epoxi. Esto alivia la tensión del anillo en el epóxido y es la fuerza impulsora de la reacción. [30] Las moléculas con funcionalidad de amina terciaria se utilizan a menudo para acelerar la reacción de curado epoxi-amina e incluyen sustancias como 2,4,6-Tris(dimetilaminometil)fenol . Se ha afirmado que este es el acelerador a temperatura ambiente más utilizado para sistemas de resina epoxi de dos componentes. [31] [32]
Las aminas simples de bajo peso molecular, como la etilamina , son sólo débilmente tóxicas con una DL50 entre 100 y 1000 mg/kg. Son irritantes de la piel, especialmente porque algunas se absorben fácilmente a través de la piel. [5] Las aminas son una clase amplia de compuestos, y los miembros más complejos de la clase pueden ser extremadamente bioactivos, por ejemplo, la estricnina .