Chrysomallon squamiferum , comúnmente conocido como gasterópodo de patas escamosas , caracol de patas escamosas , pangolín de mar o caracol volcánico [3] [4] es una especie de caracol de respiradero hidrotermal de aguas profundas, un molusco gasterópodo marino de la familia Peltospiridae . [2] Este gasterópodo endémico de los respiraderos se conoce únicamente en los respiraderos hidrotermales de aguas profundas en el Océano Índico , donde se ha encontrado a profundidades de aproximadamente 2.400 a 2.900 m (1,5 a 1,8 millas). C. squamiferum se diferencia mucho de otros gasterópodos de aguas profundas, incluso de los neomphalinos estrechamente relacionados. [5] En 2019, fue declarada en peligro de extinción en la Lista Roja de la UICN, [6] la primera especie en ser incluida como tal debido a los riesgos de la minería en aguas profundas de su hábitat de respiradero. [7]
El caparazón es de construcción única, con tres capas; la capa externa está formada por sulfuros de hierro , la capa intermedia equivale al periostraco orgánico que se encuentra en otros gasterópodos y la capa más interna está hecha de aragonito . El pie también es inusual, ya que está blindado a los lados con escleritas mineralizadas de hierro .
La glándula esofágica del caracol alberga gammaproteobacterias simbióticas de las que el caracol parece obtener su alimento. Esta especie se considera uno de los gasterópodos de respiraderos hidrotermales de aguas profundas más peculiares, y es el único animal existente conocido que incorpora sulfuro de hierro en su esqueleto (tanto en sus escleritos como en su caparazón como exoesqueleto). [2] Su corazón es, proporcionalmente hablando, inusualmente grande para cualquier animal: el corazón comprende aproximadamente el 4% de su volumen corporal. [5]
Esta especie fue descubierta por primera vez en abril de 2001 y desde 2001 se la conoce como gasterópodo de "pies escamosos". [8] Se la conoce como Chrysomallon squamiferum desde 2003, pero no se describió formalmente en el sentido de Código Internacional de Nomenclatura Zoológica hasta que Chen et al. lo nombró en 2015. [2] [9] Los especímenes tipo se almacenan en el Museo de Historia Natural de Londres . [2] Durante la época en la que el nombre aún no estaba formalizado, una variante ortográfica incorrecta era " Crysomallon squamiferum ". [2]
Chrysomallon squamiferum es la especie tipo y la única especie dentro del género Chrysomallon . [2] El nombre genérico Chrysomallon proviene del idioma griego antiguo y significa "cabello dorado", porque la pirita (un compuesto que se encuentra en su caparazón) es de color dorado. [2] El nombre específico squamiferum proviene del idioma latino y significa "portador de escamas", debido a sus escleritos. [2] Al principio no se sabía a qué familia pertenecía esta especie. [8] Warén et al. clasificó esta especie en la familia Peltospiridae, dentro de Neomphalina en 2003. [10] Los análisis moleculares basados en secuencias de genes de citocromo-c oxidasa I (COI) confirmaron la ubicación de esta especie dentro de Peltospiridae . [2] [11] Los morfotipos de dos localidades son oscuros; un morfotipo de una tercera localidad es blanco (consulte la siguiente sección para obtener una explicación de las localidades). [2] [12] [13] Estos caracoles de diferentes colores parecen ser simplemente "variedades" de la misma especie, según los resultados del análisis genético. [2]

El gasterópodo de patas escamosas es un gasterópodo endémico de los respiraderos conocido sólo en los respiraderos hidrotermales de aguas profundas del Océano Índico, que tienen alrededor de 2.780 metros (1,73 millas) de profundidad. [2] La especie fue descubierta en 2001 y vivía en las bases de los fumadores negros en el campo de respiraderos hidrotermales de Kairei , 25°19.239′S 70°02.429′E / 25.320650°S 70.040483°E / -25.320650; 70.040483 , en Central Indian Ridge, justo al norte de Rodrigues Triple Point . [8] Posteriormente, la especie también se encontró en el campo Solitario, 19°33.413′S 65°50.888′E / 19.556883°S 65.848133°E / -19.556883; 65.848133 , Central Indian Ridge , dentro de la zona económica exclusiva de Mauricio [14] [15] y campo Longqi (significa "bandera del dragón" en chino) [16] , 37°47.027′S 49°38.963′E / 37.783783° S 49.649383°E / -37.783783; 49.649383 , Cordillera del suroeste de la India . [17] [18] El campo Longqi fue designado como localidad tipo; todo tipo de material se originó en este campo de ventilación. [2] La distancia entre Kairei y Solitario es de unos 700 km (430 millas). La distancia entre Solitario y Longqi es de aproximadamente 2.500 km (1.600 millas). [2] Estos tres sitios pertenecen a la provincia biogeográfica de sistemas de respiraderos hidrotermales del Océano Índico sensu Rogers et al. (2012). [19] La distancia entre sitios es grande, pero el área de distribución total es muy pequeña, menos de 0,02 kilómetros cuadrados (0,0077 millas cuadradas). [20]
Se sabe que los caracoles Peltospiridae viven principalmente en los campos de ventilación del Pacífico oriental. Nakamura et al. Planteó la hipótesis de que la aparición del gasterópodo de patas escamosas en el Océano Índico sugiere una relación de las faunas de los respiraderos hidrotermales entre estas dos áreas. [14]

Las expediciones de investigación han incluido:

En esta especie, los lados de la pata del caracol son extremadamente inusuales, ya que están blindados con cientos de escleritos mineralizados con hierro ; estos están compuestos por sulfuros de hierro [10] greigita y pirita . [23] Cada esclerito tiene un núcleo de tejido epitelial blando , una cubierta de conquiolina y una capa superior que contiene pirita y greigita. [2] Antes del descubrimiento del gasterópodo de patas escamosas, se pensaba que los únicos moluscos existentes que poseían estructuras en forma de escamas estaban en las clases Caudofoveata , Solenogastres y Polyplacophora . [18] Los escleritos no son homólogos a un opérculo de gasterópodo . Los escleritos del gasterópodo de pie escamoso tampoco son homólogos a los escleritos que se encuentran en los quitones (Polyplacophora). [18] Se ha planteado la hipótesis de que los escleritos de los halwaxiidos del Cámbrico como Halkieria pueden ser potencialmente más análogos a los escleritos de este caracol que los escleritos de quitones o aplacóforos. [18] Tan recientemente como 2015, no se había llevado a cabo un análisis morfológico detallado para probar esta hipótesis. [18]
Los escleritos de C. squamiferum son principalmente proteicos (la conquiolina es una proteína compleja); por el contrario, las escleritas de los quitones son principalmente calcáreas. [18] No hay líneas de crecimiento visibles de conquiolina en secciones transversales de escleritos. [18] Ningún otro gasterópodo existente o extinto posee escleritos dérmicos, [18] y no se sabe de ningún otro animal existente que utilice sulfuros de hierro de esta manera, ya sea en su esqueleto , [2] o en su exoesqueleto .
El tamaño de cada esclerito es de aproximadamente 1 × 5 mm en los adultos. [2] Los juveniles tienen escamas en pocas filas, mientras que los adultos tienen escamas densas y asimétricas. [24] La población de caracoles Solitario tiene escleritos blancos en lugar de negros; esto se debe a la falta de hierro en los escleritos. [18] Los escleritos están imbricados (superpuestos de una manera que recuerda a las tejas ). [5] Se ha especulado que el propósito de los escleritos es la protección o la desintoxicación . [25] Los escleritos pueden ayudar a proteger al gasterópodo del líquido de ventilación, de modo que sus bacterias puedan vivir cerca de la fuente de donantes de electrones para la quimiosíntesis. [5] O, alternativamente, los escleritos pueden resultar de la deposición de desechos de sulfuro tóxicos de los endosimbiontes y, por lo tanto, representan una nueva solución para la desintoxicación. [5] Pero la verdadera función de los escleritos aún se desconoce. [14] Los escleritos de la población Kairei, que tienen una capa de sulfuro de hierro, son ferrimagnéticos . [2] La esclerita no mineralizada con sulfuro de hierro del morfotipo Solitario mostró una mayor resistencia mecánica de toda la estructura en la prueba de tensión de flexión de tres puntos (12,06 MPa) que la esclerita del morfotipo Kairei (6,54 MPa). [14]
En la vida, las superficies externas de los escleritos albergan una amplia gama de epibiontes : Campylobacterota (anteriormente Epsilonproteobacteria) y Thermodesulfobacteriota (anteriormente parte de Deltaproteobacteria). [26] Estas bacterias probablemente proporcionan su mineralización. [26] Goffredi y cols. (2004) plantearon la hipótesis de que el caracol secreta algunos compuestos orgánicos que facilitan la adhesión de las bacterias. [26]

La concha de estas especies tiene tres verticilos . [2] La forma del caparazón es globosa y la aguja está comprimida. [2] La escultura de concha consta de nervaduras y finas líneas de crecimiento. [2] La forma de la apertura es elíptica. [2] El ápice del caparazón es frágil y está corroído en los adultos. [2]
Se trata de una peltospirida muy grande en comparación con la mayoría de otras especies, que suelen tener menos de 15 milímetros ( 3 ⁄ 5 pulgadas) de longitud de caparazón. [2] El ancho del caparazón es de 9,80 a 40,02 mm (0,39 a 1,58 pulgadas); [2] el ancho máximo del caparazón alcanza los 45,5 milímetros (1,79 pulgadas). [2] El ancho medio del caparazón de los caracoles adultos es de 32 mm. [2] El ancho promedio del caparazón en la población de Solitario era ligeramente menor que el de la población de Kairei. [15] La altura del caparazón es de 7,65 a 30,87 mm (0,30 a 1,22 pulgadas). [2] El ancho de la apertura es de 7,26 a 32,52 mm (0,29 a 1,28 pulgadas). [2] La altura de la apertura es de 6,38 a 27,29 mm (0,25 a 1,07 pulgadas). [2]
La estructura del caparazón consta de tres capas. La capa exterior tiene un espesor de aproximadamente 30 μm, es negra y está hecha de sulfuros de hierro, que contienen greigita Fe 3 S 4 . [27] Esta especie es el único animal existente conocido que presenta este material en su esqueleto. [2] La capa media (alrededor de 150 μm) es equivalente al periostraco orgánico que también se encuentra en otros gasterópodos. [27] El periostraco es grueso y marrón. [2] La capa más interna está hecha de aragonita (de aproximadamente 250 μm de espesor), una forma de carbonato de calcio que se encuentra comúnmente tanto en las conchas de los moluscos como en varios corales. [27] El color de la capa de aragonito es blanco lechoso. [2]
Cada capa de caparazón parece contribuir a la eficacia de la defensa del caracol de diferentes maneras. La capa orgánica intermedia parece absorber la tensión mecánica y la energía generada por un ataque de compresión (por ejemplo, por las garras de un cangrejo), lo que hace que el caparazón sea mucho más duro. La capa orgánica también actúa para disipar el calor. [28] Las características de este material compuesto están en el foco de los investigadores para su posible uso en aplicaciones de protección civil y militar. [27]
En esta especie, la forma del opérculo cambia durante el crecimiento, desde una forma redondeada en los juveniles hasta una forma curva en los adultos. [14] El tamaño relativo del opérculo disminuye a medida que los individuos crecen. [5] Aproximadamente la mitad de todos los caracoles adultos de esta especie poseen un opérculo entre los escleritos en la parte trasera del animal. [14] Parece probable que los escleritos crezcan gradualmente y cubran completamente todo el pie para protegerlo, y el opérculo pierda su función protectora a medida que el animal crece. [14]
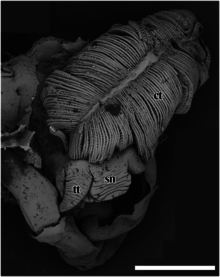
El gasterópodo de pies escamosos tiene un hocico grueso, que se estrecha distalmente hasta un extremo romo. La boca es un anillo circular de músculos cuando se contrae y se cierra. [5] Los dos tentáculos cefálicos lisos son gruesos en la base y se estrechan gradualmente hasta una punta fina en sus puntas distales. [5] Este caracol no tiene ojos. [5] No existe un apéndice copulador especializado. [5] El pie es rojo y grande, y el caracol no puede retirarlo completamente dentro del caparazón. [2] No hay prensaestopas en la parte delantera del pie. [5] Tampoco hay tentáculos epipodiales. [5]
En C. squamiferum , las partes blandas del animal ocupan aproximadamente dos verticilos del interior del caparazón. [5] El músculo de la concha tiene forma de herradura y es grande, dividido en dos partes a la izquierda y a la derecha, y conectados por una unión más estrecha. [5] El borde del manto es grueso pero simple y sin ningún rasgo distintivo. [5] La cavidad del manto es profunda y llega al borde posterior del caparazón. [5] El lado medial al izquierdo de la cavidad está dominado por un ctenidio bipectinado muy grande . [5] Ventral a la masa visceral, la cavidad corporal está ocupada por una enorme glándula esofágica, que se extiende para llenar el piso ventral de la cavidad del manto. [5] [26]
El sistema digestivo es simple y está reducido a menos del 10% del volumen típico de los gasterópodos. [5] [26] La rádula es "débil", del tipo ripidogloso, con un solo par de cartílagos radulares. [5] [26] La fórmula de la rádula es ~50 + 4 + 1 + 4 + ~50. [2] La cinta de la rádula mide 4 mm de largo y 0,5 mm de ancho; [2] la relación ancho-largo es aproximadamente 1:10. [5] No hay mandíbula ni glándulas salivales. [5] Una parte del esófago anterior se expande rápidamente hasta convertirse en una enorme glándula esofágica hipertrofiada con extremos ciegos, que ocupa gran parte de la cara ventral de la cavidad del manto (estimado en un 9,3% del volumen corporal). [5] La glándula esofágica crece isométricamente con el caracol, lo que coincide con el hecho de que el caracol depende de sus microbios endosimbiontes a lo largo de su vida sedentaria. [24] La glándula esofágica tiene una textura uniforme y está muy vascularizada con vasos sanguíneos finos. [5] El estómago tiene al menos tres conductos en su parte anterior derecha, que se conectan con la glándula digestiva . [5] Hay bolitas consolidadas tanto en el estómago como en el intestino posterior. [5] Estos gránulos son probablemente gránulos de azufre producidos por el endosimbionte como una forma de desintoxicar el sulfuro de hidrógeno. [5] El intestino está reducido y solo tiene un asa. [5] La glándula digestiva extensa y no consolidada se extiende hacia la parte posterior, llenando el ápice del caparazón. [5] El recto no penetra en el corazón, sino que pasa ventralmente a él. [5] El ano está ubicado en el lado derecho del caracol, encima de la abertura genital. [5]
En el sistema excretor , el nefridio es central, tendiendo al lado derecho del cuerpo, como una fina capa oscura de tejido glandular. [5] El nefridio es anterior y ventral de la glándula digestiva y está en contacto con el lado dorsal del intestino anterior. [5]
El sistema respiratorio y el sistema circulatorio constan de un único ctenidio bipectinado izquierdo (branquias), que es muy grande (15,5% del volumen corporal) y está sostenido por muchos senos sanguíneos grandes y móviles llenos de hemocele . [5] [24] En la disección, los senos sanguíneos y los grumos de material hemocele son una característica prominente en toda la cavidad corporal. [5] Aunque el sistema circulatorio en Chrysomallon está en su mayor parte cerrado (lo que significa que el hemocele en su mayoría no sale de los senos sanguíneos), los senos sanguíneos prominentes parecen ser transitorios y ocurren en diferentes áreas del cuerpo en diferentes individuos. [24] Hay filamentos branquiales delgados a cada lado del ctenidium. [5] El ctenidium bipectinado se extiende muy por detrás del corazón hasta los verticilos superiores de la concha; es mucho más grande que en Peltospira . Aunque esta especie tiene una forma de concha y una forma general similar a la de otros peltospiridos, el ctenidio tiene un tamaño proporcional al de Hirtopelta , que tiene las branquias más grandes entre los géneros de peltospiridos que se han investigado anatómicamente hasta ahora. [5]
El ctenidium proporciona oxígeno al caracol, pero el sistema circulatorio está agrandado más allá del alcance de otros gasterópodos similares. [5] No hay endosimbiontes dentro o sobre las branquias de C. squamiferum . [5] El agrandamiento de las branquias probablemente tiene como objetivo facilitar la extracción de oxígeno en las condiciones de bajo oxígeno que son típicas de los ecosistemas de respiraderos hidrotermales. [5]
En la parte posterior del ctenidium hay un corazón notablemente grande y bien desarrollado. [5] El corazón es proporcionalmente inusualmente grande para cualquier animal. [5] Según el volumen de la aurícula y el ventrículo únicos, el complejo cardíaco representa aproximadamente el 4% del volumen corporal (por ejemplo, el corazón de los humanos es el 1,3% del volumen corporal). [5] El ventrículo mide 0,64 mm de largo en los juveniles con una longitud de caparazón de 2,2 mm y crece hasta 8 mm de largo en los adultos. [24] Este corazón proporcionalmente gigante chupa sangre principalmente a través del ctenidium e irriga la glándula esofágica altamente vascularizada. [5] En C. squamiferum los endosimbiontes están alojados en una glándula esofágica, donde se aíslan del líquido de ventilación. [5] Por lo tanto, es probable que el huésped desempeñe un papel importante en el suministro de los productos químicos necesarios a los endosimbiontes, lo que lleva a un aumento de las necesidades respiratorias. [5] La investigación detallada del hemocele de C. squamiferum revelará más información sobre sus pigmentos respiratorios. [5]

El gasterópodo de pies escamosos es un holobionte quimiosimbiótico . [26] Alberga endosimbiontes gammaproteobacterianos tioautótrofos (oxidantes de azufre) en una glándula esofágica muy agrandada , y parece depender de estos simbiontes para su nutrición. [26] [29] El pariente más cercano conocido de este endosimbionte es el de los caracoles Alviniconcha . [30] En esta especie, el tamaño de la glándula esofágica es aproximadamente dos órdenes de magnitud mayor que el tamaño habitual. [26] Hay un agrandamiento significativo dentro de la glándula esofágica, donde la presión arterial probablemente disminuye a casi cero. [5] Lo más probable es que el elaborado sistema cardiovascular evolucionó para oxigenar los endosimbiontes en un ambiente pobre en oxígeno y/o para suministrar sulfuro de hidrógeno a los endosimbiontes. [5] Las gammaproteobacterias tioautótrofas tienen un conjunto completo de genes necesarios para la respiración aeróbica y probablemente sean capaces de cambiar entre la respiración aeróbica más eficiente y la respiración anaeróbica menos eficiente, dependiendo de la disponibilidad de oxígeno. [5] En 2014, el endosimbionte del gasterópodo de pies escamosos se convirtió en el primer endosimbionte de cualquier gasterópodo del que se conocía el genoma completo. [29] Anteriormente se pensaba que C. squamiferum era la única especie de Peltospiridae que tenía una glándula esofágica agrandada, [2] pero más tarde se descubrió que ambas especies de Gigantopelta también tienen una glándula esofágica agrandada. [11] Chrysomallon y Gigantopelta son los únicos animales de las cloacas, excepto los gusanos tubulares siboglinidos , que albergan endosimbiontes dentro de una parte cerrada del cuerpo que no está en contacto directo con el líquido de las cloacas. [24]
El sistema nervioso es grande y el cerebro es una masa neuronal sólida sin ganglios. [5] El sistema nervioso tiene una complejidad reducida y un tamaño mayor en comparación con otros taxones neomphalinos. [5] Como es típico de los gasterópodos, el sistema nervioso está compuesto por un anillo nervioso esofágico anterior y dos pares de cordones nerviosos longitudinales, el par ventral que inerva el pie y el par dorsal formando una torsión a través de la estreptoneuria . [5] La parte frontal del anillo nervioso esofágico es grande y conecta dos inflamaciones laterales. [5] La enorme masa neural fusionada está directamente adyacente a la glándula oesofágica, donde se alojan las bacterias, y la atraviesa. [5] Hay grandes nervios tentaculares que se proyectan hacia los tentáculos cefálicos. [5] Los órganos sensoriales del gasterópodo de pie escamoso incluyen estatocistos rodeados por la glándula esofágica, cada estatocisto con un solo estatolito . [5] También hay bursículas ctenidiales sensoriales en la punta de los filamentos branquiales; Se sabe que están presentes en la mayoría de los vetigastrópodos y en algunos neomphalinos. [5]
El sistema reproductivo tiene algunas características inusuales. Las gónadas de los caracoles adultos no están dentro del caparazón; están en la región de la cabeza y los pies en el lado derecho del cuerpo. [5] No hay gónadas presentes en los juveniles con una longitud de caparazón de 2,2 mm. [24] Los adultos poseen testículos y ovarios en diferentes niveles de desarrollo. [5] El testículo se coloca ventralmente; el ovario se coloca dorsalmente y el nefridio se encuentra entre ellos. [5] Hay un "órgano empaquetador de espermatóforos" al lado del testículo. [5] Los gonoductos del testículo y el ovario están inicialmente separados, pero aparentemente se fusionan en un solo conducto y emergen como una única abertura genital a la derecha de la cavidad del manto. [5] El animal no tiene órgano copulador. [2] [5]
Se plantea la hipótesis de que la estrategia derivada de albergar microbios endosimbióticos en una glándula esofágica ha sido el catalizador de innovaciones anatómicas que sirven principalmente para mejorar la aptitud de las bacterias, más allá de las necesidades del caracol. [5] El gran agrandamiento de la glándula esofágica, los escleritos dérmicos protectores del caracol, sus sistemas respiratorio y circulatorio muy agrandados y su alta fecundidad se consideran adaptaciones beneficiosas para sus microbios endosimbiontes. [5] Estas adaptaciones parecen ser el resultado de la especialización para resolver las necesidades energéticas en un entorno quimiosintético extremo . [5]
Esta especie habita en los campos de respiraderos hidrotermales del Océano Índico. Vive junto a fluidos de ventilación ácidos y reductores, en las paredes de chimeneas de humo negro o directamente en sitios de flujo difuso. [5]
La profundidad del campo Kairei varía de 2415 a 2460 m (7923 a 8071 pies), [8] y sus dimensiones son aproximadamente 30 por 80 m (98 por 262 pies). [8] La pendiente del campo es de 10° a 30°. [8] La roca del sustrato es troctolita y basalto empobrecido de dorsales en medio del océano . [31] Los gasterópodos de pies escamosos del campo Kairei viven en los fluidos difusos de baja temperatura de una sola chimenea. [14] La zona de transición, donde se encontraron estos gasterópodos, tiene aproximadamente 1 a 2 m (3 a 7 pies) de ancho, con una temperatura de 2 a 10 °C. [32] La temperatura del agua preferida para esta especie es de aproximadamente 5 °C. [33] Estos caracoles viven en un ambiente que tiene altas concentraciones de sulfuro de hidrógeno y bajas concentraciones de oxígeno. [33]
La abundancia de gasterópodos de patas escamosas fue menor en el campo Kairei que en el campo Longqi. [2] La comunidad de respiraderos hidrotermales de Kairei consta de 35 taxones, [34] que incluyen anémonas de mar Marianactis sp., crustáceos Austinograea rodriguezensis , Rimicaris kairei , Mirocaris indica , Munidopsis sp., género y sp. Neolepadidae , Eochionelasmus sp., bivalvos Bathymodiolus . marisindicus , gasterópodos Lepetodrilus sp., Pseudorimula sp., Eulepetopsis sp., Shinkailepas sp. y Alviniconcha marisindica , [35] Desbruyeresia marisindica , [36] Bruceiella wareni , [36] Phymorhynchus sp., Sutilizona sp., lapa hendida sp. 1, lapa hendida sp. 2, Iphinopsis boucheti , [36] solenogastres Helicoradomenia ? sp., anélidos Amphisamytha sp., Archinome jasoni , Capitellidae sp. 1, Ophyotrocha sp., Hesionidae sp. 1, Hesionoidae sp. 2, Branchinotogluma sp., Branchipolynoe sp., Harmothoe ? sp., Levensteiniella ? sp., Prionospio sp., Nemertea no identificada y Platyhelminthes no identificada . [34] Los gasterópodos de patas escamosas viven en colonias con caracoles Alviniconcha marisindica , y hay colonias de Rimicaris kairei encima de ellos. [33]
El campo Solitario se encuentra a una profundidad de 2.606 m (8.550 pies) y sus dimensiones son aproximadamente 50 por 50 m (160 por 160 pies). [14] La roca del sustrato está enriquecida con basalto de dorsal oceánica. [14] [31] Los gasterópodos de patas escamosas viven cerca de los fluidos difusos de alta temperatura de las chimeneas en el campo de ventilación. [14] La abundancia de gasterópodos de pies escamosos fue menor en el campo Solitaire que en el campo Longqi. [2] La comunidad de respiraderos hidrotermales de Solitario comprende 22 taxones, entre ellos: anémonas de mar Marianactis sp., crustáceos Austinograea rodriguezensis , Rimicaris kairei , Mirocaris indica , Munidopsis sp., Neolepadidae gen et sp., Eochionelasmus sp., bivalvos Bathymodiolus marisindicus , gasterópodos. Lepetodrilus sp., Eulepetopsis sp., Shinkailepas sp., Alviniconcha sp. tipo 3, Desbruyeresia sp., Phymorhynchus sp., anélidos Alvinellidae género y sp., Archinome jasoni , Branchinotogluma sp., equinodermos holoturios Apodacea gen et sp., peces Macrouridae género y sp., Nemertea no identificado y Platyhelminthes no identificados . [34]

El campo de ventilación de Longqi se encuentra a una profundidad de 2780 m (9120 pies), [2] y sus dimensiones son aproximadamente 100 por 150 m (330 por 490 pies). [20] C. squamiferum estaba densamente poblado en las áreas que rodeaban inmediatamente la ventilación de flujo difuso. [5] La comunidad de respiraderos hidrotermales de Longqi incluye 23 [Nota 1] taxones de macro y megafauna: anémonas de mar Actinostolidae sp., anélidos Polynoidae n. gen. norte. sp. “655”, Branchipolynoe n. sp. “Dragón”, Peinaleopolynoe n. sp. “Dragón”, Hesiolyra cf. bergi, Hesionidae sp. indet., Ophryotrocha n. sp. “F-038/1b”, Prionospio cf. unilamellata, Ampharetidae sp. indet., mejillones Bathymodiolus marisindicus , gasterópodos Gigantopelta aegis , [11] Dracogyra subfuscus , Lirapex politus , [16] Phymorhynchus n. sp. “SWIR” , Lepetodrilus n. sp. “SWIR”, crustáceos Neolepas sp. 1, Rimicaris kairei , Mirocaris indica , Chorocaris sp., Kiwa n. sp. “SWIR”17, Munidopsis sp. y holoturios equinodermos Chiridota sp. [17] [37] La densidad de Lepetodrilus n. sp. "SWIR" y gasterópodos de patas escamosas representan más de 100 caracoles por m 2 a poca distancia de las fuentes de fluido de ventilación en el campo de ventilación de Longqi. [37]
El gasterópodo de pies escamosos es un simbiotrofo obligado durante toda la vida posterior a la colonización. [24] A lo largo de su vida postlarval, el gasterópodo de patas escamosas obtiene toda su nutrición de la quimioautotrofia de sus bacterias endosimbióticas. [26] [24] El gasterópodo de patas escamosas no se alimenta por filtración [5] [24] ni utiliza otros mecanismos para alimentarse. [5] La rádula y el cartílago de la rádula son pequeños y constituyen respectivamente sólo el 0,4% y el 0,8% del volumen corporal de los juveniles, en comparación con el 1,4% y el 2,6% en los juveniles mixotróficos de Gigantopelta chessoia . [24]
Para identificar interacciones tróficas en un hábitat, donde la observación directa de los hábitos alimentarios es complicada, se pueden medir las composiciones de isótopos estables de carbono y nitrógeno. [32] Hay valores reducidos de δ 13 C en la glándula esofágica (en relación con el carbono orgánico derivado de la fotosíntesis). [26] Se suponía que los simbiontes quimioautótrofos eran una fuente de dicho carbono. [26] El origen quimioautótrofo del isótopo de carbono estable 13 C se confirmó experimentalmente. [29]
Este gasterópodo es hermafrodita simultáneo . [5] Es la única especie de la familia Peltospiridae que hasta ahora se sabe que es hermafrodita simultánea. [5] Tiene una alta fecundidad . [5] Pone huevos que probablemente sean de tipo lecitotrófico. [22] Los huevos del gasterópodo de patas escamosas flotan negativamente bajo presión atmosférica. [15] Ni las larvas ni la protoconcha se conocen en 2016, pero se cree que la especie tiene una etapa de dispersión planctónica. [22] Los especímenes juveniles de C. squamiferum más pequeños jamás recolectados tenían una longitud de caparazón de 2,2 mm. [24] Los resultados de los análisis estadísticos no revelaron diferenciación genética entre las dos poblaciones en los campos Kairei y Solitaire, lo que sugiere una posible conectividad entre los dos campos de ventilación. [15] La población de Kairei representa una población fuente potencial para las dos poblaciones en Central Indian Ridge. [15] Estos caracoles son difíciles de mantener vivos en un ambiente artificial; sin embargo, sobrevivieron en acuarios a presión atmosférica durante más de tres semanas. [33]
El gasterópodo de pies escamosos no está protegido. [1] [20] Se ha estimado que su hábitat potencial en todos los campos de respiraderos hidrotermales del Océano Índico es como máximo de 0,27 kilómetros cuadrados (67 acres), mientras que los tres sitios conocidos en los que se ha encontrado, entre los cuales solo se produce una migración insignificante, [38] suman 0,0177 kilómetros cuadrados (4,4 acres), [1] o menos de una quinta parte de un campo de fútbol. [20]
La población en el campo de respiraderos de Longqi puede ser motivo de especial preocupación. La Cordillera del Suroeste de la India, dentro de la cual se encuentra, es una de las dorsales en medio del océano que se expande más lentamente , y la baja tasa de perturbaciones naturales está asociada con comunidades ecológicas que probablemente son más sensibles a las perturbaciones y se recuperan más lentamente de ellas. Los centros de lenta expansión también pueden crear depósitos minerales más grandes, lo que convierte a esas áreas sensibles en objetivos principales para la minería en aguas profundas . Además, según medidas genéticas, la población de Longqi está mal conectada con la de los campos de ventilación de Kairei y Solitaire, a más de 2.000 km de distancia, dentro de la Cordillera India Central. [20]
El campo Solitaire Vent se encuentra dentro de la zona económica exclusiva de Mauricio, mientras que los otros dos sitios se encuentran dentro de áreas fuera de la jurisdicción nacional (comúnmente conocidas como alta mar ) bajo la autoridad de la Autoridad Internacional de los Fondos Marinos , que ha otorgado licencias de exploración minera comercial para ambos. . El Kairei Vent Field está bajo licencia para Alemania (2015-2030), el Longqi Vent Field para China (2011-2026). A partir de 2017, no se proponen ni existen medidas de conservación para ninguno de los tres sitios. [20]
Ha sido incluida como especie en peligro de extinción en la Lista Roja de Especies Amenazadas de la UICN desde el 4 de julio de 2019. [1]
{{cite journal}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace )