
Una exoenzima , o enzima extracelular , es una enzima secretada por una célula y que funciona fuera de ella . Las exoenzimas son producidas tanto por células procariotas como eucariotas y se ha demostrado que son un componente crucial de muchos procesos biológicos . La mayoría de las veces, estas enzimas están involucradas en la descomposición de macromoléculas más grandes . La descomposición de estas macromoléculas más grandes es fundamental para permitir que sus componentes pasen a través de la membrana celular y entren en la célula. Para los humanos y otros organismos complejos, este proceso se caracteriza mejor por el sistema digestivo que descompone los alimentos sólidos [1] a través de exoenzimas. Las pequeñas moléculas, generadas por la actividad de la exoenzima, ingresan a las células y se utilizan para varias funciones celulares. Las bacterias y los hongos también producen exoenzimas para digerir nutrientes en su entorno , y estos organismos pueden usarse para realizar ensayos de laboratorio para identificar la presencia y función de dichas exoenzimas. [2] Algunas especies patógenas también utilizan exoenzimas como factores de virulencia para ayudar en la propagación de estos microorganismos causantes de enfermedades . [3] Además de las funciones integrales en los sistemas biológicos, los humanos han utilizado diferentes clases de exoenzimas microbianas desde tiempos prehistóricos para propósitos tan diversos como la producción de alimentos , biocombustibles , producción textil y en la industria del papel . [4] Otro papel importante que cumplen las exoenzimas microbianas es en la ecología natural y la biorremediación de entornos terrestres y marinos [5] .
Se dispone de muy poca información sobre el descubrimiento original de las exoenzimas. Según el diccionario Merriam-Webster , el término "exoenzima" se reconoció por primera vez en el idioma inglés en 1908. [6] Se cree que el libro "Intracellular Enzymes: A Course of Lectures Given in the Physiological", de Horace Vernon, es la primera publicación que utilizó esta palabra en ese año. [7] Con base en el libro, se puede suponer que las primeras exoenzimas conocidas fueron la pepsina y la tripsina , ya que Vernon menciona que ambas fueron descubiertas por los científicos Briike y Kiihne antes de 1908. [8]
En las bacterias y los hongos , las exoenzimas desempeñan un papel fundamental para permitir que los organismos interactúen de manera eficaz con su entorno. Muchas bacterias utilizan enzimas digestivas para descomponer los nutrientes de su entorno. Una vez digeridos, estos nutrientes entran en la bacteria, donde se utilizan para impulsar las vías celulares con la ayuda de las endoenzimas . [9]
Muchas exoenzimas también se utilizan como factores de virulencia . Los patógenos , tanto bacterianos como fúngicos, pueden utilizar exoenzimas como mecanismo primario con el que causar enfermedades . [ cita requerida ] La actividad metabólica de las exoenzimas permite a la bacteria invadir organismos hospedadores descomponiendo las capas externas defensivas de las células hospedadoras o necrosando tejidos corporales de organismos más grandes. [3] Muchas bacterias gramnegativas tienen inyectisomas , o proyecciones similares a flagelos , para entregar directamente la exoenzima virulenta a la célula hospedadora utilizando un sistema de secreción de tipo tres . [10] Con cualquiera de los dos procesos, los patógenos pueden atacar la estructura y función de la célula hospedadora, así como su ADN nucleico. [11]
En las células eucariotas , las exoenzimas se fabrican como cualquier otra enzima a través de la síntesis de proteínas y se transportan a través de la vía secretora . Después de moverse a través del retículo endoplasmático rugoso , se procesan a través del aparato de Golgi , donde se empaquetan en vesículas y se liberan fuera de la célula. [12] En los humanos , la mayoría de estas exoenzimas se pueden encontrar en el sistema digestivo y se utilizan para la descomposición metabólica de macronutrientes a través de hidrólisis . La descomposición de estos nutrientes permite su incorporación a otras vías metabólicas . [13]
Fuente: [3]

Las enzimas necrosantes destruyen células y tejidos. Uno de los ejemplos más conocidos es una exoenzima producida por Streptococcus pyogenes que causa fascitis necrosante en humanos.
Al unirse a la protrombina , la coagulasa facilita la coagulación en una célula convirtiendo finalmente el fibrinógeno en fibrina . Las bacterias como el Staphylococcus aureus utilizan la enzima para formar una capa de fibrina alrededor de su célula para protegerse contra los mecanismos de defensa del huésped .

Las quinasas , que son las opuestas de la coagulasa, pueden disolver los coágulos. S. aureus también puede producir estafiloquinasa, lo que le permite disolver los coágulos que forma y difundirse rápidamente en el huésped en el momento correcto. [14]
De manera similar a la colagenasa, la hialuronidasa permite que un patógeno penetre profundamente en los tejidos. Las bacterias como Clostridium lo hacen utilizando la enzima para disolver el colágeno y el ácido hialurónico , la proteína y los sacáridos, respectivamente, que mantienen unidos los tejidos.
Las hemolisinas atacan a los eritrocitos, también conocidos como glóbulos rojos . Al atacar y lisar estas células, se daña al organismo huésped y se le proporciona al microorganismo, como el hongo Candida albicans , una fuente de hierro a partir de la hemoglobina lisada . [15] Los organismos pueden ser alfa-hemolíticos , beta-hemolíticos o gamma -hemolíticos (no hemolíticos).
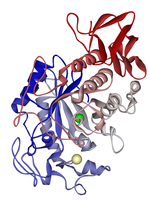
Las amilasas son un grupo de enzimas extracelulares ( glicósido hidrolasas ) que catalizan la hidrólisis del almidón en maltosa . Estas enzimas se agrupan en tres clases según sus secuencias de aminoácidos , mecanismo de reacción, método de catálisis y su estructura. [16] Las diferentes clases de amilasas son α-amilasas , β-amilasas y glucoamilasas . Las α-amilasas hidrolizan el almidón escindiendo aleatoriamente los enlaces 1,4-aD-glucosídicos entre las unidades de glucosa , las β-amilasas escinden los extremos de la cadena no reductora de los componentes del almidón como la amilosa , y las glucoamilasas hidrolizan las moléculas de glucosa de los extremos de la amilosa y la amilopectina . [17] Las amilasas son enzimas extracelulares de importancia crítica y se encuentran en plantas, animales y microorganismos . En los seres humanos, las amilasas son secretadas por el páncreas y las glándulas salivales, y ambas fuentes de la enzima son necesarias para la hidrólisis completa del almidón. [18]
La lipoproteína lipasa (LPL) es un tipo de enzima digestiva que ayuda a regular la absorción de triacilglicéridos de los quilomicrones y otras lipoproteínas de baja densidad de los tejidos grasos del cuerpo. [19] La función exoenzimática le permite descomponer el triacilglicerol en dos ácidos grasos libres y una molécula de monoacilglicerol . La LPL se puede encontrar en las células endoteliales de los tejidos grasos, como el tejido adiposo , el cardíaco y el muscular . [19] La lipoproteína lipasa se regula a la baja por niveles altos de insulina , [20] y se regula al alza por niveles altos de glucagón y adrenalina . [19]
Las pectinasas , también llamadas enzimas pectolíticas , son una clase de exoenzimas que participan en la descomposición de sustancias pécticas , especialmente la pectina . [21] Las pectinasas se pueden clasificar en dos grupos diferentes según su acción contra la cadena principal de galacturonano de la pectina: desesterificantes y despolimerizantes. [22] Estas exoenzimas se pueden encontrar tanto en plantas como en organismos microbianos, incluidos hongos y bacterias . [23] Las pectinasas se utilizan con mayor frecuencia para descomponer los elementos pécticos que se encuentran en las plantas y los productos derivados de las plantas.
Descubierta en 1836, la pepsina fue una de las primeras enzimas en ser clasificada como exoenzima. [8] La enzima es producida primero en la forma inactiva, pepsinógeno , por las células principales en el revestimiento del estómago . [24] Con un impulso del nervio vago , el pepsinógeno es secretado en el estómago, donde se mezcla con ácido clorhídrico para formar pepsina. [25] Una vez activa, la pepsina trabaja para descomponer las proteínas en alimentos como los lácteos , la carne y los huevos . [24] La pepsina funciona mejor en el pH del ácido gástrico , 1,5 a 2,5, y se desactiva cuando el ácido se neutraliza a un pH de 7. [24]
La tripsina , una de las primeras exoenzimas descubiertas, recibió su nombre en 1876, cuarenta años después de la pepsina. [26] Esta enzima es responsable de la descomposición de proteínas globulares grandes y su actividad es específica para escindir los lados C-terminales de los residuos de aminoácidos arginina y lisina . [26] Es el derivado del tripsinógeno , un precursor inactivo que se produce en el páncreas . [27] Cuando se secreta en el intestino delgado , se mezcla con la enteroquinasa para formar tripsina activa. Debido a su papel en el intestino delgado, la tripsina funciona a un pH óptimo de 8,0. [28]
La producción de una exoenzima digestiva particular por una célula bacteriana se puede evaluar mediante ensayos en placa . Las bacterias se extienden sobre el agar y se dejan incubar . La liberación de la enzima en el entorno de la célula provoca la descomposición de la macromolécula en la placa. Si no se produce una reacción, significa que la bacteria no crea una exoenzima capaz de interactuar con el entorno. Si se produce una reacción, queda claro que la bacteria posee una exoenzima, y qué macromolécula se hidroliza determina su identidad. [2]
La amilasa descompone los carbohidratos en mono y disacáridos, por lo que se debe utilizar un agar almidón para este ensayo. Una vez que la bacteria se extiende sobre el agar, la placa se inunda con yodo . Dado que el yodo se une al almidón pero no a sus subproductos digeridos , aparecerá un área clara donde se ha producido la reacción de la amilasa. Bacillus subtilis es una bacteria que da como resultado un ensayo positivo como se muestra en la imagen. [2]
Los análisis de lipasa se realizan utilizando un agar lipídico con un colorante azul alcohol . Si la bacteria tiene lipasa, se formará una veta clara en el agar y el colorante llenará el espacio vacío, creando un halo azul oscuro alrededor del área despejada. El Staphylococcus epidermidis da como resultado un análisis de lipasa positivo. [2]
Las fuentes microbiológicas de exoenzimas, incluidas las amilasas , proteasas , pectinasas, lipasas , xilanasas y celulasas , se utilizan para una amplia gama de usos biotecnológicos e industriales , incluida la generación de biocombustibles , la producción de alimentos , la fabricación de papel, los detergentes y la producción textil . [4] La optimización de la producción de biocombustibles ha sido un foco de atención de los investigadores en los últimos años y se centra en el uso de microorganismos para convertir la biomasa en etanol . Las enzimas que son de particular interés en la producción de etanol son la celobiohidrolasa, que solubiliza la celulosa cristalina, y la xilanasa , que hidroliza el xilano en xilosa . [29] Un modelo de producción de biocombustibles es el uso de una población mixta de cepas bacterianas o un consorcio que trabaja para facilitar la descomposición de los materiales de celulosa en etanol mediante la secreción de exoenzimas como celulasas y lacasas. [29] Además del importante papel que desempeña en la producción de biocombustibles, la xilanasa se utiliza en una serie de otras aplicaciones industriales y biotecnológicas debido a su capacidad para hidrolizar la celulosa y la hemicelulosa . Estas aplicaciones incluyen la descomposición de desechos agrícolas y forestales, como aditivo alimentario para facilitar una mayor absorción de nutrientes por parte del ganado y como ingrediente en la elaboración del pan para mejorar la textura y el volumen del mismo. [30]

Las lipasas son una de las exoenzimas más utilizadas en biotecnología y aplicaciones industriales . Las lipasas son enzimas ideales para estas aplicaciones porque son altamente selectivas en su actividad, son producidas y secretadas fácilmente por bacterias y hongos , su estructura cristalina está bien caracterizada, no requieren cofactores para su actividad enzimática y no catalizan reacciones secundarias. [31] La gama de usos de las lipasas abarca la producción de biopolímeros, la generación de cosméticos, el uso como herbicida y como disolvente eficaz. [31] Sin embargo, quizás el uso más conocido de las lipasas en este campo es su uso en la producción de combustible biodiésel. En esta función, las lipasas se utilizan para convertir aceite vegetal en metil y otros ésteres de alcohol de cadena corta mediante una única reacción de transesterificación . [32]
Las celulasas , hemicelulasas y pectinasas son diferentes exoenzimas que están involucradas en una amplia variedad de aplicaciones biotecnológicas e industriales. En la industria alimentaria estas exoenzimas se utilizan en la producción de jugos de frutas , néctares de frutas, purés de frutas y en la extracción de aceite de oliva entre muchas otras. [33] El papel que juegan estas enzimas en estas aplicaciones alimentarias es descomponer parcialmente las paredes celulares de las plantas y la pectina . Además del papel que juegan en la producción de alimentos , las celulasas se utilizan en la industria textil para eliminar el exceso de tinte de la mezclilla , suavizar las telas de algodón y restaurar el brillo del color de las telas de algodón. [33] Las celulasas y hemicelulasas (incluidas las xilanasas) también se utilizan en la industria del papel y la pulpa para destintar fibras recicladas , modificar pulpa mecánica gruesa y para la hidrólisis parcial o completa de las fibras de pulpa. [33] Las celulasas y hemicelulasas se utilizan en estas aplicaciones industriales debido a su capacidad para hidrolizar los componentes de celulosa y hemicelulosa que se encuentran en estos materiales.

La biorremediación es un proceso en el que se eliminan contaminantes del medio ambiente mediante el uso de organismos biológicos o sus productos. La eliminación de estos contaminantes, a menudo peligrosos , se lleva a cabo principalmente mediante microorganismos naturales o introducidos deliberadamente que son capaces de descomponer o absorber el contaminante deseado. Los tipos de contaminantes que a menudo son el objetivo de las estrategias de biorremediación son los productos derivados del petróleo (incluido el aceite y los disolventes ) y los pesticidas . [34] Además de la capacidad de los microorganismos para digerir y absorber los contaminantes, sus exoenzimas secretadas desempeñan un papel importante en muchas estrategias de biorremediación. [35]
Se ha demostrado que los hongos son organismos viables para realizar biorremediación y se han utilizado para ayudar en la descontaminación de una serie de contaminantes, incluidos hidrocarburos aromáticos policíclicos (HAP), pesticidas , tintes sintéticos , clorofenoles , explosivos , petróleo crudo y muchos otros. [36] Si bien los hongos pueden descomponer muchos de estos contaminantes intracelularmente , también secretan numerosas exoenzimas oxidativas que funcionan extracelularmente . Un aspecto crítico de los hongos con respecto a la biorremediación es que secretan estas exoenzimas oxidativas desde sus puntas hifales cada vez más alargadas . [36] Las lacasas son una enzima oxidativa importante que los hongos secretan y utilizan oxígeno para oxidar muchos contaminantes. Algunos de los contaminantes que se han utilizado las lacasas para tratar incluyen efluentes que contienen tintes de la industria textil, contaminantes de aguas residuales (clorofenoles, HAP, etc.) y compuestos que contienen azufre del procesamiento del carbón . [36]
Las bacterias también son una fuente viable de exoenzimas capaces de facilitar la biorremediación del medio ambiente. Hay muchos ejemplos del uso de bacterias para este propósito y sus exoenzimas abarcan muchas clases diferentes de enzimas bacterianas. De particular interés en este campo son las hidrolasas bacterianas , ya que tienen una baja especificidad de sustrato intrínseca y se pueden utilizar para numerosos contaminantes, incluidos los desechos sólidos. [37] Los desechos plásticos , incluidos los poliuretanos , son particularmente difíciles de degradar, pero se ha identificado una exoenzima en una bacteria Gram-negativa , Comamonas acidovorans , que era capaz de degradar los desechos de poliuretano en el medio ambiente. [37] El uso libre de células de exoenzimas microbianas como agentes de biorremediación también es posible, aunque su actividad a menudo no es tan robusta e introducir las enzimas en ciertos entornos como el suelo ha sido un desafío. [37] Además de los microorganismos de base terrestre, las bacterias de base marina y sus exoenzimas muestran potencial como candidatos en el campo de la biorremediación. Las bacterias de origen marino se han utilizado en la eliminación de metales pesados , la degradación de petróleo/ diésel y en la eliminación de hidrocarburos poliaromáticos, entre otros. [38]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: |first=tiene nombre genérico ( ayuda )Mantenimiento de CS1: varios nombres: lista de autores ( enlace )