
La virología es el estudio científico de los virus biológicos . Es un subcampo de la microbiología que se centra en su detección, estructura, clasificación y evolución, sus métodos de infección y explotación de las células huésped para la reproducción, su interacción con la fisiología e inmunidad del organismo huésped, las enfermedades que causan, las técnicas para aislarlos y cultivarlos, y su uso en investigación y terapia.
La identificación del agente causal de la enfermedad del mosaico del tabaco (TMV) como un nuevo patógeno por parte de Martinus Beijerinck (1898) se reconoce hoy como el inicio oficial del campo de la virología como disciplina distinta de la bacteriología . Se dio cuenta de que la fuente no era una infección bacteriana ni fúngica , sino algo completamente diferente. Beijerinck utilizó la palabra "virus" para describir al misterioso agente en su " contagium vivum fluidum " ("fluido vivo contagioso"). Rosalind Franklin propuso la estructura completa del virus del mosaico del tabaco en 1955.
Una de las principales motivaciones para el estudio de los virus es que causan muchas enfermedades infecciosas en plantas y animales. [1] El estudio de la forma en que los virus causan enfermedades se denomina patogénesis viral . El grado en que un virus causa enfermedades se denomina virulencia . [2] Estos campos de estudio se denominan virología vegetal , virología animal y virología humana o médica . [3]
La virología comenzó cuando no existían métodos para propagar o visualizar virus ni pruebas de laboratorio específicas para infecciones virales. No existían los métodos para separar los ácidos nucleicos virales ( ARN y ADN ) y las proteínas , que ahora son el pilar de la virología. Ahora hay muchos métodos para observar la estructura y las funciones de los virus y sus componentes. Hoy en día se conocen miles de virus diferentes y los virólogos a menudo se especializan en los virus que infectan a las plantas, las bacterias y otros microorganismos o los animales. Los virus que infectan a los humanos ahora son estudiados por virólogos médicos. La virología es una disciplina amplia que abarca la biología, la salud, el bienestar animal, la agricultura y la ecología.

Louis Pasteur no pudo encontrar un agente causal de la rabia y especuló sobre un patógeno demasiado pequeño para ser detectado por microscopios. [4] En 1884, el microbiólogo francés Charles Chamberland inventó el filtro Chamberland (o filtro Pasteur-Chamberland) con poros lo suficientemente pequeños para eliminar todas las bacterias de una solución que pasara a través de él. [5] En 1892, el biólogo ruso Dmitri Ivanovsky utilizó este filtro para estudiar lo que ahora se conoce como el virus del mosaico del tabaco : los extractos de hojas trituradas de plantas de tabaco infectadas seguían siendo infecciosos incluso después de la filtración para eliminar las bacterias. Ivanovsky sugirió que la infección podría ser causada por una toxina producida por bacterias, pero no siguió adelante con la idea. [6] En ese momento se pensaba que todos los agentes infecciosos podían ser retenidos por filtros y cultivados en un medio nutritivo; esto era parte de la teoría de los gérmenes de la enfermedad . [7]
En 1898, el microbiólogo holandés Martinus Beijerinck repitió los experimentos y se convenció de que la solución filtrada contenía una nueva forma de agente infeccioso. [8] Observó que el agente se multiplicaba solo en las células que se estaban dividiendo, pero como sus experimentos no demostraban que estuviera hecho de partículas, lo llamó contagium vivum fluidum (germen vivo soluble) y reintrodujo la palabra virus . Beijerinck sostuvo que los virus eran de naturaleza líquida, una teoría posteriormente desacreditada por Wendell Stanley , quien demostró que eran particulados. [6] En el mismo año, Friedrich Loeffler y Paul Frosch pasaron el primer virus animal, el aftovirus (el agente de la fiebre aftosa ), a través de un filtro similar. [9]
A principios del siglo XX, el bacteriólogo inglés Frederick Twort descubrió un grupo de virus que infectan bacterias, ahora llamados bacteriófagos [10] (o comúnmente 'fagos'), y el microbiólogo franco-canadiense Félix d'Herelle describió virus que, cuando se agregaban a bacterias en una placa de agar , producirían áreas de bacterias muertas. Diluyó con precisión una suspensión de estos virus y descubrió que las diluciones más altas (concentraciones de virus más bajas), en lugar de matar todas las bacterias, formaban áreas discretas de organismos muertos. Contar estas áreas y multiplicarlas por el factor de dilución le permitió calcular la cantidad de virus en la suspensión original. [11] Los fagos fueron anunciados como un tratamiento potencial para enfermedades como la fiebre tifoidea y el cólera , pero su promesa se olvidó con el desarrollo de la penicilina . El desarrollo de resistencia bacteriana a los antibióticos ha renovado el interés en el uso terapéutico de los bacteriófagos. [12]
A finales del siglo XIX, los virus se definieron en términos de su infectividad , su capacidad para pasar filtros y su necesidad de huéspedes vivos. Los virus se habían cultivado solo en plantas y animales. En 1906, Ross Granville Harrison inventó un método para cultivar tejido en la linfa , y en 1913 E. Steinhardt, C. Israeli y RA Lambert utilizaron este método para cultivar el virus vaccinia en fragmentos de tejido corneal de cobaya. [13] En 1928, HB Maitland y MC Maitland cultivaron el virus vaccinia en suspensiones de riñones de gallina picados. Su método no fue ampliamente adoptado hasta la década de 1950, cuando el poliovirus se cultivó a gran escala para la producción de vacunas. [14]
Otro gran avance se produjo en 1931, cuando el patólogo estadounidense Ernest William Goodpasture y Alice Miles Woodruff cultivaron el virus de la gripe y otros virus en huevos de gallina fertilizados. [15] En 1949, John Franklin Enders , Thomas Weller y Frederick Robbins cultivaron el virus de la polio en células cultivadas a partir de tejido embrionario humano abortado, [16] el primer virus que se cultivó sin utilizar tejido animal sólido ni huevos. Este trabajo permitió a Hilary Koprowski , y luego a Jonas Salk , fabricar una vacuna eficaz contra la polio . [17]
Las primeras imágenes de virus se obtuvieron tras la invención de la microscopía electrónica en 1931 por los ingenieros alemanes Ernst Ruska y Max Knoll . [18] En 1935, el bioquímico y virólogo estadounidense Wendell Meredith Stanley examinó el virus del mosaico del tabaco y descubrió que estaba compuesto principalmente de proteínas. [19] Poco tiempo después, este virus se separó en partes de proteína y ARN. [20] El virus del mosaico del tabaco fue el primero en cristalizarse y, por lo tanto, su estructura pudo dilucidarse en detalle. Las primeras imágenes de difracción de rayos X del virus cristalizado fueron obtenidas por Bernal y Fankuchen en 1941. Basándose en sus imágenes cristalográficas de rayos X, Rosalind Franklin descubrió la estructura completa del virus en 1955. [21] Ese mismo año, Heinz Fraenkel-Conrat y Robley Williams demostraron que el ARN purificado del virus del mosaico del tabaco y su capa proteica pueden ensamblarse por sí solos para formar virus funcionales, lo que sugiere que este mecanismo simple fue probablemente el medio a través del cual se crearon los virus dentro de sus células huésped. [22]
La segunda mitad del siglo XX fue la edad de oro del descubrimiento de virus, y la mayoría de las especies documentadas de virus animales, vegetales y bacterianos se descubrieron durante estos años. [23] En 1957 se descubrieron el arterivirus equino y la causa de la diarrea viral bovina (un pestivirus ). En 1963, Baruch Blumberg descubrió el virus de la hepatitis B , [24] y en 1965 Howard Temin describió el primer retrovirus . La transcriptasa inversa , la enzima que utilizan los retrovirus para hacer copias de ADN de su ARN, fue descrita por primera vez en 1970 por Temin y David Baltimore de forma independiente. [25] En 1983, el equipo de Luc Montagnier en el Instituto Pasteur en Francia, aisló por primera vez el retrovirus ahora llamado VIH. [ 26] En 1989, el equipo de Michael Houghton en Chiron Corporation descubrió la hepatitis C. [27] [28]

Existen varios enfoques para detectar virus, entre ellos la detección de partículas virales (viriones) o sus antígenos o ácidos nucleicos y ensayos de infectividad.

Los virus se observaron por primera vez en la década de 1930, cuando se inventaron los microscopios electrónicos. Estos microscopios utilizan haces de electrones en lugar de luz, que tienen una longitud de onda mucho más corta y pueden detectar objetos que no se pueden ver con microscopios ópticos. El aumento máximo que se puede obtener con microscopios electrónicos es de hasta 10.000.000 de veces [29], mientras que con microscopios ópticos es de alrededor de 1.500 veces. [30]
Los virólogos suelen utilizar la tinción negativa para visualizar los virus. En este procedimiento, los virus se suspenden en una solución de sales metálicas como el acetato de uranio. Los átomos de metal son opacos a los electrones y los virus se ven suspendidos en un fondo oscuro de átomos de metal. [29] Esta técnica se utiliza desde la década de 1950. [31] Se descubrieron muchos virus utilizando esta técnica y la microscopía electrónica con tinción negativa sigue siendo un arma valiosa en el arsenal de un virólogo. [32]
La microscopía electrónica tradicional tiene desventajas, ya que los virus se dañan al secarse en el alto vacío dentro del microscopio electrónico y el haz de electrones en sí es destructivo. [29] En la microscopía electrónica criogénica, la estructura de los virus se preserva al incrustarlos en un entorno de agua vítrea . [33] Esto permite la determinación de estructuras biomoleculares con una resolución cercana a la atómica, [34] y ha atraído una amplia atención al enfoque como una alternativa a la cristalografía de rayos X o la espectroscopia de RMN para la determinación de la estructura de los virus. [35]
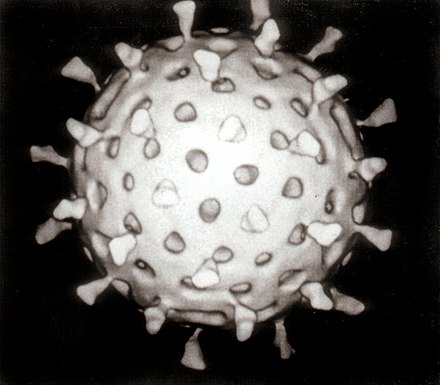
Los virus son parásitos intracelulares obligados y, como sólo se reproducen dentro de las células vivas de un huésped, se necesitan estas células para cultivarlos en el laboratorio. Para los virus que infectan a los animales (normalmente llamados "virus animales") se utilizan células cultivadas en cultivos celulares de laboratorio . En el pasado, se utilizaban huevos de gallina fértiles y los virus se cultivaban en las membranas que rodeaban al embrión. Este método todavía se utiliza en la fabricación de algunas vacunas. Para los virus que infectan a las bacterias, se pueden utilizar directamente los bacteriófagos , las bacterias que crecen en tubos de ensayo. Para los virus de las plantas, se pueden utilizar las plantas hospedadoras naturales o, sobre todo cuando la infección no es evidente, las denominadas plantas indicadoras, que muestran los signos de infección con mayor claridad. [36] [37]

Los virus que han crecido en cultivos celulares pueden detectarse indirectamente por el efecto perjudicial que tienen sobre la célula huésped. Estos efectos citopáticos suelen ser característicos del tipo de virus. Por ejemplo, los virus del herpes simple producen una "inflamación" característica de las células, típicamente fibroblastos humanos . Algunos virus, como el virus de las paperas, hacen que los glóbulos rojos de los pollos se adhieran firmemente a las células infectadas. Esto se llama "hemadsorción" o "hemadsorción". Algunos virus producen "lesiones" localizadas en capas celulares llamadas placas , que son útiles en ensayos de cuantificación y en la identificación de la especie de virus mediante ensayos de reducción de placa . [38] [39]
Los virus que crecen en cultivos celulares se utilizan para medir su susceptibilidad a fármacos antivirales nuevos y validados . [40]
Los virus son antígenos que inducen la producción de anticuerpos y estos anticuerpos pueden usarse en laboratorios para estudiar los virus. Los virus relacionados a menudo reaccionan con los anticuerpos de los demás y algunos virus pueden nombrarse en función de los anticuerpos con los que reaccionan. El uso de anticuerpos que antes se derivaban exclusivamente del suero (fluido sanguíneo) de animales se llama serología . [41] Una vez que se ha producido una reacción de anticuerpos en una prueba, se necesitan otros métodos para confirmarla. Los métodos más antiguos incluían pruebas de fijación del complemento , [42] inhibición de la hemaglutinación y neutralización del virus . [43] Los métodos más nuevos utilizan inmunoensayos enzimáticos (EIA). [44]
En los años previos a la invención de la PCR, se utilizaba la inmunofluorescencia para confirmar rápidamente las infecciones virales. Se trata de un ensayo de infectividad que es específico de la especie del virus porque se utilizan anticuerpos. Los anticuerpos se marcan con un colorante que es luminiscente y, cuando se utiliza un microscopio óptico con una fuente de luz modificada, las células infectadas brillan en la oscuridad. [45]
La PCR es un método fundamental para detectar virus en todas las especies, incluidas plantas y animales. Funciona detectando trazas de ARN o ADN específicos del virus. Es muy sensible y específica, pero puede verse fácilmente comprometida por la contaminación. La mayoría de las pruebas utilizadas en virología veterinaria y virología médica se basan en PCR o métodos similares, como la amplificación mediada por transcripción . Cuando surge un virus nuevo, como el coronavirus covid, se puede diseñar una prueba específica rápidamente siempre que se haya secuenciado el genoma viral y se hayan identificado regiones únicas del ADN o ARN viral. [46] La invención de las pruebas de microfluidos ha permitido que la mayoría de estas pruebas se automaticen, [47] A pesar de su especificidad y sensibilidad, la PCR tiene la desventaja de que no diferencia los virus infecciosos de los no infecciosos y las "pruebas de curación" deben retrasarse hasta 21 días para permitir que el ácido nucleico viral residual se elimine del sitio de la infección. [48]
En los laboratorios, muchas de las pruebas diagnósticas para detectar virus son métodos de amplificación de ácidos nucleicos como la PCR. Algunas pruebas detectan los virus o sus componentes, como la microscopía electrónica y los inmunoensayos enzimáticos . Los aparatos denominados "caseros" o "auto" de prueba suelen ser pruebas de flujo lateral , que detectan el virus utilizando un anticuerpo monoclonal marcado . [49] También se utilizan en agricultura, alimentación y ciencias ambientales. [50]
El recuento de virus (cuantificación) siempre ha tenido un papel importante en virología y se ha vuelto central para el control de algunas infecciones de humanos donde se mide la carga viral . [51] Hay dos métodos básicos: aquellos que cuentan las partículas virales completamente infecciosas, que se denominan ensayos de infectividad, y aquellos que cuentan todas las partículas, incluidas las defectuosas. [29]

Los ensayos de infectividad miden la cantidad (concentración) de virus infecciosos en una muestra de volumen conocido. [52] Para las células huésped, se utilizan plantas o cultivos de células bacterianas o animales. También se han utilizado animales de laboratorio como ratones, particularmente en virología veterinaria. [53] Estos son ensayos cuantitativos donde los resultados están en una escala continua o cuánticos, donde un evento ocurre o no. Los ensayos cuantitativos dan valores absolutos y los ensayos cuánticos dan una probabilidad estadística como el volumen de la muestra de prueba necesaria para asegurar que el 50% de las células huésped, plantas o animales estén infectados. Esto se llama dosis infecciosa media o ID 50. [54] Los bacteriófagos infecciosos se pueden contar sembrándolos en "céspedes" de bacterias en placas de cultivo . Cuando están en bajas concentraciones, los virus forman agujeros en el césped que se pueden contar. El número de virus se expresa luego como unidades formadoras de placa . Para los bacteriófagos que se reproducen en bacterias que no pueden crecer en cultivos, se utilizan ensayos de carga viral. [55]

El ensayo de formación de focos (FFA) es una variación del ensayo de placa, pero en lugar de basarse en la lisis celular para detectar la formación de placa, el FFA emplea técnicas de inmunotinción que utilizan anticuerpos marcados con fluorescencia específicos para un antígeno viral para detectar células huésped infectadas y partículas virales infecciosas antes de que se forme una placa real. El FFA es particularmente útil para cuantificar clases de virus que no lisan las membranas celulares, ya que estos virus no serían susceptibles al ensayo de placa. Al igual que el ensayo de placa, las monocapas de células huésped se infectan con varias diluciones de la muestra de virus y se dejan incubar durante un período de incubación relativamente breve (p. ej., 24 a 72 horas) bajo un medio de superposición semisólido que restringe la propagación del virus infeccioso, creando grupos localizados (focos) de células infectadas. Posteriormente, las placas se sondean con anticuerpos marcados con fluorescencia contra un antígeno viral y se utiliza microscopía de fluorescencia para contar y cuantificar el número de focos. El método FFA generalmente produce resultados en menos tiempo que los ensayos de placa o de dosis infecciosa de cultivo de tejido al cincuenta por ciento (TCID50 ) , pero puede ser más costoso en términos de reactivos y equipos requeridos. El tiempo de finalización del ensayo también depende del tamaño del área que el usuario esté contando. Un área más grande requerirá más tiempo pero puede proporcionar una representación más precisa de la muestra. Los resultados del FFA se expresan como unidades formadoras de focos por mililitro, o FFU/ [56]
Cuando se realiza un ensayo para medir la partícula viral infecciosa (ensayo de placa, ensayo de foco), el título viral a menudo se refiere a la concentración de partículas virales infecciosas, que es diferente de las partículas virales totales. Los ensayos de carga viral generalmente cuentan el número de genomas virales presentes en lugar del número de partículas y utilizan métodos similares a la PCR . [57] Las pruebas de carga viral son importantes en el control de infecciones por VIH. [58] Este método versátil se puede utilizar para virus de plantas. [59] [60]
La virología molecular es el estudio de los virus a nivel de ácidos nucleicos y proteínas. Los métodos inventados por los biólogos moleculares han demostrado ser útiles en virología. Su pequeño tamaño y sus estructuras relativamente simples hacen de los virus un candidato ideal para el estudio mediante estas técnicas.

Para su posterior estudio, los virus cultivados en el laboratorio necesitan purificarse para eliminar los contaminantes de las células huésped. Los métodos utilizados suelen tener la ventaja de concentrar los virus, lo que facilita su investigación.
Las centrífugas se utilizan a menudo para purificar virus. Las centrífugas de baja velocidad, es decir, aquellas con una velocidad máxima de 10.000 revoluciones por minuto (rpm) no son lo suficientemente potentes para concentrar virus, pero las ultracentrífugas con una velocidad máxima de alrededor de 100.000 rpm, sí lo son y esta diferencia se utiliza en un método llamado centrifugación diferencial . En este método, los contaminantes más grandes y pesados se eliminan de una mezcla de virus mediante centrifugación a baja velocidad. Los virus, que son pequeños y ligeros y se dejan en suspensión, se concentran luego mediante centrifugación a alta velocidad. [62]
Después de la centrifugación diferencial, las suspensiones de virus a menudo permanecen contaminadas con restos que tienen el mismo coeficiente de sedimentación y no se eliminan mediante el procedimiento. En estos casos se utiliza una modificación de la centrifugación, llamada centrifugación de densidad flotante . En este método, los virus recuperados de la centrifugación diferencial se centrifugan nuevamente a una velocidad muy alta durante varias horas en soluciones densas de azúcares o sales que forman un gradiente de densidad, de bajo a alto, en el tubo durante la centrifugación. En algunos casos, se utilizan gradientes preformados en los que las soluciones de densidad decreciente constante se superponen cuidadosamente unas sobre otras. Como un objeto en el Mar Muerto , a pesar de la fuerza centrífuga, las partículas de virus no pueden hundirse en soluciones que son más densas que ellas y forman capas discretas de virus concentrados, a menudo visibles, en el tubo. El cloruro de cesio se utiliza a menudo para estas soluciones, ya que es relativamente inerte pero forma fácilmente un gradiente cuando se centrifuga a alta velocidad en una ultracentrífuga. [61] La centrifugación por densidad flotante también se puede utilizar para purificar los componentes de los virus, como sus ácidos nucleicos o proteínas. [63]
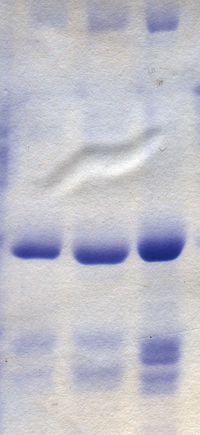
La separación de moléculas en función de su carga eléctrica se denomina electroforesis . Los virus y todos sus componentes se pueden separar y purificar utilizando este método. Esto se hace generalmente en un medio de soporte como geles de agarosa y poliacrilamida . Las moléculas separadas se revelan utilizando tinciones como azul de coomasie , para proteínas, o bromuro de etidio para ácidos nucleicos. En algunos casos, los componentes virales se vuelven radiactivos antes de la electroforesis y se revelan utilizando película fotográfica en un proceso conocido como autorradiografía . [64]
Como la mayoría de los virus son demasiado pequeños para ser vistos por un microscopio óptico, la secuenciación es una de las principales herramientas en virología para identificar y estudiar el virus. La secuenciación tradicional de Sanger y la secuenciación de próxima generación (NGS) se utilizan para secuenciar virus en investigación básica y clínica, así como para el diagnóstico de infecciones virales emergentes, epidemiología molecular de patógenos virales y pruebas de resistencia a fármacos. Hay más de 2,3 millones de secuencias virales únicas en GenBank. [65] La NGS ha superado a Sanger tradicional como el enfoque más popular para generar genomas virales. [65] La secuenciación del genoma viral se ha convertido en un método central en la epidemiología viral y la clasificación viral .
Los datos de la secuenciación de genomas virales se pueden utilizar para determinar relaciones evolutivas, lo que se denomina análisis filogenético . [66] Se utilizan programas informáticos, como PHYLIP , para dibujar árboles filogenéticos . Este análisis también se utiliza para estudiar la propagación de infecciones virales en comunidades ( epidemiología ). [67]
Cuando se necesitan virus purificados o componentes virales para pruebas de diagnóstico o vacunas, se puede utilizar la clonación en lugar de cultivar los virus. [68] Al comienzo de la pandemia de COVID-19, la disponibilidad de la secuencia de ARN del coronavirus 2 del síndrome respiratorio agudo severo permitió fabricar pruebas rápidamente. [69] Existen varios métodos probados para clonar virus y sus componentes. A menudo se utilizan pequeños fragmentos de ADN llamados vectores de clonación y los más comunes son plásmidos modificados en laboratorio (pequeñas moléculas circulares de ADN producidas por bacterias). El ácido nucleico viral, o una parte de él, se inserta en el plásmido, que es copiado muchas veces por las bacterias. Este ADN recombinante puede luego usarse para producir componentes virales sin la necesidad de virus nativos. [70]
Los virus que se reproducen en bacterias, arqueas y hongos se denominan informalmente "fagos", [71] y los que infectan a las bacterias -bacteriófagos- en particular son útiles en virología y biología en general. [72] Los bacteriófagos fueron algunos de los primeros virus que se descubrieron, a principios del siglo XX, [73] y debido a que son relativamente fáciles de cultivar rápidamente en laboratorios, gran parte de nuestro conocimiento sobre los virus se originó al estudiarlos. [73] Los bacteriófagos, conocidos desde hace mucho tiempo por sus efectos positivos en el medio ambiente, se utilizan en técnicas de visualización de fagos para analizar secuencias de ADN de proteínas. Son una herramienta poderosa en biología molecular. [74]
Todos los virus tienen genes que se estudian mediante la genética . [75] En la genética viral se utilizan todas las técnicas utilizadas en biología molecular, como la clonación, la creación de mutaciones y el silenciamiento del ARN . [76]
La redistribución es el intercambio de genes de diferentes progenitores y es particularmente útil cuando se estudia la genética de virus que tienen genomas segmentados (fragmentados en dos o más moléculas de ácido nucleico) como los virus de la gripe y los rotavirus . Los genes que codifican propiedades como el serotipo se pueden identificar de esta manera. [77]
La recombinación, que suele confundirse con la redistribución, también es la mezcla de genes, pero el mecanismo difiere en que, durante el ciclo de replicación del ARN o del ADN, se unen fragmentos de moléculas de ADN o ARN, en lugar de moléculas completas. La recombinación no es tan común como la redistribución en la naturaleza, pero es una herramienta poderosa en los laboratorios para estudiar la estructura y las funciones de los genes virales. [78]
La genética inversa es un método de investigación poderoso en virología. [79] En este procedimiento, se utilizan copias de ADN complementario (ADNc) de genomas virales llamados "clones infecciosos" para producir virus modificados genéticamente que luego pueden analizarse para detectar cambios en, por ejemplo, la virulencia o la transmisibilidad. [80]
Una rama importante de la virología es la clasificación de los virus . Es artificial en el sentido de que no se basa en la filogenética evolutiva , sino en las propiedades compartidas o distintivas de los virus. [81] [82] Busca describir la diversidad de los virus nombrándolos y agrupándolos en función de sus similitudes. [83] En 1962, André Lwoff , Robert Horne y Paul Tournier fueron los primeros en desarrollar un medio de clasificación de los virus, basado en el sistema jerárquico de Linneo . [84] Este sistema basaba la clasificación en filo , clase , orden , familia , género y especie . Los virus se agrupaban según sus propiedades compartidas (no las de sus huéspedes) y el tipo de ácido nucleico que formaba sus genomas. [85] En 1966, se formó el Comité Internacional de Taxonomía de Virus (ICTV). El sistema propuesto por Lwoff, Horne y Tournier no fue aceptado inicialmente por el ICTV porque el pequeño tamaño del genoma de los virus y su alta tasa de mutación dificultaban la determinación de su ascendencia más allá del orden. Como tal, el sistema de clasificación de Baltimore ha llegado a utilizarse para complementar la jerarquía más tradicional. [86] A partir de 2018, el ICTV comenzó a reconocer relaciones evolutivas más profundas entre los virus que se han descubierto con el tiempo y adoptó un sistema de clasificación de 15 rangos que van desde el reino hasta la especie. [87] Además, algunas especies dentro del mismo género se agrupan en un genogrupo . [88] [89]
El ICTV desarrolló el sistema de clasificación actual y redactó pautas que dan mayor importancia a ciertas propiedades de los virus para mantener la uniformidad familiar. Se ha establecido una taxonomía unificada (un sistema universal para clasificar los virus). Solo se ha estudiado una pequeña parte de la diversidad total de virus. [90] En 2021, el ICTV ha definido 6 reinos, 10 reinos, 17 filos, 2 subfilos, 39 clases, 65 órdenes, 8 subórdenes, 233 familias, 168 subfamilias , 2606 géneros, 84 subgéneros y 10 434 especies de virus. [91]
A continuación se muestra la estructura taxonómica general de los rangos de taxones y los sufijos utilizados en los nombres taxonómicos. A partir de 2021, los rangos de subreino, subreino y subclase no se utilizan, mientras que todos los demás rangos están en uso. [91]

El biólogo ganador del Premio Nobel David Baltimore ideó el sistema de clasificación de Baltimore . [92]
La clasificación de Baltimore de los virus se basa en el mecanismo de producción del ARNm . Los virus deben generar ARNm a partir de sus genomas para producir proteínas y replicarse, pero se utilizan diferentes mecanismos para lograrlo en cada familia de virus. Los genomas virales pueden ser monocatenarios (ss) o bicatenarios (ds), de ARN o ADN, y pueden utilizar o no la transcriptasa inversa (RT). Además, los virus ssRNA pueden ser sentido (+) o antisentido (−). Esta clasificación coloca a los virus en siete grupos:
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )