La proteína fluorescente verde ( GFP ) es una proteína que exhibe fluorescencia verde cuando se expone a la luz en el rango azul a ultravioleta . [2] [3] La etiqueta GFP se refiere tradicionalmente a la proteína aislada por primera vez de la medusa Aequorea victoria y a veces se llama avGFP . Sin embargo, se han encontrado GFP en otros organismos, incluidos corales , anémonas de mar , zoanítidos , copépodos y lancetas . [4]
La GFP de A. victoria tiene un pico de excitación principal en una longitud de onda de 395 nm y uno menor en 475 nm. Su pico de emisión está en 509 nm, que está en la porción verde inferior del espectro visible . El rendimiento cuántico de fluorescencia (QY) de GFP es 0,79. La GFP de la flor de mar ( Renilla reniformis ) tiene un único pico de excitación principal en 498 nm. La GFP es una excelente herramienta en muchas formas de biología debido a su capacidad para formar un cromóforo interno sin requerir ningún cofactor accesorio , productos genéticos o enzimas / sustratos distintos del oxígeno molecular. [5]
En biología celular y molecular, el gen GFP se utiliza frecuentemente como un reportero de expresión . [6] Se ha utilizado en formas modificadas para hacer biosensores , y se han creado muchos animales que expresan GFP, lo que demuestra una prueba de concepto de que un gen puede expresarse en todo un organismo determinado, en órganos seleccionados o en células de interés. GFP puede introducirse en animales u otras especies a través de técnicas transgénicas , y mantenerse en su genoma y en el de su descendencia. GFP se ha expresado en muchas especies, incluidas bacterias, levaduras, hongos, peces y mamíferos, incluso en células humanas. Los científicos Roger Y. Tsien , Osamu Shimomura y Martin Chalfie fueron galardonados con el Premio Nobel de Química 2008 el 10 de octubre de 2008 por su descubrimiento y desarrollo de la proteína verde fluorescente.
La mayoría de los genes de GFP y proteínas fluorescentes similares disponibles comercialmente tienen alrededor de 730 pares de bases de longitud. La proteína natural tiene 238 aminoácidos. Su masa molecular es de 27 kD. [7] Por lo tanto, la fusión del gen de GFP con el gen de una proteína de interés puede aumentar significativamente el tamaño y la masa molecular de la proteína, y puede perjudicar la función natural de la proteína o cambiar su ubicación o trayectoria de transporte dentro de la célula. [8]


En los años 1960 y 1970, la GFP, junto con la proteína luminiscente separada aequorina (una enzima que cataliza la descomposición de la luciferina , liberando luz), se purificó por primera vez de la medusa Aequorea victoria y sus propiedades fueron estudiadas por Osamu Shimomura . [9] En A. victoria , la fluorescencia de GFP ocurre cuando la aequorina interactúa con iones Ca 2+ , induciendo un brillo azul. Parte de esta energía luminiscente se transfiere a la GFP, cambiando el color general hacia el verde. [10] Sin embargo, su utilidad como herramienta para biólogos moleculares no comenzó a comprenderse hasta 1992, cuando Douglas Prasher informó sobre la clonación y la secuencia de nucleótidos de wtGFP en Gene . [11] La financiación para este proyecto se había agotado, por lo que Prasher envió muestras de ADNc a varios laboratorios. El laboratorio de Martin Chalfie expresó la secuencia codificante de wtGFP, con los primeros aminoácidos eliminados, en células heterólogas de E. coli y C. elegans , publicando los resultados en Science en 1994. [12] El laboratorio de Frederick Tsuji informó de forma independiente la expresión de la proteína recombinante un mes después. [13] Sorprendentemente, la molécula de GFP se plegó y fue fluorescente a temperatura ambiente, sin necesidad de cofactores exógenos específicos de la medusa. Aunque esta GFP casi wt era fluorescente, tenía varios inconvenientes, incluidos espectros de excitación de doble pico, sensibilidad al pH, sensibilidad al cloruro, bajo rendimiento cuántico de fluorescencia, baja fotoestabilidad y bajo plegamiento a 37 °C (99 °F).
La primera estructura cristalina de una GFP de la que se informó fue la del mutante S65T por el grupo Remington en Science en 1996. [14] Un mes después, el grupo Phillips informó de forma independiente la estructura de la GFP de tipo salvaje en Nature Biotechnology . [15] Estas estructuras cristalinas proporcionaron información fundamental sobre la formación de cromóforos y las interacciones de residuos vecinos. Los investigadores han modificado estos residuos mediante mutagénesis dirigida y aleatoria para producir la amplia variedad de derivados de GFP que se utilizan en la actualidad. Investigaciones posteriores sobre la GFP han demostrado que es resistente a detergentes, proteasas, tratamientos con cloruro de guanidinio (GdmCl) y cambios drásticos de temperatura. [16]

Debido al potencial de uso generalizado y las necesidades cambiantes de los investigadores, se han diseñado muchos mutantes diferentes de GFP. [17] [18] La primera mejora importante fue una mutación puntual única (S65T) informada en 1995 en Nature por Roger Tsien . [19] Esta mutación mejoró drásticamente las características espectrales de GFP, lo que resultó en un aumento de la fluorescencia, la fotoestabilidad y un desplazamiento del pico de excitación principal a 488 nm, con la emisión máxima mantenida a 509 nm. Esto coincidió con las características espectrales de los conjuntos de filtros FITC comúnmente disponibles, lo que aumentó la practicidad de uso por parte del investigador general. En 1995, los laboratorios de Thastrup [20] y Falkow descubrieron un mutante puntual de eficiencia de plegamiento de 37 °C (F64L) para este andamio, que produce GFP mejorada (EGFP). [21] EGFP permitió el uso práctico de GFP en células de mamíferos. El coeficiente de extinción de EGFP (denominado ε) es de 55 000 M −1 cm −1 . [22] El rendimiento cuántico de fluorescencia (QY) de EGFP es 0,60. El brillo relativo, expresado como ε•QY, es 33 000 M −1 cm −1 .
En 2006 se informó sobre la supercarpeta GFP (sfGFP), una serie de mutaciones que permiten que la GFP se pliegue y madure rápidamente incluso cuando se fusiona con péptidos de plegado deficiente. [23]
Se han realizado muchas otras mutaciones, incluidos mutantes de color; en particular, la proteína fluorescente azul (EBFP, EBFP2, Azurite, mKalama1), la proteína fluorescente cian (ECFP, Cerulean, CyPet, mTurquoise2) y los derivados de la proteína fluorescente amarilla (YFP, Citrine, Venus, YPet). Los derivados de BFP (excepto mKalama1) contienen la sustitución Y66H. Presentan una amplia banda de absorción en el ultravioleta centrada cerca de 380 nanómetros y un máximo de emisión a 448 nanómetros. Se ha desarrollado un mutante de proteína fluorescente verde (BFPms1) que se une preferentemente a Zn(II) y Cu(II). BFPms1 tiene varias mutaciones importantes que incluyen el cromóforo BFP (Y66H), Y145F para un mayor rendimiento cuántico, H148G para crear un agujero en el barril beta y varias otras mutaciones que aumentan la solubilidad. La unión de Zn(II) aumenta la intensidad de la fluorescencia, mientras que la unión de Cu(II) extingue la fluorescencia y desplaza la máxima absorbancia de 379 a 444 nm. Por lo tanto, pueden utilizarse como biosensores de Zn. [24]

Unión del cromóforo. La mutación crítica en los derivados del cian es la sustitución Y66W, que hace que el cromóforo se forme con un componente indol en lugar de fenólico. Se requieren varias mutaciones compensatorias adicionales en el barril circundante para restaurar el brillo de este cromóforo modificado debido al aumento del volumen del grupo indol. En ECFP y Cerulean, la mitad N-terminal de la séptima hebra exhibe dos conformaciones. Ambas conformaciones tienen un conjunto complejo de interacciones de van der Waals con el cromóforo. Las mutaciones Y145A y H148D en Cerulean estabilizan estas interacciones y permiten que el cromóforo sea más plano, esté mejor empaquetado y sea menos propenso a la extinción por colisión. [25]
La mutagénesis aleatoria dirigida al sitio adicional en combinación con el cribado basado en el tiempo de vida de la fluorescencia ha estabilizado aún más la séptima cadena β, lo que resultó en una variante brillante, mTurquoise2, con un rendimiento cuántico (QY) de 0,93. [26] La longitud de onda desplazada al rojo de los derivados de YFP se logra mediante la mutación T203Y y se debe a interacciones de apilamiento de electrones π entre el residuo de tirosina sustituido y el cromóforo. [3] Estas dos clases de variantes espectrales se emplean a menudo para experimentos de transferencia de energía por resonancia de Förster (FRET). Los reporteros FRET codificados genéticamente sensibles a las moléculas de señalización celular, como el calcio o el glutamato, el estado de fosforilación de proteínas, la complementación de proteínas, la dimerización del receptor y otros procesos proporcionan lecturas ópticas altamente específicas de la actividad celular en tiempo real.
La mutagénesis semirracional de una serie de residuos dio lugar a mutantes sensibles al pH conocidos como pHluorinas y, posteriormente, a pHluorinas supereclípticas. Aprovechando el rápido cambio de pH tras la fusión de vesículas sinápticas, las pHluorinas marcadas con sinaptobrevina se han utilizado para visualizar la actividad sináptica en las neuronas. [27]
La GFP sensible a la oxidación-reducción ( roGFP ) se diseñó mediante la introducción de cisteínas en la estructura de barril beta. El estado redox de las cisteínas determina las propiedades fluorescentes de la roGFP . [28]
La nomenclatura de las GFP modificadas suele ser confusa debido a la superposición de varias versiones de GFP en un único nombre. Por ejemplo, mGFP suele referirse a una GFP con una palmitoilación N-terminal que hace que la GFP se una a las membranas celulares . Sin embargo, el mismo término también se utiliza para referirse a la GFP monomérica , que a menudo se consigue mediante la mutación A206K que rompe la interfaz del dímero. [29] La GFP de tipo salvaje tiene una tendencia débil a la dimerización en concentraciones superiores a 5 mg/ml. mGFP también significa "GFP modificada", que se ha optimizado mediante el intercambio de aminoácidos para una expresión estable en células vegetales.

Se desconoce el propósito de la bioluminiscencia (primaria) (de la acción de la aequorina sobre la luciferina) y de la fluorescencia (secundaria) de la GFP en las medusas. La GFP se coexpresa con la aequorina en pequeños gránulos alrededor del borde de la campana de la medusa. El pico de excitación secundario (480 nm) de la GFP absorbe parte de la emisión azul de la aequorina, lo que da a la bioluminiscencia un tono más verde. El residuo de serina 65 del cromóforo GFP es responsable de los espectros de excitación de doble pico de la GFP de tipo salvaje. Se conserva en las tres isoformas de GFP originalmente clonadas por Prasher. Casi todas las mutaciones de este residuo consolidan los espectros de excitación en un solo pico a 395 nm o 480 nm. El mecanismo preciso de esta sensibilidad es complejo, pero, al parecer, implica la donación de un hidrógeno de la serina 65 al glutamato 222, que influye en la ionización del cromóforo. [3] Dado que una única mutación puede mejorar drásticamente el pico de excitación de 480 nm, lo que convierte a la GFP en un socio mucho más eficiente de la aequorina, A. victoria parece preferir evolutivamente el espectro de excitación de doble pico, menos eficiente. Roger Tsien ha especulado que la variación de la presión hidrostática con la profundidad puede afectar la capacidad de la serina 65 de donar un hidrógeno al cromóforo y cambiar la relación de los dos picos de excitación. Por lo tanto, la medusa puede cambiar el color de su bioluminiscencia con la profundidad. Sin embargo, un colapso en la población de medusas en Friday Harbor , donde se descubrió originalmente la GFP, ha obstaculizado un estudio más profundo del papel de la GFP en el entorno natural de las medusas.
Se sabe que la mayoría de las especies de lancetas producen GFP en varias regiones de su cuerpo. [30] A diferencia de A. victoria , las lancetas no producen su propia luz azul, y el origen de su GFP endógena aún se desconoce. Algunos especulan que atrae al plancton hacia la boca de la lanceta, sirviendo como un mecanismo de caza pasivo. También puede servir como un agente fotoprotector en las larvas, previniendo el daño causado por la luz azul de alta intensidad al convertirla en luz verde de menor intensidad. Sin embargo, estas teorías no han sido probadas.
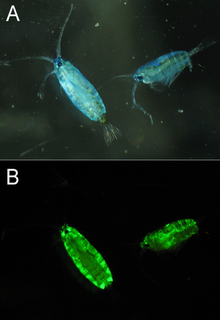
Se han encontrado proteínas similares a GFP en múltiples especies de copépodos marinos , particularmente de las familias Pontellidae y Aetideidae . [31] La GFP aislada de Pontella mimocerami ha mostrado altos niveles de brillo con un rendimiento cuántico de 0,92, lo que las hace casi dos veces más brillantes que la EGFP comúnmente utilizada aislada de A. victoria. [32]

Existen muchas proteínas similares a GFP que, a pesar de pertenecer a la misma familia de proteínas que GFP, no derivan directamente de Aequorea victoria . Entre ellas se incluyen dsRed , eqFP611, Dronpa, TagRFPs, KFP, EosFP/IrisFP, Dendra, etc. Al haberse desarrollado a partir de proteínas de diferentes organismos, estas proteínas a veces pueden mostrar enfoques imprevistos para la formación de cromóforos. Algunas de ellas, como KFP, se desarrollan a partir de proteínas naturalmente no fluorescentes o débilmente fluorescentes que se pueden mejorar en gran medida mediante mutagénesis. [33] Cuando se utilizan barriles similares a GFP de diferentes características espectrales, los espectros de excitación de un cromóforo se pueden utilizar para alimentar otro cromóforo (FRET), lo que permite la conversión entre longitudes de onda de luz. [34]
Las proteínas fluorescentes que se unen a FMN (FbFP) se desarrollaron en 2007 y son una clase de proteínas fluorescentes pequeñas (11–16 kDa) independientes del oxígeno que se derivan de los receptores de luz azul. Están destinadas especialmente para su uso en condiciones anaeróbicas o hipóxicas, ya que la formación y unión del cromóforo flavina no requiere oxígeno molecular, como es el caso de la síntesis del cromóforo GFP. [35]

Las proteínas fluorescentes con otros cromóforos, como UnaG con bilirrubina, pueden mostrar propiedades únicas, como emisión desplazada hacia el rojo por encima de los 600 nm o fotoconversión de un estado emisor de luz verde a un estado emisor de luz roja. Pueden tener longitudes de onda de excitación y emisión lo suficientemente separadas como para lograr la conversión entre luz roja y verde.
Una nueva clase de proteína fluorescente se desarrolló a partir de una ficobiliproteína cianobacteriana ( Trichodesmium erythraeum ) , la α- aloficocianina , y se denominó proteína fluorescente ultra roja pequeña ( smURFP ) en 2016. smURFP incorpora autocatalíticamente el cromóforo biliverdina sin la necesidad de una proteína externa , conocida como liasa . [36] [37] Las proteínas similares a GFP derivadas de medusas y corales requieren oxígeno y producen una cantidad estequiométrica de peróxido de hidrógeno tras la formación del cromóforo . [38] smURFP no requiere oxígeno ni produce peróxido de hidrógeno y utiliza el cromóforo , biliverdina . smURFP tiene un coeficiente de extinción grande (180.000 M −1 cm −1 ) y un rendimiento cuántico modesto (0,20), lo que lo hace comparable en brillo biofísico a eGFP y aproximadamente 2 veces más brillante que la mayoría de las proteínas fluorescentes rojas o rojas lejanas derivadas del coral . Las propiedades espectrales de smURFP son similares al colorante orgánico Cy5 . [36] [39]

Se pueden encontrar revisiones sobre nuevas clases de proteínas fluorescentes y aplicaciones en las revisiones citadas. [40] [41]
La GFP tiene una estructura de barril beta que consta de once cadenas β con una disposición de láminas plegadas, con una hélice alfa que contiene el cromóforo 4-( p -hidroxibencilideno)imidazolidin-5-ona (HBI) unido covalentemente y que atraviesa el centro. [3] [14] [15] Cinco hélices alfa más cortas forman tapas en los extremos de la estructura. La estructura de barril beta es un cilindro casi perfecto, de 42 Å de largo y 24 Å de diámetro (algunos estudios han informado de un diámetro de 30 Å [16] ), [14] creando lo que se conoce como una formación de "lata β", que es exclusiva de la familia similar a la GFP. [15] La HBI, la forma modificada espontáneamente del tripéptido Ser65–Tyr66–Gly67, no es fluorescente en ausencia del andamiaje de GFP correctamente plegado y existe principalmente en la forma de fenol no ionizado en wtGFP. [42] Las cadenas laterales orientadas hacia adentro del barril inducen reacciones de ciclización específicas en Ser65–Tyr66–Gly67 que inducen la ionización de HBI a la forma de fenolato y la formación de cromóforos . Este proceso de modificación postraduccional se conoce como maduración . [43] La red de enlaces de hidrógeno y las interacciones de apilamiento de electrones con estas cadenas laterales influyen en el color, la intensidad y la fotoestabilidad de GFP y sus numerosos derivados. [44] La naturaleza densamente empaquetada del barril excluye las moléculas de disolvente, lo que protege la fluorescencia del cromóforo de la extinción por el agua. Además de la autociclización de Ser65-Tyr66-Gly67, se produce una reacción de 1,2-deshidrogenación en el residuo Tyr66. [16] Además de los tres residuos que forman el cromóforo, residuos como Gln94, Arg96, His148, Thr203 y Glu222 actúan como estabilizadores. Los residuos de Gln94, Arg96 e His148 son capaces de estabilizarse deslocalizando la carga del cromóforo. Arg96 es el residuo estabilizador más importante debido a que provoca los reajustes estructurales necesarios para que se produzcan los anillos HBI. Cualquier mutación del residuo Arg96 daría lugar a una disminución de la velocidad de desarrollo del cromóforo porque se perderían las interacciones electrostáticas y estéricas adecuadas. Tyr66 es el receptor de enlaces de hidrógeno y no se ioniza para producir una electrostática favorable. [45]

Mecanísticamente, el proceso implica una ciclización mediada por bases seguida de deshidratación y oxidación. En la reacción de 7a a 8 se produce la formación de una enamina a partir de la imina, mientras que en la reacción de 7b a 9 se extrae un protón. [46] El fluoróforo HBI formado se resalta en verde.
Las reacciones son catalizadas por los residuos Glu222 y Arg96. [46] [47] Un mecanismo análogo también es posible con treonina en lugar de Ser65.
La proteína fluorescente verde puede utilizarse como gen reportero . [48] [49]
Por ejemplo, la GFP se puede utilizar como indicador de los niveles de toxicidad ambiental. Se ha demostrado que esta proteína es una forma eficaz de medir los niveles de toxicidad de diversas sustancias químicas, como el etanol, el p -formaldehído, el fenol, el triclosán y el parabeno. La GFP es una proteína indicadora excelente porque no tiene ningún efecto sobre el huésped cuando se introduce en su entorno celular. Debido a esta capacidad, no se necesitan tinciones de visualización externas, ATP ni cofactores. Con respecto a los niveles de contaminantes, se midió la fluorescencia para medir el efecto que tienen los contaminantes sobre la célula huésped. También se midió la densidad celular de la célula huésped. Los resultados del estudio realizado por Song, Kim y Seo (2016) mostraron que hubo una disminución tanto de la fluorescencia como de la densidad celular a medida que aumentaban los niveles de contaminantes. Esto fue indicativo del hecho de que la actividad celular había disminuido. Se necesita más investigación sobre esta aplicación específica para determinar el mecanismo por el cual la GFP actúa como marcador de contaminantes. [50] Se han observado resultados similares en peces cebra, ya que los peces cebra a los que se les inyectó GFP fueron aproximadamente veinte veces más susceptibles a reconocer el estrés celular que los peces cebra a los que no se les inyectó GFP. [51]
La mayor ventaja de la GFP es que puede ser hereditaria, dependiendo de cómo se haya introducido, lo que permite el estudio continuo de las células y los tejidos en los que se expresa. La visualización de la GFP no es invasiva y solo requiere iluminación con luz azul. La GFP por sí sola no interfiere con los procesos biológicos, pero cuando se fusiona con proteínas de interés, se requiere un diseño cuidadoso de los enlaces para mantener la función de la proteína de interés. Además, si se utiliza con un monómero, puede difundirse fácilmente por todas las células. [52]

La disponibilidad de GFP y sus derivados ha redefinido por completo la microscopía de fluorescencia y la forma en que se utiliza en biología celular y otras disciplinas biológicas. [53] Si bien la mayoría de las moléculas fluorescentes pequeñas, como el FITC (isotiocianato de fluoresceína), son fuertemente fototóxicas cuando se utilizan en células vivas, las proteínas fluorescentes como la GFP suelen ser mucho menos dañinas cuando se iluminan en células vivas. Esto ha desencadenado el desarrollo de sistemas de microscopía de fluorescencia de células vivas altamente automatizados, que se pueden utilizar para observar células a lo largo del tiempo que expresan una o más proteínas marcadas con proteínas fluorescentes.
Existen muchas técnicas para utilizar la GFP en un experimento de obtención de imágenes de células vivas. La forma más directa de utilizar la GFP es unirla directamente a una proteína de interés. Por ejemplo, la GFP se puede incluir en un plásmido que exprese otros genes para indicar una transfección exitosa de un gen de interés. Otro método es utilizar una GFP que contenga una mutación en la que la fluorescencia cambie de verde a amarilla con el tiempo, lo que se conoce como temporizador fluorescente. Con el temporizador fluorescente, los investigadores pueden estudiar el estado de la producción de proteínas, como activada recientemente, activada continuamente o desactivada recientemente, en función del color informado por la proteína fluorescente. [54] En otro ejemplo, los científicos han modificado la GFP para que se active solo después de la exposición a la irradiación, lo que les da a los investigadores una herramienta para activar selectivamente ciertas partes de una célula y observar dónde se mueven las proteínas marcadas con la GFP desde la ubicación inicial. [55] Estos son solo dos ejemplos en un campo floreciente de la microscopía fluorescente y una revisión más completa de los biosensores que utilizan GFP y otras proteínas fluorescentes se puede encontrar aquí [56].
Por ejemplo, la GFP se ha utilizado ampliamente para etiquetar los espermatozoides de varios organismos con fines de identificación, como en Drosophila melanogaster , donde la expresión de GFP puede utilizarse como marcador de una característica particular. La GFP también puede expresarse en diferentes estructuras, lo que permite una distinción morfológica. En tales casos, el gen para la producción de GFP se incorpora al genoma del organismo en la región del ADN que codifica las proteínas diana y que está controlada por la misma secuencia reguladora ; es decir, la secuencia reguladora del gen ahora controla la producción de GFP, además de la(s) proteína(s) marcada(s). En las células en las que se expresa el gen y se producen las proteínas marcadas, se produce GFP al mismo tiempo. Por lo tanto, solo aquellas células en las que se expresa el gen marcado o se producen las proteínas diana emitirán fluorescencia cuando se observen con microscopio de fluorescencia. El análisis de dichas películas de lapso de tiempo ha redefinido la comprensión de muchos procesos biológicos, incluidos el plegamiento de proteínas, el transporte de proteínas y la dinámica del ARN, que en el pasado se habían estudiado utilizando material fijo (es decir, muerto). Los datos obtenidos también se utilizan para calibrar modelos matemáticos de sistemas intracelulares y para estimar las tasas de expresión génica. [57] De manera similar, la GFP se puede utilizar como un indicador de la expresión de proteínas en sistemas heterólogos. En este escenario, las proteínas de fusión que contienen GFP se introducen indirectamente, utilizando ARN del constructo, o directamente, con la propia proteína marcada. Este método es útil para estudiar las características estructurales y funcionales de la proteína marcada a escala macromolecular o de molécula única con microscopía de fluorescencia.
El microscopio Vertico SMI que utiliza la tecnología SPDM Phymod utiliza el llamado efecto de "fotoblanqueo reversible" de los colorantes fluorescentes como GFP y sus derivados para localizarlos como moléculas individuales en una resolución óptica de 10 nm. Esto también se puede realizar como una co-localización de dos derivados de GFP (2CLM). [58]
Otro uso poderoso de GFP es expresar la proteína en pequeños conjuntos de células específicas. Esto permite a los investigadores detectar ópticamente tipos específicos de células in vitro (en un plato), o incluso in vivo (en el organismo vivo). [59] La combinación genética de varias variantes espectrales de GFP es un truco útil para el análisis de circuitos cerebrales ( Brainbow ). [60] Otros usos interesantes de proteínas fluorescentes en la literatura incluyen el uso de FP como sensores del potencial de membrana de las neuronas , [61] el seguimiento de los receptores AMPA en las membranas celulares, [62] la entrada viral y la infección de virus de influenza individuales y virus lentivirales, [63] [64] etc.
También se ha descubierto que nuevas líneas de ratas GFP transgénicas pueden ser relevantes para la terapia génica, así como para la medicina regenerativa. [65] Al utilizar GFP de "alta expresión", las ratas transgénicas muestran una alta expresión en la mayoría de los tejidos y en muchas células que no se han caracterizado o que se han caracterizado pobremente en ratas transgénicas GFP anteriores.
Se ha demostrado que la GFP es útil en criobiología como un ensayo de viabilidad . La correlación de la viabilidad medida mediante ensayos de azul tripán fue de 0,97. [66] Otra aplicación es el uso de la cotransfección con GFP como control interno para la eficiencia de la transfección en células de mamíferos. [67]
Un posible uso novedoso de la GFP incluye su uso como monitor sensible de los procesos intracelulares a través de un sistema láser eGFP fabricado a partir de una línea celular de riñón embrionario humano. El primer láser vivo diseñado se fabrica mediante una célula que expresa eGFP dentro de una cavidad óptica reflectante y la golpea con pulsos de luz azul. En un umbral de pulso determinado, la salida óptica de la eGFP se vuelve más brillante y completamente uniforme en color verde puro con una longitud de onda de 516 nm. Antes de emitirse como luz láser, la luz rebota de un lado a otro dentro de la cavidad del resonador y pasa por la célula numerosas veces. Al estudiar los cambios en la actividad óptica, los investigadores pueden comprender mejor los procesos celulares. [68] [69]
La GFP se utiliza ampliamente en la investigación del cáncer para etiquetar y rastrear células cancerosas. Las células cancerosas marcadas con GFP se han utilizado para modelar la metástasis, el proceso por el cual las células cancerosas se propagan a órganos distantes. [70]
La GFP se puede utilizar para analizar la colocalización de proteínas. Esto se logra "dividiendo" la proteína en dos fragmentos que pueden autoensamblarse y luego fusionando cada uno de ellos con las dos proteínas de interés. Por sí solos, estos fragmentos incompletos de GFP no pueden emitir fluorescencia. Sin embargo, si las dos proteínas de interés se colocalizan, entonces los dos fragmentos de GFP se ensamblan para formar una estructura similar a la GFP que puede emitir fluorescencia. Por lo tanto, midiendo el nivel de fluorescencia es posible determinar si las dos proteínas de interés se colocalizan. [71]
Los procesos biológicos a macroescala, como la propagación de infecciones virales, se pueden seguir utilizando el etiquetado de GFP. [72] En el pasado, se ha utilizado luz ultravioleta (UV) mutagénica para iluminar organismos vivos (p. ej., ver [73] ) para detectar y fotografiar la expresión de GFP. Recientemente, se ha desarrollado una técnica que utiliza luces LED no mutagénicas [74] para la macrofotografía. [75] La técnica utiliza un accesorio de cámara de epifluorescencia [76] basado en el mismo principio utilizado en la construcción de microscopios de epifluorescencia .

Alba , un conejo verde fluorescente, fue creado por un laboratorio francés encargado por Eduardo Kac utilizando GFP con fines artísticos y de comentario social. [77] La empresa estadounidense Yorktown Technologies comercializa en tiendas de acuarios peces cebra verdes fluorescentes ( GloFish ) que inicialmente se desarrollaron para detectar la contaminación en las vías fluviales. NeonPets, una empresa con sede en EE. UU., ha comercializado ratones verdes fluorescentes para la industria de las mascotas como NeonMice. [78] Los cerdos verdes fluorescentes, conocidos como Noels, fueron criados por un grupo de investigadores dirigido por Wu Shinn-Chih en el Departamento de Ciencia y Tecnología Animal de la Universidad Nacional de Taiwán . [79] Un equipo japonés-estadounidense creó gatos verdes fluorescentes como prueba de concepto para usarlos potencialmente como organismos modelo para enfermedades, particularmente el VIH . [80] En 2009, un equipo surcoreano de la Universidad Nacional de Seúl crió los primeros beagles transgénicos con células de fibroblastos de anémonas de mar. Los perros emiten una luz fluorescente roja y su objetivo es permitir a los científicos estudiar los genes que causan enfermedades humanas como la narcolepsia y la ceguera. [81]
Julian Voss-Andreae , un artista nacido en Alemania especializado en "esculturas de proteínas", [82] creó esculturas basadas en la estructura de la GFP, incluyendo la "Proteína fluorescente verde" (2004) de 1,70 metros de altura [83] y la "Medusa de acero" (2006) de 1,40 metros de altura. La última escultura está ubicada en el lugar del descubrimiento de la GFP por Shimomura en 1962, los Laboratorios Friday Harbor de la Universidad de Washington . [84]
.jpg/440px-Steel_Jellyfish_(GFP).jpg)