

Los carbonilos metálicos son complejos de coordinación de metales de transición con ligandos de monóxido de carbono . Los carbonilos metálicos son útiles en síntesis orgánica y como catalizadores o precursores de catalizadores en catálisis homogénea , como la hidroformilación y la química de Reppe . En el proceso Mond , el tetracarbonilo de níquel se utiliza para producir níquel puro . En la química organometálica , los carbonilos metálicos sirven como precursores para la preparación de otros complejos organometálicos.
Los carbonilos metálicos son tóxicos por contacto con la piel, inhalación o ingestión, en parte debido a su capacidad de carbonilar la hemoglobina para dar carboxihemoglobina , que impide la unión del oxígeno . [1]
La nomenclatura de los carbonilos metálicos depende de la carga del complejo, del número y tipo de átomos centrales y del número y tipo de ligandos y sus modos de unión. Se presentan como complejos neutros, como cationes carbonilos metálicos cargados positivamente o como carbonilatos metálicos cargados negativamente . El ligando de monóxido de carbono puede estar unido terminalmente a un solo átomo de metal o haciendo puente con dos o más átomos de metal. Estos complejos pueden ser homolépticos , conteniendo solo ligandos de CO, como el tetracarbonilo de níquel (Ni(CO) 4 ), pero más comúnmente los carbonilos metálicos son heterolépticos y contienen una mezcla de ligandos. [ cita requerida ]
Los carbonilos metálicos mononucleares contienen solo un átomo de metal como átomo central. Excepto el hexacarbonilo de vanadio , solo los metales con número atómico par, como el cromo , el hierro , el níquel y sus homólogos, forman complejos mononucleares neutros. Los carbonilos metálicos polinucleares se forman a partir de metales con números atómicos impares y contienen un enlace metal-metal . [2] Los complejos con diferentes metales pero solo un tipo de ligando se denominan isolépticos. [2]
El monóxido de carbono tiene distintos modos de unión en los carbonilos metálicos. Se diferencian en términos de su hapticidad , denotada η , y su modo de unión. En los complejos η 2 -CO, tanto el carbono como el oxígeno están unidos al metal. Lo más común es que solo el carbono esté unido, en cuyo caso no se menciona la hapticidad. [3]
El ligando carbonilo participa en una amplia gama de modos de enlace en dímeros y grupos de carbonilos metálicos. En el modo de enlace más común, denominado μ 2 o simplemente μ , el ligando CO forma un puente entre un par de metales. Este modo de enlace se observa en los carbonilos metálicos comúnmente disponibles: Co 2 (CO) 8 , Fe 2 (CO) 9 , Fe 3 (CO) 12 y Co 4 (CO) 12 . [1] [4] En ciertos grupos de mayor nuclearidad, el CO forma un puente entre tres o incluso cuatro metales. Estos ligandos se denominan μ 3 -CO y μ 4 -CO. Menos comunes son los modos de enlace en los que tanto C como O se unen al metal, como μ 3 η 2 . [ cita requerida ]

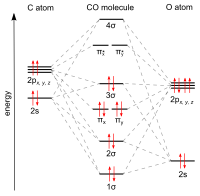
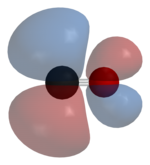
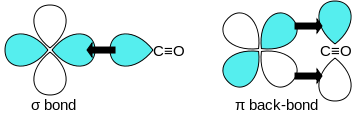
El monóxido de carbono se une a los metales de transición mediante un " enlace retroenlace pi* sinérgico ". El enlace M–C tiene tres componentes, lo que da lugar a un triple enlace parcial. Un enlace sigma (σ) surge de la superposición del par de electrones sp-hibridados no enlazantes (o débilmente antienlazantes) en el carbono con una mezcla de orbitales d , s y p en el metal. Un par de enlaces pi (π) surge de la superposición de orbitales d llenos en el metal con un par de orbitales antienlazantes π* que se proyectan desde el átomo de carbono del CO. El último tipo de enlace requiere que el metal tenga electrones d y que el metal esté en un estado de oxidación relativamente bajo (0 o +1) que hace que la donación retroactiva de densidad electrónica sea favorable. A medida que los electrones del metal llenan el orbital antienlazante π del CO, debilitan el enlace carbono-oxígeno en comparación con el monóxido de carbono libre, mientras que el enlace metal-carbono se fortalece. Debido al carácter de enlace múltiple del enlace M–CO, la distancia entre el metal y el átomo de carbono es relativamente corta, a menudo menor a 1,8 Å, aproximadamente 0,2 Å más corta que un enlace metal- alquilo . La distancia M-CO y MC-O son sensibles a otros ligandos en el metal. Los siguientes datos para las distancias Mo-C y CO en Mo(CO) 6 y Mo(CO) 3 (4-metilpiridina) 3 son ilustrativos de estos efectos : 2,06 frente a 1,90 y 1,11 frente a 1,18 Å. [5]
La espectroscopia infrarroja es una sonda sensible para la presencia de ligandos de carbonilo puente. Para compuestos con ligandos de CO doblemente puente, denotados μ 2 -CO o a menudo solo μ -CO, la frecuencia de estiramiento de enlace ν CO generalmente se desplaza entre 100 y 200 cm −1 a una energía más baja en comparación con las firmas del CO terminal, que están en la región de 1800 cm −1 . Las bandas para ligandos de CO con recubrimiento de caras ( μ 3 ) aparecen a energías incluso más bajas. Además de los modos de puente simétricos, se puede encontrar que el CO se une asimétricamente o mediante donación desde un orbital d de metal al orbital π* del CO. [6] [7] [8] El aumento de la unión π debido a la donación posterior desde múltiples centros metálicos da como resultado un mayor debilitamiento del enlace C–O. [ cita requerida ]
La mayoría de los complejos carbonílicos mononucleares son líquidos o sólidos volátiles incoloros o de color amarillo pálido que son inflamables y tóxicos. [9] El hexacarbonilo de vanadio , un carbonilo metálico de 17 electrones excepcionalmente estable, es un sólido azul-negro. [1] Los carbonilos dimetálicos y polimetálicos tienden a tener colores más profundos. El dodecacarbonilo trihierro (Fe 3 (CO) 12 ) forma cristales de color verde oscuro. Los carbonilos metálicos cristalinos a menudo son sublimables al vacío, aunque este proceso suele ir acompañado de degradación. Los carbonilos metálicos son solubles en disolventes orgánicos no polares y polares como el benceno , el éter dietílico , la acetona , el ácido acético glacial y el tetracloruro de carbono . Algunas sales de carbonilos metálicos catiónicos y aniónicos son solubles en agua o alcoholes inferiores. [10]

Aparte de la cristalografía de rayos X , las técnicas analíticas importantes para la caracterización de carbonilos metálicos son la espectroscopia infrarroja y la espectroscopia de RMN de 13 C. Estas dos técnicas proporcionan información estructural en dos escalas de tiempo muy diferentes. Los modos vibracionales activos en el infrarrojo , como las vibraciones de estiramiento de CO, suelen ser rápidos en comparación con los procesos intramoleculares, mientras que las transiciones de RMN ocurren a frecuencias más bajas y, por lo tanto, muestrean estructuras en una escala de tiempo que, resulta, es comparable a la velocidad de los procesos de intercambio de ligandos intramoleculares. Los datos de RMN proporcionan información sobre "estructuras promediadas en el tiempo", mientras que el IR es una "instantánea" instantánea. [11] Ilustrativa de las diferentes escalas de tiempo, la investigación del octacarbonilo de dicobalto (Co 2 (CO) 8 ) por medio de espectroscopia infrarroja proporciona bandas de CO de 13 ν , mucho más de lo esperado para un solo compuesto. Esta complejidad refleja la presencia de isómeros con y sin ligandos de CO puente. El espectro de RMN de 13 C de la misma sustancia muestra una única señal con un desplazamiento químico de 204 ppm. Esta simplicidad indica que los isómeros se interconvierten rápidamente (en la escala de tiempo de RMN). [ cita requerida ]
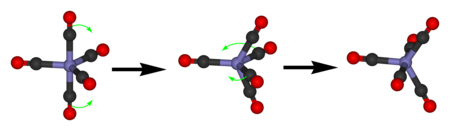
El pentacarbonilo de hierro exhibe solo una única señal de RMN de 13 C debido al rápido intercambio de los ligandos axiales y ecuatoriales de CO por pseudorotación de Berry . [ cita requerida ]

Una técnica importante para caracterizar los carbonilos metálicos es la espectroscopia infrarroja . [13] La vibración C–O, típicamente denotada ν CO , ocurre a 2143 cm −1 para el gas de monóxido de carbono. Las energías de la banda ν CO para los carbonilos metálicos se correlacionan con la fuerza del enlace carbono-oxígeno, e inversamente correlacionadas con la fuerza del enlace π-backlinking entre el metal y el carbono. La π-basicidad del centro metálico depende de muchos factores; en la serie isoelectrónica ( titanio a hierro ) en la parte inferior de esta sección, los hexacarbonilos muestran un enlace π-backlinking decreciente a medida que uno aumenta (hace más positiva) la carga en el metal. Los ligandos π-básicos aumentan la densidad de electrones π en el metal, y el enlace retroactivo mejorado reduce ν CO . El parámetro electrónico de Tolman utiliza el fragmento Ni(CO) 3 para ordenar los ligandos según sus capacidades de donación de π. [14] [15]
El número de modos vibracionales de un complejo de carbonilo metálico se puede determinar mediante la teoría de grupos . Solo los modos vibracionales que se transforman como el operador dipolar eléctrico tendrán productos directos distintos de cero y se observan. Por lo tanto, se puede predecir el número de transiciones IR observables (pero no sus energías). [16] [17] [ 18] Por ejemplo, los ligandos CO de complejos octaédricos, como Cr(CO) 6 , se transforman como 1g , e g , y t 1u , pero solo el modo t 1u (estiramiento antisimétrico de los ligandos carbonílicos apicales) está permitido por IR. Por lo tanto, solo se observa una única banda ν CO en los espectros IR de los hexacarbonilos metálicos octaédricos. Los espectros para complejos de menor simetría son más complejos. Por ejemplo, el espectro IR de Fe 2 (CO) 9 muestra bandas de CO a 2082, 2019 y 1829 cm −1 . En la tabla se muestra el número de modos vibracionales observables en el infrarrojo para algunos carbonilos metálicos. Hay disponibles tabulaciones exhaustivas. [13] Estas reglas se aplican a los carbonilos metálicos en solución o en fase gaseosa. Los disolventes de baja polaridad son ideales para una alta resolución. Para las mediciones en muestras sólidas de carbonilos metálicos, el número de bandas puede aumentar debido en parte a la simetría del sitio. [19]
Los carbonilos metálicos suelen caracterizarse mediante espectroscopia de RMN de 13 C. Para mejorar la sensibilidad de esta técnica, los complejos suelen enriquecerse con 13 CO. El rango típico de desplazamiento químico para ligandos unidos terminalmente es de 150 a 220 ppm. Los ligandos puente resuenan entre 230 y 280 ppm. [1] Las señales de 13 C se desplazan hacia campos más altos con un número atómico creciente del metal central.
La espectroscopia de RMN se puede utilizar para la determinación experimental de la fluxionalidad . [26]
La energía de activación de los procesos de intercambio de ligando se puede determinar mediante la dependencia de la temperatura del ensanchamiento de la línea. [27]
La espectrometría de masas proporciona información sobre la estructura y la composición de los complejos. Los espectros de policarbonilos metálicos suelen ser fácilmente interpretables, ya que el proceso de fragmentación dominante es la pérdida de ligandos carbonílicos ( m / z = 28).
La ionización electrónica es la técnica más común para caracterizar los carbonilos metálicos neutros. Los carbonilos metálicos neutros se pueden convertir en especies cargadas mediante derivatización , lo que permite el uso de la ionización por electrospray (ESI), instrumentación para la cual suele estar ampliamente disponible. Por ejemplo, el tratamiento de un carbonilo metálico con alcóxido genera un metalaformiato aniónico que se puede analizar mediante ESI-MS:
Algunos carbonilos metálicos reaccionan con azida para formar complejos de isocianato con liberación de nitrógeno . [28] Ajustando el voltaje del cono o la temperatura, se puede controlar el grado de fragmentación. Se puede determinar la masa molar del complejo original, así como información sobre reordenamientos estructurales que involucran pérdida de ligandos carbonílicos bajo condiciones de ESI-MS. [29]
La espectrometría de masas combinada con espectroscopia de fotodisociación infrarroja puede proporcionar información vibracional para complejos carbonílicos iónicos en fase gaseosa. [30]

En la investigación del espectro infrarrojo del Centro Galáctico de la Vía Láctea , se detectaron vibraciones de monóxido de carbono de carbonilos de hierro en nubes de polvo interestelar . [32] También se observaron cúmulos de carbonilo de hierro en condritas Jiange H5 identificadas por espectroscopia infrarroja. Se encontraron cuatro frecuencias de estiramiento infrarrojas para los ligandos de monóxido de carbono terminales y de puente. [33]
En la atmósfera rica en oxígeno de la Tierra, los carbonilos metálicos están sujetos a oxidación para convertirse en óxidos metálicos. Se discute si en los ambientes hidrotermales reductores de la prehistoria prebiótica se formaron tales complejos y si podrían haber estado disponibles como catalizadores para la síntesis de compuestos bioquímicos críticos como el ácido pirúvico . [34] Se encontraron trazas de carbonilos de hierro, níquel y tungsteno en las emanaciones gaseosas de los lodos de depuradora de las plantas de tratamiento municipales . [35]
Las enzimas hidrogenasas contienen CO unido al hierro. Se cree que el CO estabiliza los estados de oxidación bajos, lo que facilita la unión del hidrógeno . Las enzimas deshidrogenasa de monóxido de carbono y acetil-CoA sintasa también están involucradas en el bioprocesamiento del CO. [36] Los complejos que contienen monóxido de carbono se invocan para la toxicidad del CO y la señalización. [37]
La síntesis de carbonilos metálicos es un tema de investigación ampliamente estudiado en el campo de los organometálicos. Desde el trabajo de Mond y luego de Hieber, se han desarrollado muchos procedimientos para la preparación de carbonilos metálicos mononucleares, así como de grupos carbonílicos homometálicos y heterometálicos. [38]
El tetracarbonilo de níquel y el pentacarbonilo de hierro se pueden preparar de acuerdo con las siguientes ecuaciones mediante la reacción del metal finamente dividido con monóxido de carbono : [39]
El tetracarbonilo de níquel se forma con monóxido de carbono ya a 80 °C y presión atmosférica, el hierro finamente dividido reacciona a temperaturas entre 150 y 200 °C y una presión de monóxido de carbono de 50-200 bar. [40] Otros carbonilos metálicos se preparan por métodos menos directos. [41]
Algunos carbonilos metálicos se preparan mediante la reducción de haluros metálicos en presencia de monóxido de carbono a alta presión. Se emplean diversos agentes reductores, entre ellos cobre , aluminio , hidrógeno y alquilos metálicos como el trietilaluminio . Un ejemplo ilustrativo es la formación de hexacarbonilo de cromo a partir de cloruro de cromo(III) anhidro en benceno con aluminio como agente reductor y cloruro de aluminio como catalizador: [39]
El uso de alquilos metálicos, como trietilaluminio y dietilzinc , como agente reductor conduce al acoplamiento oxidativo del radical alquilo para formar el alcano dímero :
Las sales de tungsteno , molibdeno , manganeso y rodio se pueden reducir con hidruro de litio y aluminio . El hexacarbonilo de vanadio se prepara con sodio como agente reductor en disolventes quelantes como la diglima . [9]
En la fase acuosa, las sales de níquel o cobalto pueden reducirse, por ejemplo, mediante ditionito de sodio . En presencia de monóxido de carbono, las sales de cobalto se convierten cuantitativamente en el anión tetracarbonilcobalto(−1): [9]
Algunos carbonilos metálicos se preparan utilizando CO directamente como agente reductor . De esta manera, Hieber y Fuchs prepararon por primera vez decacarbonilo de dirhenio a partir del óxido: [42]
Si se utilizan óxidos metálicos, se forma dióxido de carbono como producto de reacción. En la reducción de cloruros metálicos con monóxido de carbono se forma fosgeno , como en la preparación de cloruro de osmiocarbonilo a partir de las sales de cloruro. [38] El monóxido de carbono también es adecuado para la reducción de sulfuros , donde el sulfuro de carbonilo es el subproducto.
La fotólisis o termólisis de carbonilos mononucleares genera carbonilos dimetálicos y polimetálicos como el nonacarbonilo de dihierro (Fe 2 (CO) 9 ). [43] [44] Al calentarlos más, los productos se descomponen finalmente en el metal y el monóxido de carbono. [ cita requerida ]
La descomposición térmica del dodecacarbonilo de triosmio (Os 3 (CO) 12 ) proporciona grupos de carbonilo de osmio de núcleo superior, como Os 4 (CO) 13 , Os 6 (CO) 18 hasta Os 8 (CO) 23 . [9]
Los carbonilos de ligando mixto de rutenio , osmio , rodio e iridio se generan a menudo mediante la abstracción de CO de disolventes como dimetilformamida (DMF) y 2-metoxietanol . Un ejemplo típico es la síntesis de IrCl(CO)(PPh 3 ) 2 a partir de la reacción de cloruro de iridio (III) y trifenilfosfina en solución de DMF hirviendo. [45]
La reacción de metátesis de sales como KCo(CO) 4 con [Ru(CO) 3 Cl 2 ] 2 conduce selectivamente a carbonilos de metales mixtos como RuCo 2 (CO) 11 . [46]
La síntesis de complejos carbonílicos iónicos es posible por oxidación o reducción de los complejos neutros. Los carbonilatos metálicos aniónicos pueden obtenerse, por ejemplo, por reducción de complejos dinucleares con sodio. Un ejemplo conocido es la sal sódica del tetracarbonilato de hierro (Na 2 Fe(CO) 4 , reactivo de Collman ), que se utiliza en síntesis orgánica. [47]
Las sales hexacarbonílicas catiónicas de manganeso , tecnecio y renio se pueden preparar a partir de haluros de carbonilo bajo presión de monóxido de carbono mediante reacción con un ácido de Lewis .
El uso de ácidos fuertes logró preparar cationes carbonílicos de oro como [Au(CO) 2 ] + , que se utiliza como catalizador para la carbonilación de alquenos . [48] El complejo catiónico de platino-carbonilo [Pt(CO) 4 ] 2+ se puede preparar trabajando en los llamados superácidos como el pentafluoruro de antimonio . [49] Aunque el CO se considera generalmente como un ligando para iones metálicos de baja valencia, el complejo de hierro tetravalente [Cp* 2 Fe] 2+ (complejo de 16 electrones de valencia) se une cuantitativamente al CO para dar el Fe(IV)-carbonilo diamagnético [Cp* 2 FeCO] 2+ (complejo de 18 electrones de valencia). [50]
Los carbonilos metálicos son precursores importantes para la síntesis de otros complejos organometálicos. Las reacciones más comunes son la sustitución del monóxido de carbono por otros ligandos, las reacciones de oxidación o reducción del centro metálico y las reacciones en el ligando de monóxido de carbono. [1]
La sustitución de ligandos de CO puede ser inducida térmicamente o fotoquímicamente por ligandos donantes. La gama de ligandos es amplia e incluye fosfinas , cianuro (CN − ), donantes de nitrógeno e incluso éteres, especialmente los quelantes. Los alquenos , especialmente los dienos , son ligandos eficaces que proporcionan derivados sintéticamente útiles. La sustitución de complejos de 18 electrones generalmente sigue un mecanismo disociativo , que involucra intermediarios de 16 electrones. [51]
La sustitución se produce mediante un mecanismo disociativo :
La energía de disociación es 105 kJ/mol (25 kcal/mol) para el tetracarbonilo de níquel y 155 kJ/mol (37 kcal/mol) para el hexacarbonilo de cromo . [1]
La sustitución en complejos de 17 electrones, que son raros, se realiza a través de mecanismos asociativos con intermediarios de 19 electrones.
La tasa de sustitución en complejos de 18 electrones a veces es catalizada por cantidades catalíticas de oxidantes, a través de la transferencia de electrones . [52]
Los carbonilos metálicos reaccionan con agentes reductores como el sodio metálico o la amalgama de sodio para dar aniones carbonilmetalato (o carbonilato):
Para el pentacarbonilo de hierro se obtiene el tetracarbonilferrato con pérdida de CO:
El mercurio puede insertarse en los enlaces metal-metal de algunos carbonilos metálicos polinucleares:
El ligando CO es a menudo susceptible al ataque de los nucleófilos . Por ejemplo, el óxido de trimetilamina y la bis(trimetilsilil)amida de potasio convierten los ligandos CO en CO2 y CN− , respectivamente. En la " reacción de la base de Hieber ", el ion hidróxido ataca al ligando CO para dar un ácido metalacarboxílico , seguido de la liberación de dióxido de carbono y la formación de hidruros metálicos o carbonilmetalatos. Un ejemplo bien estudiado de esta adición nucleofílica es la conversión de pentacarbonilo de hierro en anión tetracarbonilo de hidruro de hierro :
Los reactivos hidruro también atacan a los ligandos CO, especialmente en complejos metálicos catiónicos, para dar el derivado formilo :
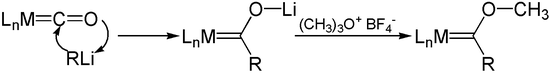
Los reactivos de organolitio se suman a los aniones de carbonilo de acilmetal con los de metal. La O - alquilación de estos aniones, como con sales de Meerwein , produce carbenos de Fischer .
A pesar de estar en estados de oxidación formal bajos , los carbonilos metálicos son relativamente poco reactivos frente a muchos electrófilos . Por ejemplo, resisten el ataque de agentes alquilantes, ácidos suaves y agentes oxidantes suaves . La mayoría de los carbonilos metálicos sufren halogenación . El pentacarbonilo de hierro , por ejemplo, forma haluros de carbonilo ferroso:
Los enlaces metal-metal se rompen por acción de los halógenos. Según el esquema de conteo electrónico utilizado, esto puede considerarse como una oxidación de los átomos de metal:
La mayoría de los complejos de carbonilo metálico contienen una mezcla de ligandos. Algunos ejemplos son el históricamente importante IrCl(CO)(P(C 6 H 5 ) 3 ) 2 y el agente antidetonante (CH 3 C 5 H 4 )Mn(CO) 3 . Los compuestos originales de muchos de estos complejos de ligando mixto son los carbonilos binarios, aquellas especies de la fórmula [M x (CO) n ] z , muchas de las cuales están disponibles comercialmente. Las fórmulas de muchos carbonilos metálicos se pueden inferir a partir de la regla de los 18 electrones .
También son bien conocidos los grandes grupos aniónicos de níquel , paladio y platino . Muchos aniones carbonílicos metálicos pueden protonarse para dar hidruros carbonílicos metálicos .
El término no clásico describe aquellos complejos carbonílicos en los que la ν CO es mayor que la del monóxido de carbono libre. En los complejos de CO no clásicos, la distancia del CO es menor que la del CO libre (113,7 pm). La estructura de [Fe(CO) 6 ] 2+ , con d C-O = 112,9 pm, ilustra este efecto. Estos complejos suelen ser catiónicos, a veces dicatiónicos. [58]

Los carbonilos metálicos se utilizan en varios procesos industriales. Quizás la primera aplicación fue la extracción y purificación de níquel a través del tetracarbonilo de níquel mediante el proceso Mond (véase también metalurgia de carbonilos ). [ cita requerida ]
Mediante un proceso similar, se prepara el hierro carbonílico , un polvo metálico de alta pureza, mediante la descomposición térmica del pentacarbonilo de hierro. El hierro carbonílico se utiliza, entre otras cosas, para la preparación de inductores , pigmentos , como complementos dietéticos [59] , en la producción de materiales absorbentes de radar en la tecnología furtiva [ 60] y en la pulverización térmica . [ cita requerida ]
Los carbonilos metálicos se utilizan en varias reacciones de carbonilación de importancia industrial . En el proceso oxo , un alqueno , gas hidrógeno y monóxido de carbono reaccionan junto con un catalizador (como el octacarbonilo de dicobalto ) para dar aldehídos . Un ejemplo ilustrativo es la producción de butiraldehído a partir de propileno :
El butiraldehído se convierte a escala industrial en 2-etilhexanol , un precursor de los plastificantes de PVC , mediante condensación aldólica , seguida de la hidrogenación del hidroxialdehído resultante. Los "oxoaldehídos" resultantes de la hidroformilación se utilizan para la síntesis a gran escala de alcoholes grasos, que son precursores de los detergentes . La hidroformilación es una reacción con una gran economía de átomos , especialmente si la reacción se produce con alta regioselectividad . [ cita requerida ]
Otra reacción importante catalizada por carbonilos metálicos es la hidrocarboxilación . El ejemplo siguiente corresponde a la síntesis de ácido acrílico y ésteres de ácido acrílico:
También la ciclización del acetileno a ciclooctatetraeno utiliza catalizadores de carbonilo metálico: [61]
En los procesos Monsanto y Cativa , el ácido acético se produce a partir de metanol, monóxido de carbono y agua utilizando yoduro de hidrógeno , así como catalizadores de carbonilo de rodio e iridio, respectivamente. Las reacciones de carbonilación relacionadas producen anhídrido acético . [62]
Las moléculas liberadoras de monóxido de carbono son complejos de carbonilo metálico que se están desarrollando como posibles fármacos para liberar CO. En bajas concentraciones, el CO funciona como un agente vasodilatador y antiinflamatorio. Los CO-RM se han concebido como un enfoque farmacológico estratégico para transportar y administrar cantidades controladas de CO a los tejidos y órganos. [63]
Se sabe que muchos ligandos forman complejos de ligandos homolépticos y mixtos que son análogos a los carbonilos metálicos. [ cita requerida ]
Los nitrosilos metálicos, compuestos que presentan ligandos NO , son numerosos. Sin embargo, a diferencia de los carbonilos metálicos, los nitrosilos metálicos homolépticos son raros. El NO es un aceptor π más fuerte que el CO. Los carbonilos nitrosílicos bien conocidos incluyen CoNO(CO) 3 y Fe(NO) 2 (CO) 2 , que son análogos de Ni(CO) 4 . [64]
Se conocen complejos que contienen CS pero son poco comunes. [65] [66] La rareza de tales complejos se debe en parte al hecho de que el material de origen obvio, el monosulfuro de carbono , es inestable. Por lo tanto, la síntesis de complejos de tiocarbonilo requiere rutas indirectas, como la reacción del tetracarbonilferrato de disodio con tiofosgeno :
Se han caracterizado complejos de CSe y CTe. [67]
Los isocianuros también forman extensas familias de complejos relacionados con los carbonilos metálicos. Los ligandos típicos de isocianuro son el isocianuro de metilo y el isocianuro de t -butilo (Me 3 CNC). Un caso especial es el CF 3 NC , una molécula inestable que forma complejos estables cuyo comportamiento es muy similar al de los carbonilos metálicos. [68]
La toxicidad de los carbonilos metálicos se debe a la toxicidad del monóxido de carbono , el metal, y debido a la volatilidad e inestabilidad de los complejos, cualquier toxicidad inherente del metal generalmente se vuelve mucho más severa debido a la facilidad de exposición. La exposición ocurre por inhalación, o para carbonilos metálicos líquidos por ingestión o debido a la buena solubilidad en grasas por reabsorción cutánea. La mayor parte de la experiencia clínica se obtuvo a partir de envenenamiento toxicológico con tetracarbonilo de níquel y pentacarbonilo de hierro debido a su uso en la industria. El tetracarbonilo de níquel se considera uno de los venenos por inhalación más fuertes. [69]
La inhalación de tetracarbonilo de níquel provoca síntomas agudos no específicos similares a una intoxicación por monóxido de carbono , como náuseas , tos , dolor de cabeza , fiebre y mareos . Después de algún tiempo, aparecen síntomas pulmonares graves como tos, taquicardia y cianosis , o problemas en el tracto gastrointestinal . Además de alteraciones patológicas del pulmón, como por metalación de los alvéolos, se observan daños en el cerebro, el hígado, los riñones, las glándulas suprarrenales y el bazo. Una intoxicación por carbonilo metálico a menudo requiere una recuperación prolongada. [70]
La exposición crónica por inhalación de bajas concentraciones de tetracarbonilo de níquel puede causar síntomas neurológicos como insomnio, dolores de cabeza, mareos y pérdida de memoria. [70] El tetracarbonilo de níquel se considera cancerígeno, pero pueden pasar de 20 a 30 años desde el inicio de la exposición hasta la manifestación clínica del cáncer. [71]

Los primeros experimentos sobre la reacción del monóxido de carbono con metales fueron realizados por Justus von Liebig en 1834. Al pasar monóxido de carbono sobre potasio fundido , preparó una sustancia que tenía la fórmula empírica KCO, a la que llamó Kohlenoxidkalium . [72] Como se demostró más tarde, el compuesto no era un carbonilo, sino la sal de potasio del bencenohexol (K 6 C 6 O 6 ) y la sal de potasio del acetilenodiol (K 2 C 2 O 2 ). [38]

La síntesis del primer complejo de carbonilo metálico heteroléptico verdadero fue realizada por Paul Schützenberger en 1868 al pasar cloro y monóxido de carbono sobre negro de platino , donde se formó dicarbonildicloroplatino (Pt(CO) 2 Cl 2 ). [73]
Ludwig Mond , uno de los fundadores de Imperial Chemical Industries , investigó en la década de 1890 con Carl Langer y Friedrich Quincke varios procesos para la recuperación del cloro que se perdía en el proceso Solvay por los metales, óxidos y sales de níquel . [38] Como parte de sus experimentos, el grupo trató el níquel con monóxido de carbono. Descubrieron que el gas resultante coloreaba la llama de gas de un quemador de un color verdoso-amarillento; cuando se calentaba en un tubo de vidrio formaba un espejo de níquel. El gas podía condensarse hasta convertirse en un líquido incoloro y transparente con un punto de ebullición de 43 °C. De este modo, Mond y su compañero de trabajo habían descubierto el primer carbonilo metálico homoléptico puro, el tetracarbonilo de níquel (Ni(CO) 4 ). [74] La inusual alta volatilidad del compuesto metálico tetracarbonilo de níquel llevó a Kelvin a afirmar que Mond había "dado alas a los metales pesados". [75]
Al año siguiente, Mond y Marcellin Berthelot descubrieron de forma independiente el pentacarbonilo de hierro , que se produce mediante un procedimiento similar al del tetracarbonilo de níquel. Mond reconoció el potencial económico de esta clase de compuestos, que utilizó comercialmente en el proceso Mond y financió más investigaciones sobre compuestos relacionados. Heinrich Hirtz y su colega M. Dalton Cowap sintetizaron carbonilos metálicos de cobalto , molibdeno , rutenio y nonacarbonilo de dihierro . [76] [77] En 1906, James Dewar y HO Jones pudieron determinar la estructura del nonacarbonilo de dihierro, que se produce a partir del pentacarbonilo de hierro por la acción de la luz solar. [78] Después de Mond, que murió en 1909, la química de los carbonilos metálicos cayó en el olvido durante varios años. BASF inició en 1924 la producción industrial de pentacarbonilo de hierro mediante un proceso desarrollado por Alwin Mittasch . El pentacarbonilo de hierro se utilizó para la producción de hierro de alta pureza, el llamado hierro carbonílico , y pigmento de óxido de hierro . [40] No fue hasta 1927 que A. Job y A. Cassal lograron preparar hexacarbonilo de cromo y hexacarbonilo de tungsteno , la primera síntesis de otros carbonilos metálicos homolépticos. [ cita requerida ]
Walter Hieber desempeñó un papel decisivo en los años posteriores a 1928 en el desarrollo de la química de los carbonilos metálicos. Investigó y descubrió sistemáticamente, entre otras cosas, la reacción de la base de Hieber , la primera ruta conocida para los hidruros de carbonilo metálico y las vías sintéticas que conducen a los carbonilos metálicos como el decacarbonilo de dirhenium . [79] Hieber, que desde 1934 era director del Instituto de Química Inorgánica de la Universidad Técnica de Múnich , publicó en cuatro décadas 249 artículos sobre la química de los carbonilos metálicos. [38]
También en la década de 1930 Walter Reppe , un químico industrial y más tarde miembro de la junta directiva de BASF, descubrió una serie de procesos catalíticos homogéneos, como la hidrocarboxilación , en la que las olefinas o alquinos reaccionan con monóxido de carbono y agua para formar productos como ácidos insaturados y sus derivados. [38] En estas reacciones, por ejemplo, el tetracarbonilo de níquel o los carbonilos de cobalto actúan como catalizadores. [80] Reppe también descubrió la ciclotrimerización y tetramerización del acetileno y sus derivados a benceno y derivados de benceno con carbonilos metálicos como catalizadores. BASF construyó en la década de 1960 una planta de producción de ácido acrílico mediante el proceso Reppe, que solo fue reemplazado en 1996 por métodos más modernos basados en la oxidación catalítica del propileno . [ cita requerida ]

Para el diseño racional de nuevos complejos se ha considerado útil el concepto de analogía isolobal. Roald Hoffmann recibió el Premio Nobel de Química por el desarrollo de este concepto. Este describe los fragmentos de carbonilo metálico de M(CO) n como partes de bloques de construcción octaédricos en analogía con los fragmentos tetraédricos CH 3 –, CH 2 – o CH– en química orgánica. En el ejemplo, el decacarbonilo de dimanganeso se forma en términos de la analogía isolobal de dos fragmentos d 7 Mn(CO) 5 , que son isolobales al radical metilo CH•
3. En analogía a cómo los radicales metilo se combinan para formar etano , estos pueden combinarse para formar decacarbonilo de dimanganeso . La presencia de fragmentos análogos isolobales no significa que se puedan sintetizar las estructuras deseadas. En su discurso del Premio Nobel, Hoffmann enfatizó que la analogía isolobal es un modelo útil pero simple, y en algunos casos no conduce al éxito. [81]
Los beneficios económicos de las carbonilaciones catalizadas por metales , como la química de Reppe y la hidroformilación , propiciaron el crecimiento de la zona. Se descubrieron compuestos de carbonilo metálico en los sitios activos de tres enzimas naturales. [82]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: Falta o está vacío |title=( ayuda )