El síndrome de Wolff-Parkinson-White ( WPWS ) es un trastorno debido a un tipo específico de problema con el sistema eléctrico del corazón que involucra una vía accesoria capaz de conducir corriente eléctrica entre las aurículas y los ventrículos , evitando así el nódulo auriculoventricular . [2] [3] Alrededor del 60% de las personas con el problema eléctrico desarrollaron síntomas, [5] que pueden incluir un latido cardíaco anormalmente rápido , palpitaciones , dificultad para respirar , mareos o síncope . [1] En raras ocasiones, puede ocurrir un paro cardíaco . [1] El tipo más común de latido cardíaco irregular que ocurre se conoce como taquicardia supraventricular paroxística . [1]
La causa del síndrome de WPW es generalmente desconocida y probablemente se deba a una combinación de factores genéticos y de azar. [2] Un pequeño número de casos se deben a una mutación del gen PRKAG2 que puede heredarse de forma autosómica dominante . [2] El mecanismo subyacente implica una vía de conducción eléctrica accesoria entre las aurículas y los ventrículos . [1] Se asocia con otras afecciones como la anomalía de Ebstein y la parálisis periódica hipocalémica . [1] El diagnóstico de WPW se produce con una combinación de palpitaciones y cuando un electrocardiograma (ECG) muestra un intervalo PR corto y una onda delta. [3] Es un tipo de síndrome de preexcitación . [3]
El síndrome de WPW puede ser controlado o tratado con medicamentos o una ablación (destrucción de los tejidos) como la ablación con catéter de radiofrecuencia . [4] Afecta entre el 0,1 y el 0,3% de la población. [1] El riesgo de muerte en aquellos que no presentan síntomas es de alrededor del 0,5% por año en niños y del 0,1% por año en adultos. [5] En algunos casos, el monitoreo no invasivo puede ayudar a estratificar con más cuidado a los pacientes en una categoría de riesgo menor. [6] En aquellos que no presentan síntomas, la observación continua puede ser razonable. [5] En aquellos con WPW complicado por fibrilación auricular , se puede utilizar cardioversión o el medicamento procainamida . [7] La afección recibe su nombre de Louis Wolff , John Parkinson y Paul Dudley White , quienes describieron los hallazgos del ECG en 1930. [3]
Las personas con WPW suelen ser asintomáticas cuando no tienen una frecuencia cardíaca rápida. Sin embargo, las personas pueden experimentar palpitaciones , mareos , falta de aire o, con poca frecuencia, síncope (desmayo o casi desmayo) durante episodios de taquicardia supraventricular . El WPW también se asocia con un riesgo muy pequeño de muerte súbita debido a alteraciones más peligrosas del ritmo cardíaco. [8]

La actividad eléctrica del corazón humano normal comienza cuando surge un potencial de acción cardíaca en el nódulo sinoauricular (SA), que se encuentra en la aurícula derecha . Desde allí, el estímulo eléctrico se transmite a través de vías internodales hasta el nódulo auriculoventricular (AV). Después de un breve retraso en el nódulo AV, el estímulo viaja a través del haz de His hasta las ramas izquierda y derecha del haz y luego a las fibras de Purkinje y al endocardio en el vértice del corazón, y finalmente al miocardio ventricular . [ cita requerida ]
El nodo AV cumple una importante función como "guardián", limitando la actividad eléctrica que llega a los ventrículos. En situaciones en las que las aurículas generan una actividad eléctrica excesivamente rápida (como la fibrilación auricular o el aleteo auricular ), el nodo AV limita la cantidad de señales que se conducen a los ventrículos. Por ejemplo, si las aurículas se activan eléctricamente a 300 latidos por minuto, la mitad de esos impulsos eléctricos pueden ser bloqueados por el nodo AV, de modo que los ventrículos se estimulan a solo 150 latidos por minuto, lo que da como resultado un pulso de 150 latidos por minuto. Otra propiedad importante del nodo AV es que ralentiza los impulsos eléctricos individuales. Esto se manifiesta en el electrocardiograma como el intervalo PR (el tiempo desde la activación eléctrica de las aurículas hasta la activación eléctrica de los ventrículos ), que generalmente se acorta a menos de 120 milisegundos de duración. [ cita requerida ]
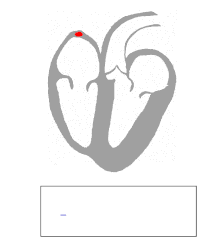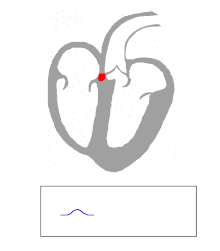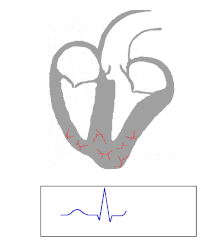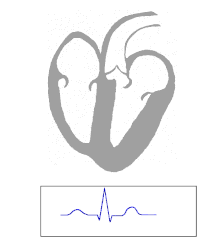
Las personas con WPW tienen una vía accesoria que comunica las aurículas y los ventrículos, además del nódulo AV. [6] Esta vía accesoria se conoce como haz de Kent. Esta vía accesoria no comparte las propiedades de desaceleración de la frecuencia del nódulo AV y puede conducir la actividad eléctrica a una frecuencia significativamente mayor que la del nódulo AV. Por ejemplo, en el ejemplo anterior, si una persona tuviera una frecuencia auricular de 300 latidos por minuto, el haz accesorio puede conducir todos los impulsos eléctricos desde las aurículas hasta los ventrículos, lo que hace que los ventrículos se contraigan a 300 latidos por minuto. Las frecuencias cardíacas extremadamente rápidas como esta pueden provocar inestabilidad hemodinámica o shock cardiogénico . En algunos casos, la combinación de una vía accesoria y ritmos cardíacos anormales puede desencadenar fibrilación ventricular , una de las principales causas de muerte cardíaca súbita. [ cita requerida ]
El WPW puede estar asociado con PRKAG2 , una enzima proteína quinasa codificada por el gen PRKAG2 . [9]

El haz de Kent es una vía de conducción accesoria o extra-anormal entre las aurículas y los ventrículos que está presente en un pequeño porcentaje (entre el 0,1 y el 0,3 %) de la población general. [10] [11] [12] Esta vía puede comunicar entre la aurícula izquierda y el ventrículo izquierdo, en cuyo caso se denomina "preexcitación de tipo A", o entre la aurícula derecha y el ventrículo derecho, en cuyo caso se denomina "preexcitación de tipo B" en una clasificación antigua, actualmente abandonada. [13] Los problemas surgen cuando esta vía crea un circuito eléctrico que pasa por alto el nódulo AV. El nódulo AV es capaz de reducir la velocidad de conducción de los impulsos eléctricos a los ventrículos, mientras que el haz de Kent carece de esta capacidad. Cuando se realiza una conexión eléctrica aberrante a través del haz de Kent, pueden producirse taquiarritmias. [ cita requerida ]

El WPW se diagnostica comúnmente en base al electrocardiograma en un individuo asintomático. En este caso, se manifiesta como una onda delta, que es un trazo ascendente arrastrado en el complejo QRS que se asocia con un intervalo PR corto. El intervalo PR corto y el arrastre del complejo QRS reflejan que el impulso llega a los ventrículos de manera temprana (a través de la vía accesoria) sin el retraso habitual que se experimenta en el nódulo AV. [ cita requerida ]
Si una persona con síndrome de WPW presenta episodios de fibrilación auricular, el ECG muestra una taquicardia polimórfica rápida de complejos anchos (sin torsades de pointes ). Esta combinación de fibrilación auricular y síndrome de WPW se considera peligrosa y la mayoría de los fármacos antiarrítmicos están contraindicados. [ cita requerida ]
Cuando un individuo está en ritmo sinusal normal , las características del ECG de WPW son un intervalo PR corto (de menos de 120 milisegundos de duración), un complejo QRS ensanchado (de más de 120 milisegundos de duración) con ascenso arrastrado del complejo QRS y cambios de repolarización secundaria (reflejados en cambios en el segmento ST y la onda T ). [ cita requerida ]
En las personas con WPW, la actividad eléctrica que se inicia en el nódulo SA viaja a través de la vía accesoria, así como a través del nódulo AV para activar los ventrículos a través de ambas vías. Dado que la vía accesoria no tiene las propiedades de desaceleración del impulso del nódulo AV, el impulso eléctrico activa primero los ventrículos a través de la vía accesoria, e inmediatamente después a través del nódulo AV. Esto produce el intervalo PR corto y el ascenso arrastrado del complejo QRS conocido como onda delta. [ cita requerida ]
En el caso de preexcitación tipo A (conexiones auriculoventriculares izquierdas), se observa una onda R positiva en V1 ("delta positiva") en las derivaciones precordiales del electrocardiograma, mientras que en la preexcitación tipo B (conexiones auriculoventriculares derechas), se observa una onda delta predominantemente negativa en la derivación V1 ("delta negativa"). [13]
Las personas con WPW pueden tener más de una vía accesoria; en algunos casos, se han encontrado hasta ocho vías anormales. Esto se ha observado en individuos con anomalía de Ebstein . [14]
El síndrome de Wolff–Parkinson–White a veces se asocia con la neuropatía óptica hereditaria de Leber , una forma de enfermedad mitocondrial . [15]

El WPW conlleva un pequeño riesgo de muerte súbita, probablemente debido a una fibrilación auricular de conducción rápida que causa fibrilación ventricular. Si bien el riesgo general es de aproximadamente 2,4 por 1000 personas al año, el riesgo en un individuo depende de las propiedades de la vía accesoria que causa la preexcitación. [8]
Una historia de síncope puede sugerir una vía accesoria de mayor riesgo, pero la mejor manera de estratificar el riesgo es evaluando la frecuencia con la que una vía puede conducir impulsos a los ventrículos, generalmente mediante estimulación eléctrica programada (PES) en el laboratorio de electrofisiología cardíaca . Se trata de un procedimiento invasivo, pero generalmente de bajo riesgo, durante el cual se estimulan las aurículas para intentar inducir una taquicardia. Si se puede desencadenar una taquicardia que afecte a la vía accesoria, el cardiólogo puede evaluar la rapidez con la que la vía accesoria puede conducir. Cuanto más rápido pueda conducir, mayor será la probabilidad de que la vía accesoria pueda conducir lo suficientemente rápido como para desencadenar una taquicardia letal. [ cita requerida ]
Las características de alto riesgo que pueden estar presentes durante la PES incluyen un período refractario efectivo de la vía accesoria menor a 250 ms, vías múltiples, ubicación septal de la vía e inducibilidad de taquicardia supraventricular ( AVRT , fibrilación auricular). Las personas con cualquiera de estas características de alto riesgo generalmente se consideran en mayor riesgo de MSC o taquicardia sintomática, y deben ser tratadas en consecuencia (es decir: ablación con catéter). [16]
No está claro si la estratificación de riesgo invasiva (con PES) es necesaria en el individuo asintomático. [17] Mientras que algunos grupos abogan por la PES para la estratificación de riesgo en todos los individuos menores de 35 años, otros solo la ofrecen a individuos que tienen antecedentes sugestivos de taquiarritmia, ya que la incidencia de muerte súbita cardíaca es muy baja (menos del 0,6% en algunos informes). [12] [18] [19]
Otros métodos de estratificación del riesgo incluyen la observación de la frecuencia ventricular durante la fibrilación auricular espontánea en un ECG de 12 derivaciones. Los intervalos RR de menos de 250 ms sugieren una vía de mayor riesgo. Durante la prueba de esfuerzo, la pérdida abrupta de la preexcitación a medida que aumenta la frecuencia cardíaca también sugiere una vía de menor riesgo. [8] Sin embargo, este enfoque se ve obstaculizado por la mejora normal en la conducción del nodo AV durante el ejercicio, que también puede enmascarar la preexcitación a pesar de la conducción continua por la vía accesoria. [20]
Según el protocolo ACLS , las personas con WPW que presentan ritmos cardíacos anormales rápidos ( taquiarritmias ) pueden requerir cardioversión eléctrica sincronizada si presentan signos o síntomas graves (por ejemplo, presión arterial baja o letargo con estado mental alterado ). Si están relativamente estables, se puede utilizar medicación. [21]
El patrón de WPW con estabilidad hemodinámica y taquicardia supraventricular ortodrómica que conduce a una taquicardia regular de complejo estrecho puede manejarse de manera similar a otras taquicardias supraventriculares regulares de complejo estrecho: primero con maniobras vagales seguidas de una prueba con adenosina (tratamiento de primera línea). Las pautas ACC/AHA/HRS de 2015 recomiendan betabloqueantes o bloqueadores de los canales de calcio como agentes de segunda línea; la cardioversión eléctrica se reserva para arritmias refractarias. Sin embargo, si existe alguna duda sobre el diagnóstico de taquicardia supraventricular ortodrómica o si se observa una conducción aberrante que conduce a un QRS de complejo ancho, puede ser prudente manejarla como una taquicardia de complejo ancho indiferenciada. [22]
Las personas con fibrilación auricular y respuesta ventricular rápida pueden recibir tratamiento con amiodarona [7] o procainamida [23] para estabilizar su frecuencia cardíaca. La procainamida y la cardioversión son tratamientos aceptados para la conversión de la taquicardia que se encuentra en el síndrome de WPW. [24] La amiodarona en la fibrilación auricular con síndrome de WPW está relacionada con la fibrilación ventricular y, por lo tanto, puede ser peor que la procainamida. [7]
Los bloqueadores del nódulo AV deben evitarse en la fibrilación auricular y el aleteo auricular con WPW o antecedentes de este; esto incluye adenosina , diltiazem , verapamilo , otros bloqueadores de los canales de calcio y betabloqueantes . [25] Pueden exacerbar el síndrome al bloquear la vía eléctrica normal del corazón (favoreciendo así la conducción auricular a ventrículo 1:1 a través de la vía de preexcitación, lo que puede provocar arritmias ventriculares inestables). [22]
El tratamiento definitivo del WPW es la destrucción de la vía eléctrica anormal mediante ablación con catéter . Los dos tipos principales de ablación con catéter incluyen la ablación por radiofrecuencia con calor o la crioablación con energía fría. [6] Este procedimiento lo realizan electrofisiólogos cardíacos y tiene una alta tasa de éxito en manos de un electrofisiólogo experimentado. [26] Los hallazgos de 1994 indican tasas de éxito de hasta el 95% en personas tratadas con ablación con catéter por radiofrecuencia para WPW. [27] Si la ablación con catéter por radiofrecuencia se realiza con éxito, la afección generalmente se considera curada. Las tasas de recurrencia suelen ser inferiores al 5% después de una ablación exitosa. [26] Algunos pacientes, como los que tienen anomalía de Ebstein subyacente y miocardiopatías hereditarias , pueden tener múltiples vías accesorias. [28]
El haz de Kent debe su nombre al fisiólogo británico Albert Frank Stanley Kent (1863-1958), quien describió las ramas laterales en el surco auriculoventricular del corazón de mono (creyendo erróneamente que éstas constituían el sistema de conducción auriculoventricular normal). [29] [30]
En 1915, Frank Norman Wilson (1890-1952) fue el primero en describir la enfermedad que más tarde se denominó síndrome de Wolff-Parkinson-White. [31] Alfred M. Wedd (1887-1967) fue el siguiente en describir la enfermedad en 1921. [32] A los cardiólogos Louis Wolff (1898-1972), John Parkinson (1885-1976) y Paul Dudley White (1886-1973) se les atribuye la descripción definitiva del trastorno en 1930. [33]