El niobio es un elemento químico ; su símbolo es Nb (antes columbio , Cb ) y su número atómico es 41. Es un metal de transición gris claro, cristalino y dúctil . El niobio puro tiene una dureza de Mohs similar al titanio puro , [6] y tiene una ductilidad similar al hierro . El niobio se oxida en la atmósfera terrestre muy lentamente, de ahí su aplicación en joyería como alternativa hipoalergénica al níquel . El niobio se encuentra a menudo en los minerales pirocloro y columbita . Su nombre proviene de la mitología griega : Niobe , hija de Tántalo , homónimo del tantalio . El nombre refleja la gran similitud entre los dos elementos en sus propiedades físicas y químicas, lo que los hace difíciles de distinguir. [7]
En 1801 , el químico inglés Charles Hatchett informó de un nuevo elemento similar al tantalio y lo llamó columbio. En 1809, el químico inglés William Hyde Wollaston concluyó erróneamente que el tantalio y el columbio eran idénticos. El químico alemán Heinrich Rose determinó en 1846 que los minerales de tantalio contienen un segundo elemento, al que llamó niobio. En 1864 y 1865, una serie de hallazgos científicos aclararon que el niobio y el columbio eran el mismo elemento (a diferencia del tantalio), y durante un siglo ambos nombres se utilizaron indistintamente. El niobio se adoptó oficialmente como nombre del elemento en 1949, pero el nombre columbio sigue utilizándose actualmente en la metalurgia de los Estados Unidos.
No fue hasta principios del siglo XX que el niobio se utilizó por primera vez comercialmente. El niobio es un aditivo importante para los aceros de baja aleación de alta resistencia. Brasil es el principal productor de niobio y ferroniobio , una aleación de 60-70% de niobio con hierro. El niobio se utiliza principalmente en aleaciones, la mayor parte en acero especial como el que se utiliza en gasoductos . Aunque estas aleaciones contienen un máximo de 0,1%, el pequeño porcentaje de niobio mejora la resistencia del acero al eliminar el carburo y el nitruro . La estabilidad de la temperatura de las superaleaciones que contienen niobio es importante para su uso en motores a reacción y cohetes .
El niobio se utiliza en diversos materiales superconductores . Estas aleaciones , que también contienen titanio y estaño , se utilizan ampliamente en los imanes superconductores de los escáneres de resonancia magnética . Otras aplicaciones del niobio incluyen la soldadura, las industrias nucleares, la electrónica, la óptica, la numismática y la joyería. En las dos últimas aplicaciones, la baja toxicidad y la iridiscencia producida por la anodización son propiedades muy deseadas. El niobio se considera un elemento crítico para la tecnología .
.jpg/440px-Charles_Hatchett._Soft-ground_etching_by_F._C._Lewis_after_T_Wellcome_V0002614_(cropped).jpg)
_-_n._2990_-_Niobe_madre_-_Firenze.jpg/440px-Sommer,_Giorgio_(1834-1914)_-_n._2990_-_Niobe_madre_-_Firenze.jpg)
El niobio fue identificado por el químico inglés Charles Hatchett en 1801. [8] [9] [10] Encontró un nuevo elemento en una muestra mineral que había sido enviada a Inglaterra desde Connecticut , Estados Unidos en 1734 por John Winthrop FRS (nieto de John Winthrop el Joven ) y nombró al mineral columbita y al nuevo elemento columbio en honor a Columbia , el nombre poético de los Estados Unidos. [11] [12] [13] El columbio descubierto por Hatchett probablemente fue una mezcla del nuevo elemento con tantalio. [11]
Posteriormente, hubo una considerable confusión [14] sobre la diferencia entre el columbio (niobio) y el tántalo, estrechamente relacionado. En 1809, el químico inglés William Hyde Wollaston comparó los óxidos derivados tanto del columbio (columbita, con una densidad de 5,918 g/cm 3 ) como del tántalo (tantalita) , con una densidad de más de 8 g/cm 3 , y concluyó que los dos óxidos, a pesar de la diferencia significativa en densidad, eran idénticos; por lo tanto, mantuvo el nombre de tántalo. [14] Esta conclusión fue cuestionada en 1846 por el químico alemán Heinrich Rose , quien argumentó que había dos elementos diferentes en la muestra de tantalita, y los nombró en honor a los hijos de Tántalo : niobio (de Niobe ) y pelopio (de Pelops ). [15] [16] Esta confusión surgió de las mínimas diferencias observadas entre el tántalo y el niobio. Los elementos nuevos reivindicados , pelopio , ilmenio y dianio [17], eran de hecho idénticos al niobio o a las mezclas de niobio y tantalio. [18]
Las diferencias entre el tántalo y el niobio fueron demostradas inequívocamente en 1864 por Christian Wilhelm Blomstrand [18] y Henri Étienne Sainte-Claire Deville , así como por Louis J. Troost , quien determinó las fórmulas de algunos de los compuestos en 1865 [18] [19] y finalmente por el químico suizo Jean Charles Galissard de Marignac [20] en 1866, quienes demostraron que solo había dos elementos. Los artículos sobre el ilmenio siguieron apareciendo hasta 1871. [21]
De Marignac fue el primero en preparar el metal en 1864, cuando redujo el cloruro de niobio calentándolo en una atmósfera de hidrógeno . [22] Aunque de Marignac pudo producir niobio sin tantalio a mayor escala en 1866, no fue hasta principios del siglo XX que el niobio se utilizó en filamentos de lámparas incandescentes , la primera aplicación comercial. [19] Este uso rápidamente se volvió obsoleto debido a la sustitución del niobio por tungsteno , que tiene un punto de fusión más alto. Que el niobio mejora la resistencia del acero se descubrió por primera vez en la década de 1920, y esta aplicación sigue siendo su uso predominante. [19] En 1961, el físico estadounidense Eugene Kunzler y sus colaboradores de Bell Labs descubrieron que el niobio-estaño sigue exhibiendo superconductividad en presencia de fuertes corrientes eléctricas y campos magnéticos, [23] lo que lo convierte en el primer material que soporta las altas corrientes y campos necesarios para imanes de alta potencia útiles y maquinaria de energía eléctrica . Este descubrimiento permitió, dos décadas después, la producción de largos cables multifilares enrollados en bobinas para crear electroimanes grandes y potentes para maquinaria rotatoria, aceleradores de partículas y detectores de partículas. [24] [25]
Columbio (símbolo Cb) [26] fue el nombre dado originalmente por Hatchett tras su descubrimiento del metal en 1801. [9] El nombre reflejaba que el espécimen tipo del mineral provenía de los Estados Unidos de América ( Columbia ). [27] Este nombre siguió utilizándose en revistas estadounidenses (el último artículo publicado por la American Chemical Society con columbio en su título data de 1953 [28]) , mientras que el niobio se utilizó en Europa. Para poner fin a esta confusión, se eligió el nombre niobio para el elemento 41 en la 15.ª Conferencia de la Unión de Química en Ámsterdam en 1949. [29] Un año después, este nombre fue adoptado oficialmente por la Unión Internacional de Química Pura y Aplicada (IUPAC) después de 100 años de controversia, a pesar de la precedencia cronológica del nombre columbio . [29] Esto fue una especie de compromiso; [29] la IUPAC aceptó tungsteno en lugar de wolframio en deferencia al uso norteamericano; y niobio en lugar de columbio en deferencia al uso europeo. Si bien muchas sociedades químicas y organizaciones gubernamentales de los EE. UU. suelen utilizar el nombre oficial de la IUPAC, algunos metalúrgicos y sociedades de metales aún utilizan el nombre estadounidense original, " columbio " . [30] [31] [32] [33]
El niobio es un metal gris, brillante , dúctil y paramagnético del grupo 5 de la tabla periódica (ver tabla), con una configuración electrónica en las capas más externas atípica para el grupo 5. De manera similar, existen configuraciones atípicas en las proximidades del rutenio (44), el rodio (45) y el paladio (46).
Aunque se piensa que tiene una estructura cristalina cúbica centrada en el cuerpo desde el cero absoluto hasta su punto de fusión, las mediciones de alta resolución de la expansión térmica a lo largo de los tres ejes cristalográficos revelan anisotropías que son inconsistentes con una estructura cúbica. [34] Por lo tanto, se esperan más investigaciones y descubrimientos en esta área.
El niobio se convierte en un superconductor a temperaturas criogénicas . A presión atmosférica, tiene la temperatura crítica más alta de los superconductores elementales a 9,2 K. [35] El niobio tiene la mayor profundidad de penetración magnética de todos los elementos. [35] Además, es uno de los tres superconductores elementales de tipo II , junto con el vanadio y el tecnecio . Las propiedades superconductoras dependen en gran medida de la pureza del metal niobio. [36]
Cuando está muy puro, es comparativamente blando y dúctil, pero las impurezas lo hacen más duro. [37]
El metal tiene una sección transversal de captura baja para neutrones térmicos ; [38] por lo tanto, se utiliza en las industrias nucleares donde se desean estructuras transparentes a los neutrones. [39]
El metal adquiere un tono azulado cuando se expone al aire a temperatura ambiente durante períodos prolongados. [40] A pesar de su alto punto de fusión en forma elemental (2468 °C), es menos denso que otros metales refractarios . Además, es resistente a la corrosión, presenta propiedades superconductoras y forma capas de óxido dieléctrico .
El niobio es ligeramente menos electropositivo y más compacto que su predecesor en la tabla periódica, el circonio , mientras que es virtualmente idéntico en tamaño a los átomos más pesados de tántalo, como resultado de la contracción de los lantánidos . [37] Como resultado, las propiedades químicas del niobio son muy similares a las del tántalo, que aparece directamente debajo del niobio en la tabla periódica . [19] Aunque su resistencia a la corrosión no es tan sobresaliente como la del tántalo, el precio más bajo y la mayor disponibilidad hacen que el niobio sea atractivo para aplicaciones menos exigentes, como los revestimientos de cubas en plantas químicas. [37]
El niobio en la corteza terrestre se compone casi en su totalidad de un isótopo estable , el 93 Nb. [41] En 2003, se habían sintetizado al menos 32 radioisótopos , con masas atómicas que van desde 81 a 113. El más estable es el 92 Nb, con una vida media de 34,7 millones de años. El 92 Nb, junto con el 94 Nb, se ha detectado en muestras refinadas de niobio terrestre y puede originarse a partir del bombardeo de muones de rayos cósmicos en la corteza terrestre. [42] Uno de los isótopos de niobio menos estables es el 113 Nb; su vida media estimada es de 30 milisegundos. Los isótopos más ligeros que el estable 93 Nb tienden a la desintegración β + , y los que son más pesados tienden a la desintegración β- , con algunas excepciones. 81 Nb, 82 Nb y 84 Nb tienen trayectorias de desintegración de emisión de protones retardadas β + menores, 91 Nb se desintegra por captura de electrones y emisión de positrones , y 92 Nb se desintegra tanto por desintegración β + como β − . [41]
Se han descrito al menos 25 isómeros nucleares , con masas atómicas que van desde 84 a 104. Dentro de este rango, solo 96 Nb, 101 Nb y 103 Nb no tienen isómeros. El más estable de los isómeros del niobio es 93m Nb con una vida media de 16,13 años. El isómero menos estable es 84m Nb con una vida media de 103 ns. Todos los isómeros del niobio se desintegran por transición isomérica o desintegración beta excepto 92m1 Nb, que tiene una rama de captura de electrones menor. [41]
Se estima que el niobio es el 33.º elemento más abundante en la corteza terrestre , con 20 ppm . [43] Algunos creen que la abundancia en la Tierra es mucho mayor y que la alta densidad del elemento lo ha concentrado en el núcleo de la Tierra. [31] El elemento libre no se encuentra en la naturaleza, pero el niobio se presenta en combinación con otros elementos en los minerales. [37] Los minerales que contienen niobio a menudo también contienen tantalio. Los ejemplos incluyen columbita ( (Fe,Mn)Nb 2 O 6 ) y columbita-tantalita (o coltán , (Fe,Mn)(Ta,Nb) 2 O 6 ). [44] Minerales de columbita-tantalita (las especies más comunes son columbita-(Fe) y tantalita-(Fe), donde "-(Fe)" es el sufijo de Levinson que indica la prevalencia del hierro sobre otros elementos como el manganeso [45] [46] [47] [48] ) que se encuentran más habitualmente como minerales accesorios en intrusiones de pegmatita y en rocas intrusivas alcalinas . Menos comunes son los niobatos de calcio , uranio , torio y los elementos de tierras raras . Ejemplos de tales niobatos son el pirocloro ( (Na,Ca) 2 Nb 2 O 6 (OH,F) ) (ahora un nombre de grupo, con un ejemplo relativamente común siendo, por ejemplo, el fluorcalciopirocloro [47] [48] [49] [50] [51] ) y la euxenita (correctamente llamada euxenita-(Y) [47] [48 ] [52] ) ( (Y,Ca,Ce,U,Th)(Nb,Ta,Ti) 2 O 6 ). Estos grandes depósitos de niobio se han encontrado asociados con carbonatitas ( rocas ígneas de carbonato - silicato ) y como un constituyente del pirocloro. [53]
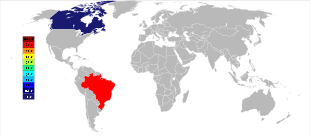
Los tres mayores depósitos de pirocloro actualmente explotados, dos en Brasil y uno en Canadá, se encontraron en la década de 1950 y siguen siendo los principales productores de concentrados minerales de niobio. [19] El depósito más grande está alojado dentro de una intrusión de carbonatita en Araxá , estado de Minas Gerais , Brasil, propiedad de CBMM ( Companhia Brasileira de Metalurgia e Mineração ); el otro depósito brasileño activo está ubicado cerca de Catalão , estado de Goiás , y es propiedad de China Molybdenum , también alojado dentro de una intrusión de carbonatita. [54] Juntas, esas dos minas producen alrededor del 88% del suministro mundial. [55] Brasil también tiene un depósito grande pero aún sin explotar cerca de São Gabriel da Cachoeira , estado de Amazonas , así como algunos depósitos más pequeños, especialmente en el estado de Roraima . [55] [56]
El tercer mayor productor de niobio es la mina Niobec , alojada en carbonatita , en Saint-Honoré , cerca de Chicoutimi , Quebec , Canadá, propiedad de Magris Resources. [57] Produce entre el 7% y el 10% del suministro mundial. [54] [55]
Después de la separación de los demás minerales, se obtienen los óxidos mixtos de tantalio Ta 2 O 5 y niobio Nb 2 O 5 . El primer paso en el procesamiento es la reacción de los óxidos con ácido fluorhídrico : [44]
La primera separación a escala industrial, desarrollada por el químico suizo de Marignac , explota las diferentes solubilidades de los fluoruros complejos de niobio y tantalio , oxipentafluoroniobato dipotásico monohidrato ( K 2 [NbOF 5 ]·H 2 O ) y heptafluorotantalato dipotásico ( K 2 [TaF 7 ] ) en agua. Los procesos más nuevos utilizan la extracción líquida de los fluoruros de la solución acuosa mediante disolventes orgánicos como la ciclohexanona . [44] Los fluoruros complejos de niobio y tantalio se extraen por separado del disolvente orgánico con agua y se precipitan mediante la adición de fluoruro de potasio para producir un complejo de fluoruro de potasio, o se precipitan con amoníaco como pentóxido: [58]
Seguido por:
Se utilizan varios métodos para la reducción a niobio metálico. La electrólisis de una mezcla fundida de K 2 [ NbOF 5 ] y cloruro de sodio es uno; el otro es la reducción del fluoruro con sodio . Con este método, se puede obtener un niobio de pureza relativamente alta. En la producción a gran escala, el Nb 2 O 5 se reduce con hidrógeno o carbono. [58] En la reacción aluminotérmica , una mezcla de óxido de hierro y óxido de niobio se hace reaccionar con aluminio :
Se añaden pequeñas cantidades de oxidantes como el nitrato de sodio para mejorar la reacción. El resultado es óxido de aluminio y ferroniobio , una aleación de hierro y niobio utilizada en la producción de acero. [59] [60] El ferroniobio contiene entre un 60 y un 70 % de niobio. [54] Sin óxido de hierro, se utiliza el proceso aluminotérmico para producir niobio. Es necesaria una purificación adicional para alcanzar el grado de aleaciones superconductoras . La fusión por haz de electrones al vacío es el método utilizado por los dos principales distribuidores de niobio. [61] [62]
En 2013 [actualizar], el CBMM de Brasil controlaba el 85 por ciento de la producción mundial de niobio. [63] El Servicio Geológico de los Estados Unidos estima que la producción aumentó de 38.700 toneladas en 2005 a 44.500 toneladas en 2006. [64] [65] Se estima que los recursos mundiales son de 4,4 millones de toneladas. [65] Durante el período de diez años entre 1995 y 2005, la producción se duplicó con creces, a partir de 17.800 toneladas en 1995. [66] Entre 2009 y 2011, la producción se mantuvo estable en 63.000 toneladas por año, [67] con una ligera disminución en 2012 a solo 50.000 toneladas por año. [68]
Se encuentran cantidades menores en el depósito Kanyika de Malawi ( mina Kanyika ).
En muchos sentidos, el niobio es similar al tantalio y al circonio . Reacciona con la mayoría de los no metales a altas temperaturas; con flúor a temperatura ambiente; con cloro a 150 °C e hidrógeno a 200 ° C ; y con nitrógeno a 400 °C, con productos que frecuentemente son intersticiales y no estequiométricos. [37] El metal comienza a oxidarse en el aire a 200 ° C . [58] Resiste la corrosión por ácidos, incluidos el agua regia , el clorhídrico , el sulfúrico , el nítrico y el fosfórico . [37] El niobio es atacado por ácido sulfúrico concentrado caliente, ácido fluorhídrico y mezclas de ácido fluorhídrico/nítrico. También es atacado por soluciones calientes y saturadas de hidróxido de metal alcalino.
Aunque el niobio exhibe todos los estados de oxidación formales desde +5 a -1, los compuestos más comunes tienen niobio en el estado +5. [37] Característicamente, los compuestos en estados de oxidación menores a 5+ muestran enlaces Nb–Nb. En soluciones acuosas, el niobio solo exhibe el estado de oxidación +5. También es fácilmente propenso a la hidrólisis y es apenas soluble en soluciones diluidas de ácidos clorhídrico , sulfúrico , nítrico y fosfórico debido a la precipitación de óxido de Nb hidratado. [61] El Nb(V) también es ligeramente soluble en medios alcalinos debido a la formación de especies solubles de polioxoniobato. [72] [73]
El niobio forma óxidos en los estados de oxidación +5 ( Nb 2 O 5 ), [74] +4 ( NbO 2 ), y el estado de oxidación más raro, +2 ( NbO ). [75] El más común es el pentóxido, precursor de casi todos los compuestos y aleaciones de niobio. [58] [76] Los niobatos se generan disolviendo el pentóxido en soluciones de hidróxido básico o fundiéndolo en óxidos de metales alcalinos. Algunos ejemplos son el niobato de litio ( LiNbO 3 ) y el niobato de lantano ( LaNbO 4 ). En el niobato de litio hay una estructura similar a la perovskita distorsionada trigonalmente , mientras que el niobato de lantano contiene solo NbO 3−
4iones. [58] También se conoce el sulfuro de niobio en capas ( NbS 2 ). [37]
Los materiales pueden recubrirse con una película delgada de óxido de niobio (V) mediante procesos de deposición química en fase de vapor o deposición de capa atómica , producidos por la descomposición térmica del etóxido de niobio (V) a temperaturas superiores a 350 °C. [77] [78]


El niobio forma haluros en los estados de oxidación de +5 y +4, así como diversos compuestos subestequiométricos . [58] [61] Los pentahaluros ( NbX
5) presentan centros octaédricos de Nb. El pentafluoruro de niobio ( NbF 5 ) es un sólido blanco con un punto de fusión de 79,0 °C y el pentacloruro de niobio ( NbCl 5 ) es amarillo (ver imagen a la derecha) con un punto de fusión de 203,4 °C. Ambos se hidrolizan para dar óxidos y oxihaluros, como NbOCl 3 . El pentacloruro es un reactivo versátil utilizado para generar compuestos organometálicos , como el dicloruro de nioboceno ( (C
5yo
5)
2NbCl
2). [79] Los tetrahaluros ( NbX
4) son polímeros de color oscuro con enlaces Nb-Nb; por ejemplo, el tetrafluoruro de niobio higroscópico negro ( NbF 4 ) y el tetracloruro de niobio marrón ( NbCl 4 ).
Los compuestos de haluro aniónico de niobio son bien conocidos, debido en parte a la acidez de Lewis de los pentahaluros. El más importante es [NbF 7 ] 2− , un intermediario en la separación de Nb y Ta de los minerales. [44] Este heptafluoruro tiende a formar el oxopentafluoruro más fácilmente que el compuesto de tántalo. Otros complejos de haluro incluyen el [ NbCl 6 ] − octaédrico :
Al igual que con otros metales con números atómicos bajos, se conoce una variedad de iones de cúmulos de haluro reducido, siendo el principal ejemplo [ Nb 6 Cl 18 ] 4− . [80]
Otros compuestos binarios de niobio incluyen el nitruro de niobio (NbN), que se convierte en un superconductor a bajas temperaturas y se utiliza en detectores de luz infrarroja. [81] El principal carburo de niobio es el NbC, un material cerámico extremadamente duro y refractario , utilizado comercialmente en brocas para herramientas de corte .

De las 44.500 toneladas de niobio extraídas en 2006, se estima que el 90% se utilizó en acero estructural de alta calidad. La segunda aplicación más importante son las superaleaciones . [82] Los superconductores y componentes electrónicos de aleaciones de niobio representan una parte muy pequeña de la producción mundial. [82]
El niobio es un elemento de microaleación eficaz para el acero, dentro del cual forma carburo de niobio y nitruro de niobio . [31] Estos compuestos mejoran el refinado del grano y retardan la recristalización y el endurecimiento por precipitación . Estos efectos a su vez aumentan la tenacidad , la resistencia , la conformabilidad y la soldabilidad . [31] Dentro de los aceros inoxidables microaleados , el contenido de niobio es una adición pequeña (menos del 0,1%) [83] pero importante para los aceros de baja aleación de alta resistencia que se utilizan ampliamente estructuralmente en los automóviles modernos. [31] El niobio a veces se utiliza en cantidades considerablemente mayores para componentes de máquinas y cuchillas altamente resistentes al desgaste , tan altas como el 3% en el acero inoxidable Crucible CPM S110V. [84]
Estas mismas aleaciones de niobio se utilizan a menudo en la construcción de tuberías. [85] [86]
Se utilizan cantidades de niobio en superaleaciones a base de níquel, cobalto y hierro en proporciones de hasta 6,5% [83] para aplicaciones como componentes de motores a reacción , turbinas de gas , subconjuntos de cohetes, sistemas de turbocompresores, equipos de combustión y de resistencia al calor. El niobio precipita una fase γ'' endurecedora dentro de la estructura del grano de la superaleación. [87]
Un ejemplo de superaleación es Inconel 718 , que consta de aproximadamente 50% de níquel , 18,6% de cromo , 18,5% de hierro , 5% de niobio, 3,1% de molibdeno , 0,9% de titanio y 0,4% de aluminio . [88] [89]
Estas superaleaciones se utilizaron, por ejemplo, en sistemas avanzados de fuselaje de aviones para el programa Gemini . Otra aleación de niobio [ aclaración necesaria ] se utilizó para la boquilla del módulo de servicio Apollo . Debido a que el niobio se oxida a temperaturas superiores a los 400 °C, es necesario un revestimiento protector para estas aplicaciones para evitar que la aleación se vuelva quebradiza . [90]

La aleación C-103 fue desarrollada a principios de la década de 1960 en conjunto por Wah Chang Corporation y Boeing Co. DuPont , Union Carbide Corp., General Electric Co. y varias otras compañías estaban desarrollando aleaciones a base de Nb simultáneamente, en gran medida impulsadas por la Guerra Fría y la carrera espacial . Está compuesta por un 89 % de niobio, un 10 % de hafnio y un 1 % de titanio y se utiliza para las boquillas de los propulsores de cohetes líquidos , como el motor de descenso de los módulos lunares Apollo . [90]
La reactividad del niobio con el oxígeno requiere que se trabaje en vacío o en una atmósfera inerte , lo que aumenta significativamente el costo y la dificultad de producción. La refundición por arco al vacío (VAR) y la fusión por haz de electrones (EBM), procesos novedosos en ese momento, permitieron el desarrollo del niobio y otros metales reactivos. El proyecto que produjo el C-103 comenzó en 1959 con nada menos que 256 aleaciones experimentales de niobio en la "serie C" ( el C posiblemente surja del columbio ) que podrían fundirse como botones y laminarse en láminas . Wah Chang Corporation tenía un inventario de hafnio , refinado a partir de aleaciones de circonio de grado nuclear , que quería poner en uso comercial. La composición experimental número 103 de las aleaciones de la serie C, Nb-10Hf-1Ti, tenía la mejor combinación de conformabilidad y propiedades de alta temperatura. Wah Chang fabricó la primera hornada de 500 lb de C-103 en 1961, de lingote a lámina, utilizando EBM y VAR. Las aplicaciones previstas incluían motores de turbina e intercambiadores de calor de metal líquido . Las aleaciones de niobio competidoras de esa época incluían FS85 (Nb-10W-28Ta-1Zr) de Fansteel Metallurgical Corp. , Cb129Y (Nb-10W-10Hf-0.2Y) de Wah Chang y Boeing, Cb752 (Nb-10W-2.5Zr) de Union Carbide y Nb1Zr de Superior Tube Co. [90]

La boquilla de la serie de motores Merlin Vacuum desarrollados por SpaceX para la etapa superior de su cohete Falcon 9 está hecha de una aleación de niobio [ aclaración necesaria ] . [91]
Las superaleaciones a base de niobio se utilizan para producir componentes para sistemas de misiles hipersónicos . [92]

Niobio-germanio ( Nb
3Ge ), niobio-estaño ( Nb
3El Sn ), así como las aleaciones de niobio-titanio se utilizan como un cable superconductor de tipo II para imanes superconductores . [93] [94] Estos imanes superconductores se utilizan en imágenes por resonancia magnética e instrumentos de resonancia magnética nuclear, así como en aceleradores de partículas . [95] Por ejemplo, el Gran Colisionador de Hadrones utiliza 600 toneladas de hilos superconductores, mientras que el Reactor Termonuclear Experimental Internacional utiliza aproximadamente 600 toneladas de hilos de Nb3Sn y 250 toneladas de hilos de NbTi. [96] Solo en 1992, se construyeron sistemas de imágenes por resonancia magnética clínica por un valor de más de mil millones de dólares con alambre de niobio-titanio. [24]

Las cavidades superconductoras de radiofrecuencia (SRF) utilizadas en los láseres de electrones libres FLASH (resultado del proyecto cancelado del acelerador lineal TESLA) y XFEL están hechas de niobio puro. [97] Un equipo de criomódulos en Fermilab utilizó la misma tecnología SRF del proyecto FLASH para desarrollar cavidades SRF de nueve celdas a 1,3 GHz hechas de niobio puro. Las cavidades se utilizarán en el acelerador lineal de partículas de 30 kilómetros (19 millas) del Colisionador Lineal Internacional . [98] La misma tecnología se utilizará en LCLS-II en el Laboratorio Nacional de Aceleradores SLAC y PIP-II en Fermilab. [99]
La alta sensibilidad de los bolómetros superconductores de nitruro de niobio los convierte en un detector ideal para la radiación electromagnética en la banda de frecuencias de THz. Estos detectores se probaron en el Telescopio Submilimétrico , el Telescopio del Polo Sur , el Telescopio del Laboratorio del Receptor y en APEX , y ahora se utilizan en el instrumento HIFI a bordo del Observatorio Espacial Herschel . [100]
El niobato de litio , que es un ferroeléctrico , se utiliza ampliamente en teléfonos móviles y moduladores ópticos , y para la fabricación de dispositivos de ondas acústicas de superficie . Pertenece a los ferroeléctricos de estructura ABO 3 como el tantalato de litio y el titanato de bario . [101] Los condensadores de niobio están disponibles como alternativa a los condensadores de tantalio , [102] pero los condensadores de tantalio aún predominan. El niobio se agrega al vidrio para obtener un índice de refracción más alto, lo que hace posible gafas correctivas más delgadas y livianas .
El niobio y algunas aleaciones de niobio son fisiológicamente inertes e hipoalergénicos . Por este motivo, el niobio se utiliza en prótesis y dispositivos implantarios, como los marcapasos. [103] El niobio tratado con hidróxido de sodio forma una capa porosa que favorece la osteointegración . [104]
Al igual que el titanio, el tantalio y el aluminio, el niobio se puede calentar y anodizar (" anodización reactiva de metal ") para producir una amplia gama de colores iridiscentes para joyería, [105] [106] donde su propiedad hipoalergénica es muy deseable. [107]
El niobio se utiliza como metal precioso en monedas conmemorativas, a menudo con plata u oro. Por ejemplo, Austria produjo una serie de monedas de euro de plata y niobio a partir de 2003; el color de estas monedas se crea mediante la difracción de la luz por una fina capa de óxido anodizado. [108] En 2012, hay diez monedas disponibles que muestran una amplia variedad de colores en el centro de la moneda: azul, verde, marrón, morado, violeta o amarillo. Dos ejemplos más son la moneda conmemorativa austríaca de 25 € de 2004 con motivo de los 150 años del ferrocarril alpino de Semmering , [109] y la moneda conmemorativa austríaca de 25 € de 2006 con motivo de la navegación por satélite europea . [110] La Casa de la Moneda de Austria produjo una serie similar de monedas para Letonia a partir de 2004, [111] a la que le siguió otra en 2007. [112] En 2011, la Real Casa de la Moneda de Canadá comenzó la producción de una moneda de plata esterlina y niobio de $5 llamada Hunter's Moon [113] en la que el niobio se oxidó selectivamente, creando así acabados únicos en los que no hay dos monedas exactamente iguales.
Los sellos del tubo de arco de las lámparas de vapor de sodio de alta presión están hechos de niobio, a veces aleado con un 1% de circonio ; el niobio tiene un coeficiente de expansión térmica muy similar, que coincide con la cerámica del tubo de arco de alúmina sinterizada , un material translúcido que resiste el ataque químico o la reducción por el sodio líquido caliente y el vapor de sodio contenidos dentro de la lámpara de operación. [114] [115] [116]
El niobio se utiliza en varillas de soldadura por arco para algunos grados estabilizados de acero inoxidable [117] y en ánodos para sistemas de protección catódica en algunos tanques de agua, que luego suelen revestirse con platino. [118] [119]
El niobio se utiliza para fabricar el cable de alto voltaje del módulo receptor de partículas de la corona solar de la sonda solar Parker . [120]
El niobio es un componente de un pigmento amarillo inorgánico estable y resistente a la luz que tiene el nombre comercial NTP Yellow. Es óxido de niobio, azufre, estaño y zinc, un pirocloro , producido mediante calcinación a alta temperatura . El pigmento también se conoce como pigmento amarillo 227, comúnmente listado como PY 227 o PY227. [121]
El niobio se emplea en la industria de la energía atómica por su alta resistencia a la temperatura y a la corrosión, así como por su estabilidad bajo la radiación . [122] Se utiliza en reactores nucleares para componentes como barras de combustible y núcleos de reactores. [123] [124]
El niobio no tiene ninguna función biológica conocida. Si bien el polvo de niobio es irritante para los ojos y la piel y un posible peligro de incendio, el niobio elemental en mayor escala es fisiológicamente inerte (y por lo tanto hipoalergénico) e inofensivo. Se utiliza a menudo en joyería y se ha probado su uso en algunos implantes médicos. [125] [126]
Se han realizado pruebas en ratas para la exposición a corto y largo plazo a los niobatos y al cloruro de niobio, dos sustancias químicas solubles en agua. Las ratas tratadas con una única inyección de pentacloruro de niobio o niobatos muestran una dosis letal media ( DL50 ) de entre 10 y 100 mg/kg. [127] [128] [129] En el caso de la administración oral, la toxicidad es menor; un estudio con ratas arrojó una DL50 después de siete días de 940 mg/kg. [127]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )