Las glándulas suprarrenales (también conocidas como glándulas suprarrenales ) son glándulas endocrinas que producen una variedad de hormonas, entre ellas la adrenalina y los esteroides aldosterona y cortisol . [1] [2] Se encuentran por encima de los riñones . Cada glándula tiene una corteza externa que produce hormonas esteroides y una médula interna . La corteza suprarrenal en sí se divide en tres zonas principales: la zona glomerulosa , la zona fasciculada y la zona reticular . [3]
La corteza suprarrenal produce tres tipos principales de hormonas esteroides : mineralocorticoides , glucocorticoides y andrógenos . Los mineralocorticoides (como la aldosterona ) producidos en la zona glomerulosa ayudan a regular la presión arterial y el equilibrio electrolítico . Los glucocorticoides cortisol y cortisona se sintetizan en la zona fasciculada; sus funciones incluyen la regulación del metabolismo y la supresión del sistema inmunológico . La capa más interna de la corteza, la zona reticular, produce andrógenos que se convierten en hormonas sexuales completamente funcionales en las gónadas y otros órganos diana. [4] La producción de hormonas esteroides se llama esteroidogénesis e implica una serie de reacciones y procesos que tienen lugar en las células corticales. [5] La médula produce las catecolaminas , que funcionan para producir una respuesta rápida en todo el cuerpo en situaciones de estrés . [4]
Varias enfermedades endocrinas implican disfunciones de la glándula suprarrenal. La sobreproducción de cortisol conduce al síndrome de Cushing , mientras que la producción insuficiente se asocia con la enfermedad de Addison . La hiperplasia suprarrenal congénita es una enfermedad genética producida por la desregulación de los mecanismos de control endocrino. [4] [6] Una variedad de tumores pueden surgir del tejido suprarrenal y se encuentran comúnmente en las imágenes médicas cuando se buscan otras enfermedades. [7]

Las glándulas suprarrenales están ubicadas a ambos lados del cuerpo en el retroperitoneo , por encima y ligeramente medial a los riñones . En los humanos, la glándula suprarrenal derecha tiene forma piramidal, mientras que la izquierda tiene forma semilunar o de medialuna y es algo más grande. [8] Las glándulas suprarrenales miden aproximadamente 5 cm de largo, 3 cm de ancho y hasta 1 cm de grosor. [9] Su peso combinado en un humano adulto varía de 7 a 10 gramos. [10] Las glándulas son de color amarillento. [8]
Las glándulas suprarrenales están rodeadas por una cápsula grasa y se encuentran dentro de la fascia renal , que también rodea los riñones. Un tabique débil (pared) de tejido conectivo separa las glándulas de los riñones. [11] Las glándulas suprarrenales están directamente debajo del diafragma y están unidas a los pilares del diafragma por la fascia renal. [11]
Cada glándula suprarrenal tiene dos partes distintas, cada una con una función única: la corteza suprarrenal externa y la médula interna , ambas producen hormonas. [12]

La corteza suprarrenal es la región externa y también la parte más grande de una glándula suprarrenal. Se divide en tres zonas separadas: zona glomerulosa, zona fasciculada y zona reticular. Cada zona es responsable de producir hormonas específicas. La corteza suprarrenal es la capa más externa de la glándula suprarrenal. Dentro de la corteza hay tres capas, llamadas "zonas". Cuando se observa bajo un microscopio, cada capa tiene una apariencia distinta y cada una tiene una función diferente. [13] La corteza suprarrenal se dedica a la producción de hormonas , a saber, aldosterona , cortisol y andrógenos . [14]
La zona más externa de la corteza suprarrenal es la zona glomerulosa . Se encuentra inmediatamente debajo de la cápsula fibrosa de la glándula. Las células de esta capa forman grupos ovalados, separados por delgadas hebras de tejido conectivo de la cápsula fibrosa de la glándula y llevan capilares anchos . [15]
Esta capa es el sitio principal de producción de aldosterona , un mineralocorticoide , por la acción de la enzima aldosterona sintasa . [16] [17] La aldosterona juega un papel importante en la regulación a largo plazo de la presión arterial . [18]
La zona fasciculada está situada entre la zona glomerulosa y la zona reticular. Las células de esta capa son responsables de producir glucocorticoides como el cortisol . [19] Es la más grande de las tres capas y representa casi el 80% del volumen de la corteza. [3] En la zona fasciculada, las células están dispuestas en columnas orientadas radialmente hacia la médula. Las células contienen numerosas gotitas de lípidos, abundantes mitocondrias y un retículo endoplasmático liso complejo . [15]
La capa cortical más interna, la zona reticular , se encuentra directamente adyacente al bulbo raquídeo. Produce andrógenos , principalmente dehidroepiandrosterona (DHEA), sulfato de DHEA (DHEA-S) y androstenediona (el precursor de la testosterona ) en los seres humanos. [19] Sus pequeñas células forman cordones y racimos irregulares, separados por capilares y tejido conectivo. Las células contienen cantidades relativamente pequeñas de citoplasma y gotitas lipídicas, y a veces muestran pigmento lipofuscina marrón . [15]
La médula suprarrenal se encuentra en el centro de cada glándula suprarrenal y está rodeada por la corteza suprarrenal. Las células cromafines de la médula son la principal fuente de catecolaminas , como la adrenalina y la noradrenalina, liberadas por la médula. Aproximadamente el 20 % de la noradrenalina (norepinefrina) y el 80 % de la adrenalina (epinefrina) se secretan aquí. [19]
La médula suprarrenal es impulsada por el sistema nervioso simpático a través de fibras preganglionares que se originan en la médula espinal torácica , desde las vértebras T5-T11. [20] Debido a que está inervada por fibras nerviosas preganglionares , la médula suprarrenal puede considerarse un ganglio simpático especializado . [20] Sin embargo, a diferencia de otros ganglios simpáticos, la médula suprarrenal carece de sinapsis diferenciadas y libera sus secreciones directamente en la sangre.
Las glándulas suprarrenales tienen una de las mayores tasas de suministro de sangre por gramo de tejido de cualquier órgano: hasta 60 arterias pequeñas pueden ingresar a cada glándula. [21] Por lo general, tres arterias irrigan cada glándula suprarrenal: [8]
Estos vasos sanguíneos irrigan una red de pequeñas arterias dentro de la cápsula de las glándulas suprarrenales. Delgadas hebras de la cápsula ingresan a las glándulas y llevan sangre a ellas. [8]
La sangre venosa es drenada de las glándulas por las venas suprarrenales , generalmente una para cada glándula: [8]
La vena suprarrenal medular central, en la médula suprarrenal, es un tipo de vaso sanguíneo poco común. Su estructura es diferente a la de las otras venas en que el músculo liso de su túnica media (la capa intermedia del vaso) está dispuesto en haces visibles y orientados longitudinalmente. [3]
Las glándulas suprarrenales pueden no desarrollarse en absoluto o pueden estar fusionadas en la línea media detrás de la aorta . [12] Estas están asociadas con otras anomalías congénitas , como la falta de desarrollo de los riñones o riñones fusionados. [12] La glándula puede desarrollarse con una ausencia parcial o total de la corteza, o puede desarrollarse en una ubicación inusual. [12]

La glándula suprarrenal secreta una serie de hormonas diferentes que son metabolizadas por enzimas , ya sea dentro de la glándula o en otras partes del cuerpo. Estas hormonas participan en una serie de funciones biológicas esenciales. [23]
Los corticosteroides son un grupo de hormonas esteroides producidas en la corteza de la glándula suprarrenal, de donde reciben su nombre. [24]
La glándula suprarrenal produce aldosterona , un mineralocorticoide , que es importante en la regulación del equilibrio de sal ("mineral") y el volumen sanguíneo . En los riñones, la aldosterona actúa sobre los túbulos contorneados distales y los conductos colectores aumentando la reabsorción de sodio y la excreción tanto de iones de potasio como de hidrógeno. [18] La aldosterona es responsable de la reabsorción de aproximadamente el 2% del filtrado glomerular filtrado . [27] La retención de sodio también es una respuesta del colon distal y las glándulas sudoríparas a la estimulación del receptor de aldosterona. La angiotensina II y el potasio extracelular son los dos principales reguladores de la producción de aldosterona. [19] La cantidad de sodio presente en el cuerpo afecta el volumen extracelular, que a su vez influye en la presión arterial . Por lo tanto, los efectos de la aldosterona en la retención de sodio son importantes para la regulación de la presión arterial. [28]
El cortisol es el principal glucocorticoide en los seres humanos. En las especies que no crean cortisol, este papel lo desempeña en su lugar la corticosterona . Los glucocorticoides tienen muchos efectos sobre el metabolismo . Como su nombre indica, aumentan el nivel circulante de glucosa . Esto es el resultado de un aumento en la movilización de aminoácidos a partir de las proteínas y la estimulación de la síntesis de glucosa a partir de estos aminoácidos en el hígado. Además, aumentan los niveles de ácidos grasos libres , que las células pueden utilizar como alternativa a la glucosa para obtener energía. Los glucocorticoides también tienen efectos no relacionados con la regulación de los niveles de azúcar en sangre, incluyendo la supresión del sistema inmunológico y un potente efecto antiinflamatorio . El cortisol reduce la capacidad de los osteoblastos para producir nuevo tejido óseo y disminuye la absorción de calcio en el tracto gastrointestinal . [28]
La glándula suprarrenal secreta un nivel basal de cortisol, pero también puede producir ráfagas de la hormona en respuesta a la hormona adrenocorticotrópica (ACTH) de la hipófisis anterior . El cortisol no se libera de manera uniforme durante el día: sus concentraciones en la sangre son más altas temprano en la mañana y más bajas en la noche como resultado del ritmo circadiano de secreción de ACTH. [28] La cortisona es un producto inactivo de la acción de la enzima 11β-HSD sobre el cortisol. La reacción catalizada por la 11β-HSD es reversible, lo que significa que puede convertir la cortisona administrada en cortisol, la hormona biológicamente activa. [28]

Todas las hormonas corticosteroides comparten el colesterol como precursor común. Por lo tanto, el primer paso en la esteroidogénesis es la captación o síntesis de colesterol. Las células que producen hormonas esteroides pueden adquirir colesterol a través de dos vías. La fuente principal es a través del colesterol de la dieta transportado a través de la sangre como ésteres de colesterol dentro de las lipoproteínas de baja densidad (LDL). La LDL ingresa a las células a través de la endocitosis mediada por receptores . La otra fuente de colesterol es la síntesis en el retículo endoplasmático de la célula . La síntesis puede compensar cuando los niveles de LDL son anormalmente bajos. [4] En el lisosoma , los ésteres de colesterol se convierten en colesterol libre, que luego se utiliza para la esteroidogénesis o se almacena en la célula. [29]
La parte inicial de la conversión del colesterol en hormonas esteroides involucra una serie de enzimas de la familia del citocromo P450 que se encuentran en la membrana interna de las mitocondrias . El transporte del colesterol desde la membrana externa a la interna es facilitado por la proteína reguladora aguda esteroidogénica y es el paso limitante de la velocidad de la síntesis de esteroides. [29]
Las capas de la glándula suprarrenal difieren según su función, y cada capa tiene enzimas distintas que producen diferentes hormonas a partir de un precursor común. [4] El primer paso enzimático en la producción de todas las hormonas esteroides es la escisión de la cadena lateral del colesterol, una reacción que forma pregnenolona como producto y es catalizada por la enzima P450scc , también conocida como colesterol desmolasa . Después de la producción de pregnenolona, enzimas específicas de cada capa cortical la modifican aún más. Las enzimas involucradas en este proceso incluyen tanto las P450 mitocondriales como las microsomales y las hidroxiesteroide deshidrogenasas . Por lo general, se requieren varios pasos intermedios en los que la pregnenolona se modifica varias veces para formar las hormonas funcionales. [5] Las enzimas que catalizan las reacciones en estas vías metabólicas están involucradas en varias enfermedades endocrinas. Por ejemplo, la forma más común de hiperplasia suprarrenal congénita se desarrolla como resultado de una deficiencia de 21-hidroxilasa , una enzima involucrada en un paso intermedio de la producción de cortisol. [30]
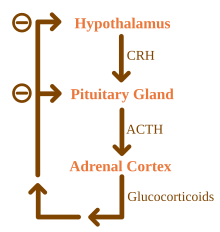
Los glucocorticoides están bajo la influencia reguladora del eje hipotálamo-hipofisario-adrenal (HHA) . La síntesis de glucocorticoides es estimulada por la hormona adrenocorticotrópica (ACTH), una hormona liberada al torrente sanguíneo por la hipófisis anterior . A su vez, la producción de ACTH es estimulada por la presencia de la hormona liberadora de corticotropina (CRH), que es liberada por las neuronas del hipotálamo . La ACTH actúa sobre las células suprarrenales primero aumentando los niveles de StAR dentro de las células, y luego de todas las enzimas esteroidogénicas P450. El eje HPA es un ejemplo de un sistema de retroalimentación negativa , en el que el propio cortisol actúa como un inhibidor directo tanto de la síntesis de CRH como de ACTH. El eje HPA también interactúa con el sistema inmunológico a través del aumento de la secreción de ACTH en presencia de ciertas moléculas de la respuesta inflamatoria . [4]
La secreción de mineralocorticoides está regulada principalmente por el sistema renina-angiotensina-aldosterona (SRAA), la concentración de potasio y, en menor medida, la concentración de ACTH. [4] Los sensores de presión arterial en el aparato yuxtaglomerular de los riñones liberan la enzima renina en la sangre, lo que inicia una cascada de reacciones que conducen a la formación de angiotensina II . Los receptores de angiotensina en las células de la zona glomerular reconocen la sustancia y, al unirse, estimulan la liberación de aldosterona . [31]
Las células de la zona reticular de las glándulas suprarrenales producen hormonas sexuales masculinas o andrógenos , de las cuales la más importante es la DHEA . En general, estas hormonas no tienen un efecto global en el cuerpo masculino, y se convierten en andrógenos más potentes como la testosterona y la DHT o en estrógenos (hormonas sexuales femeninas) en las gónadas , actuando de esta manera como intermediario metabólico . [32]
La adrenalina y la noradrenalina , conocidas principalmente en los Estados Unidos como epinefrina y norepinefrina , son catecolaminas , compuestos solubles en agua que tienen una estructura formada por un grupo catecol y un grupo amina . Las glándulas suprarrenales son responsables de la mayor parte de la adrenalina que circula en el cuerpo, pero solo de una pequeña cantidad de noradrenalina circulante. [23] Estas hormonas son liberadas por la médula suprarrenal, que contiene una densa red de vasos sanguíneos. La adrenalina y la noradrenalina actúan interactuando con los adrenorreceptores en todo el cuerpo, con efectos que incluyen un aumento de la presión arterial y la frecuencia cardíaca. [23] Las acciones de la adrenalina y la noradrenalina son responsables de la respuesta de lucha o huida , caracterizada por una aceleración de la respiración y la frecuencia cardíaca, un aumento de la presión arterial y la constricción de los vasos sanguíneos en muchas partes del cuerpo. [33]
Las catecolaminas se producen en las células cromafines de la médula de la glándula suprarrenal, a partir de la tirosina , un aminoácido no esencial derivado de los alimentos o producido a partir de la fenilalanina en el hígado. La enzima tirosina hidroxilasa convierte la tirosina en L-DOPA en el primer paso de la síntesis de catecolaminas. Luego, la L-DOPA se convierte en dopamina antes de que pueda convertirse en noradrenalina. En el citosol , la noradrenalina se convierte en epinefrina por la enzima feniletanolamina N-metiltransferasa (PNMT) y se almacena en gránulos. Los glucocorticoides producidos en la corteza suprarrenal estimulan la síntesis de catecolaminas al aumentar los niveles de tirosina hidroxilasa y PNMT. [4] [13]
La liberación de catecolaminas es estimulada por la activación del sistema nervioso simpático . Los nervios esplácnicos del sistema nervioso simpático inervan la médula de la glándula suprarrenal. Cuando se activan, provocan la liberación de catecolaminas de los gránulos de almacenamiento al estimular la apertura de los canales de calcio en la membrana celular. [34]
El genoma humano incluye aproximadamente 20.000 genes codificadores de proteínas y el 70% de estos genes se expresan en las glándulas suprarrenales adultas normales. [35] [36] Solo unos 250 genes se expresan de manera más específica en las glándulas suprarrenales en comparación con otros órganos y tejidos. Los genes específicos de las glándulas suprarrenales con el mayor nivel de expresión incluyen miembros de la superfamilia de enzimas del citocromo P450 . Las proteínas correspondientes se expresan en los diferentes compartimentos de la glándula suprarrenal, como CYP11A1 , HSD3B2 y FDX1 involucradas en la síntesis de hormonas esteroides y expresadas en capas de células corticales, y PNMT y DBH involucradas en la síntesis de noradrenalina y adrenalina y expresadas en la médula. [37]
Las glándulas suprarrenales están compuestas por dos tipos heterogéneos de tejido. En el centro se encuentra la médula suprarrenal , que produce adrenalina y noradrenalina y las libera al torrente sanguíneo, como parte del sistema nervioso simpático . Rodeando la médula se encuentra la corteza , que produce una variedad de hormonas esteroides . Estos tejidos provienen de diferentes precursores embriológicos y tienen distintas vías de desarrollo prenatal . La corteza de la glándula suprarrenal se deriva del mesodermo , mientras que la médula se deriva de la cresta neural , que es de origen ectodérmico . [12]
Las glándulas suprarrenales de un recién nacido son mucho más grandes en proporción al tamaño corporal que las de un adulto. [38] Por ejemplo, a los tres meses de edad, las glándulas tienen cuatro veces el tamaño de los riñones. El tamaño de las glándulas disminuye relativamente después del nacimiento, principalmente debido a la contracción de la corteza. La corteza, que desaparece casi por completo a la edad de 1 año, se desarrolla de nuevo a los 4 o 5 años. Las glándulas pesan aproximadamente1 gramo al nacer [12] y desarrollarse hasta un peso adulto de aproximadamente4 gramos cada uno. [28] En un feto, las glándulas se detectan por primera vez después de la sexta semana de desarrollo. [12]
El tejido de la corteza suprarrenal se deriva del mesodermo intermedio . Aparece por primera vez 33 días después de la fertilización , muestra capacidades de producción de hormonas esteroides en la octava semana y experimenta un rápido crecimiento durante el primer trimestre del embarazo. La corteza suprarrenal fetal es diferente de su contraparte adulta, ya que se compone de dos zonas distintas: la zona "fetal" interna, que lleva la mayor parte de la actividad productora de hormonas, y la zona "definitiva" externa, que está en una fase proliferativa . La zona fetal produce grandes cantidades de andrógenos suprarrenales (hormonas sexuales masculinas) que son utilizados por la placenta para la biosíntesis de estrógenos . [39] El desarrollo cortical de la glándula suprarrenal está regulado principalmente por ACTH , una hormona producida por la glándula pituitaria que estimula la síntesis de cortisol . [40] Durante la mitad de la gestación, la zona fetal ocupa la mayor parte del volumen cortical y produce 100–200 mg/día de DHEA-S , un andrógeno y precursor tanto de andrógenos como de estrógenos (hormonas sexuales femeninas). [41] Las hormonas suprarrenales, especialmente los glucocorticoides como el cortisol, son esenciales para el desarrollo prenatal de los órganos, en particular para la maduración de los pulmones . La glándula suprarrenal disminuye de tamaño después del nacimiento debido a la rápida desaparición de la zona fetal, con una disminución correspondiente en la secreción de andrógenos. [39]
Durante la primera infancia, la síntesis y secreción de andrógenos se mantiene baja, pero varios años antes de la pubertad (entre los 6 y los 8 años de edad) se producen cambios tanto en los aspectos anatómicos como funcionales de la producción cortical de andrógenos que conducen a una mayor secreción de los esteroides DHEA y DHEA-S . Estos cambios son parte de un proceso llamado adrenarquia , que solo se ha descrito en humanos y algunos otros primates. La adrenarquia es independiente de la ACTH o las gonadotropinas y se correlaciona con un engrosamiento progresivo de la capa de la zona reticular de la corteza. Funcionalmente, la adrenarquia proporciona una fuente de andrógenos para el desarrollo del vello axilar y púbico antes del comienzo de la pubertad. [42] [43]
La médula suprarrenal se deriva de las células de la cresta neural , que provienen de la capa del ectodermo del embrión . Estas células migran desde su posición inicial y se agregan en las proximidades de la aorta dorsal , un vaso sanguíneo primitivo, que activa la diferenciación de estas células a través de la liberación de proteínas conocidas como BMPs . Estas células luego experimentan una segunda migración desde la aorta dorsal para formar la médula suprarrenal y otros órganos del sistema nervioso simpático . [44] Las células de la médula suprarrenal se denominan células cromafines porque contienen gránulos que se tiñen con sales de cromo , una característica no presente en todos los órganos simpáticos. Alguna vez se pensó que los glucocorticoides producidos en la corteza suprarrenal eran responsables de la diferenciación de las células cromafines. Investigaciones más recientes sugieren que la BMP-4 secretada en el tejido suprarrenal es la principal responsable de esto, y que los glucocorticoides solo juegan un papel en el desarrollo posterior de las células. [45]
El funcionamiento normal de la glándula suprarrenal puede verse afectado por afecciones como infecciones, tumores, trastornos genéticos y enfermedades autoinmunes , o como efecto secundario de un tratamiento médico. Estos trastornos afectan a la glándula ya sea directamente (como en el caso de las infecciones o enfermedades autoinmunes) o como resultado de la desregulación de la producción hormonal (como en algunos tipos de síndrome de Cushing ), lo que provoca un exceso o una insuficiencia de hormonas suprarrenales y los síntomas relacionados.
El síndrome de Cushing es la manifestación de un exceso de glucocorticoides. Puede ser el resultado de un tratamiento prolongado con glucocorticoides o estar causado por una enfermedad subyacente que produce alteraciones en el eje HPA o en la producción de cortisol. Las causas pueden clasificarse además en ACTH -dependientes o ACTH-independientes. La causa más común del síndrome de Cushing endógeno es un adenoma hipofisario que causa una producción excesiva de ACTH. La enfermedad produce una amplia variedad de signos y síntomas que incluyen obesidad, diabetes, aumento de la presión arterial, vello corporal excesivo ( hirsutismo ), osteoporosis , depresión y, lo más distintivo, estrías en la piel, causadas por su adelgazamiento progresivo. [4] [6]
Cuando la zona glomerular produce un exceso de aldosterona , el resultado es el aldosteronismo primario . Las causas de esta afección son la hiperplasia bilateral (crecimiento excesivo de tejido) de las glándulas o los adenomas productores de aldosterona (una afección llamada síndrome de Conn ). El aldosteronismo primario produce hipertensión y desequilibrio electrolítico , lo que aumenta la retención de sodio y la depleción de potasio . [6]
La insuficiencia suprarrenal (la deficiencia de glucocorticoides ) se presenta en aproximadamente 5 de cada 10.000 personas en la población general. [6] Las enfermedades clasificadas como insuficiencia suprarrenal primaria (incluida la enfermedad de Addison y las causas genéticas) afectan directamente a la corteza suprarrenal. Si un problema que afecta al eje hipotálamo-hipofisario-suprarrenal surge fuera de la glándula, se trata de una insuficiencia suprarrenal secundaria .

La enfermedad de Addison se refiere al hipoadrenalismo primario, que es una deficiencia en la producción de glucocorticoides y mineralocorticoides por la glándula suprarrenal. En el mundo occidental, la enfermedad de Addison es más comúnmente una afección autoinmune , en la que el cuerpo produce anticuerpos contra las células de la corteza suprarrenal. En todo el mundo, la enfermedad es causada con mayor frecuencia por una infección, especialmente por tuberculosis . Una característica distintiva de la enfermedad de Addison es la hiperpigmentación de la piel, que se presenta con otros síntomas inespecíficos como la fatiga. [4]
Una complicación que se observa en la enfermedad de Addison no tratada y otros tipos de insuficiencia suprarrenal primaria es la crisis suprarrenal , una emergencia médica en la que los niveles bajos de glucocorticoides y mineralocorticoides resultan en un shock hipovolémico y síntomas como vómitos y fiebre. Una crisis suprarrenal puede conducir progresivamente al estupor y al coma . [4] El manejo de las crisis suprarrenales incluye la aplicación de inyecciones de hidrocortisona . [46]
En la insuficiencia suprarrenal secundaria, una disfunción del eje hipotálamo-hipofisario-suprarrenal conduce a una disminución de la estimulación de la corteza suprarrenal. Aparte de la supresión del eje por la terapia con glucocorticoides, la causa más común de insuficiencia suprarrenal secundaria son los tumores que afectan la producción de hormona adrenocorticotrópica (ACTH) por la glándula pituitaria . [6] Este tipo de insuficiencia suprarrenal generalmente no afecta la producción de mineralocorticoides , que están bajo la regulación del sistema renina-angiotensina . [4]
La hiperplasia suprarrenal congénita es una familia de enfermedades congénitas en las que las mutaciones de las enzimas que producen hormonas esteroides dan lugar a una deficiencia de glucocorticoides y al mal funcionamiento del circuito de retroalimentación negativa del eje HPA . En el eje HPA, el cortisol (un glucocorticoide) inhibe la liberación de CRH y ACTH , hormonas que a su vez estimulan la síntesis de corticosteroides. Como el cortisol no se puede sintetizar, estas hormonas se liberan en grandes cantidades y estimulan la producción de otros esteroides suprarrenales en su lugar. La forma más común de hiperplasia suprarrenal congénita se debe a la deficiencia de 21-hidroxilasa . La 21-hidroxilasa es necesaria para la producción tanto de mineralocorticoides como de glucocorticoides, pero no de andrógenos . Por lo tanto, la estimulación de la corteza suprarrenal con ACTH induce la liberación de cantidades excesivas de andrógenos suprarrenales , lo que puede conducir al desarrollo de genitales ambiguos y características sexuales secundarias . [30]

Los tumores suprarrenales se encuentran comúnmente como incidentalomas , tumores asintomáticos inesperados que se encuentran durante las imágenes médicas . Se observan en alrededor del 3,4 % de las tomografías computarizadas [7] y en la mayoría de los casos son adenomas benignos [48] . Los carcinomas suprarrenales son muy raros, con una incidencia de 1 caso por millón por año [4] .
Los feocromocitomas son tumores de la médula suprarrenal que surgen de las células cromafines . Pueden producir una variedad de síntomas inespecíficos, que incluyen dolores de cabeza, sudoración, ansiedad y palpitaciones . Los signos comunes incluyen hipertensión y taquicardia . La cirugía, especialmente la laparoscopia suprarrenal , es el tratamiento más común para los feocromocitomas pequeños. [49]
A Bartolomeo Eustachi , un anatomista italiano, se le atribuye la primera descripción de las glándulas suprarrenales en 1563-4. [50] [51] [52] Sin embargo, estas publicaciones eran parte de la biblioteca papal y no recibieron atención pública, que fue recibida por primera vez con las ilustraciones de Caspar Bartholin el Viejo en 1611. [51]
Las glándulas suprarrenales reciben su nombre por su ubicación en relación con los riñones. El término "suprarrenal" proviene del latín ad , "cerca", y ren , "riñón". [53] De manera similar, "suprarrenal", como lo denominó Jean Riolan el Joven en 1629, se deriva del latín supra , "encima", y ren , "riñón". La naturaleza suprarrenal de las glándulas no fue realmente aceptada hasta el siglo XIX, cuando los anatomistas aclararon la naturaleza sin conductos de las glándulas y su probable función secretora; antes de esto, hubo cierto debate sobre si las glándulas eran de hecho suprarrenales o parte del riñón. [51]
Uno de los trabajos más reconocidos sobre las glándulas suprarrenales llegó en 1855 con la publicación de On the Constitutional and Local Effects of Disease of the Suprarenal Capsule , del médico inglés Thomas Addison . En su monografía, Addison describió lo que el médico francés George Trousseau llamaría más tarde enfermedad de Addison , un epónimo que todavía hoy se utiliza para una condición de insuficiencia suprarrenal y sus manifestaciones clínicas relacionadas. [54] En 1894, los fisiólogos ingleses George Oliver y Edward Schafer estudiaron la acción de los extractos suprarrenales y observaron sus efectos presores . En las décadas siguientes, varios médicos experimentaron con extractos de la corteza suprarrenal para tratar la enfermedad de Addison. [50] Edward Calvin Kendall , Philip Hench y Tadeusz Reichstein fueron galardonados con el Premio Nobel de Fisiología o Medicina de 1950 por sus descubrimientos sobre la estructura y los efectos de las hormonas suprarrenales. [55]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )