La toxicidad del oxígeno es una condición que resulta de los efectos nocivos de respirar oxígeno molecular ( O
2) a presiones parciales elevadas . Los casos graves pueden provocar daño celular y muerte, con efectos que se observan con mayor frecuencia en el sistema nervioso central, los pulmones y los ojos. Históricamente, la afección del sistema nervioso central se denominaba efecto Paul Bert y la afección pulmonar efecto Lorrain Smith , en honor a los investigadores que fueron pioneros en los descubrimientos y descripciones a fines del siglo XIX. La toxicidad del oxígeno es una preocupación para los buceadores , aquellos que reciben altas concentraciones de oxígeno suplementario y aquellos que se someten a terapia de oxígeno hiperbárico .
El resultado de respirar presiones parciales de oxígeno elevadas es la hiperoxia , un exceso de oxígeno en los tejidos corporales. El cuerpo se ve afectado de diferentes maneras según el tipo de exposición. La toxicidad del sistema nervioso central es causada por una exposición breve a presiones parciales de oxígeno elevadas a una presión superior a la atmosférica. La toxicidad pulmonar y ocular es el resultado de una exposición más prolongada a niveles de oxígeno elevados a una presión normal. Los síntomas pueden incluir desorientación, problemas respiratorios y cambios en la visión, como miopía . La exposición prolongada a presiones parciales de oxígeno superiores a lo normal, o exposiciones más breves a presiones parciales muy elevadas, pueden causar daño oxidativo a las membranas celulares , colapso de los alvéolos en los pulmones, desprendimiento de retina y convulsiones . La toxicidad del oxígeno se controla reduciendo la exposición a niveles elevados de oxígeno. Los estudios muestran que, a largo plazo, es posible una recuperación sólida de la mayoría de los tipos de toxicidad del oxígeno.
Existen protocolos para evitar los efectos de la hiperoxia en los ámbitos en los que se respira oxígeno a presiones parciales superiores a las normales, como el buceo submarino con gases respiratorios comprimidos , la medicina hiperbárica, la atención neonatal y los vuelos espaciales tripulados . Estos protocolos han dado lugar a una rareza cada vez mayor de las convulsiones debidas a la toxicidad del oxígeno, y los daños pulmonares y oculares se limitan en gran medida a los problemas relacionados con el tratamiento de los bebés prematuros.
En los últimos años, el oxígeno se ha vuelto disponible para uso recreativo en bares de oxígeno . La Administración de Alimentos y Medicamentos de los Estados Unidos ha advertido a quienes padecen enfermedades como enfermedades cardíacas o pulmonares que no utilicen bares de oxígeno. Los buceadores utilizan gases respirables que contienen hasta un 100 % de oxígeno y deben tener una formación específica para utilizar dichos gases.
Los efectos de la toxicidad del oxígeno pueden clasificarse según los órganos afectados, produciendo tres formas principales: [2] [3] [4]
La toxicidad del oxígeno en el sistema nervioso central puede causar convulsiones, breves períodos de rigidez seguidos de convulsiones y pérdida de conocimiento, y es motivo de preocupación para los buceadores que se encuentran con presiones superiores a la atmosférica. La toxicidad del oxígeno pulmonar provoca daños en los pulmones, lo que provoca dolor y dificultad para respirar. [2] El daño oxidativo en el ojo puede provocar miopía o desprendimiento parcial de la retina . Es más probable que se produzcan daños pulmonares y oculares cuando se administra oxígeno suplementario como parte de un tratamiento, en particular a los recién nacidos, pero también son motivo de preocupación durante la terapia con oxígeno hiperbárico. [5] [6]
El daño oxidativo puede ocurrir en cualquier célula del cuerpo, pero los efectos en los tres órganos más susceptibles serán la principal preocupación. También puede estar implicado en el daño a los glóbulos rojos ( hemólisis ), [7] [8] el hígado , [9] el corazón , [10] las glándulas endocrinas ( glándulas suprarrenales , gónadas y tiroides ), [11] [12] [13] o los riñones , [14] y el daño general a las células . [2] [15]
En circunstancias excepcionales, pueden observarse efectos en otros tejidos: se sospecha que durante los vuelos espaciales, las altas concentraciones de oxígeno pueden contribuir al daño óseo. [16] La hiperoxia también puede causar indirectamente narcosis por dióxido de carbono en pacientes con enfermedades pulmonares como la enfermedad pulmonar obstructiva crónica o con depresión respiratoria central. [16] La hiperventilación del aire atmosférico a presiones atmosféricas no causa toxicidad por oxígeno, porque el aire a nivel del mar tiene una presión parcial de oxígeno de 0,21 bar (21 kPa), mientras que la toxicidad no ocurre por debajo de 0,3 bar (30 kPa). [17]
La toxicidad del oxígeno del sistema nervioso central se manifiesta como síntomas tales como cambios visuales (especialmente visión de túnel ), zumbido en los oídos ( tinnitus ), náuseas , espasmos (especialmente en la cara), cambios de comportamiento (irritabilidad, ansiedad , confusión) y mareos . Esto puede ser seguido por una convulsión tónico-clónica que consta de dos fases: ocurre una contracción muscular intensa durante varios segundos (fase tónica); seguida de espasmos rápidos de relajación y contracción muscular alternada que producen sacudidas convulsivas ( fase clónica ). La convulsión termina con un período de inconsciencia (el estado postictal ). [18] [19] El inicio de la convulsión depende de la presión parcial de oxígeno en el gas respirable y la duración de la exposición. Sin embargo, el tiempo de exposición antes del inicio es impredecible, ya que las pruebas han demostrado una amplia variación, tanto entre individuos como en el mismo individuo de un día para otro. [18] [20] [21] Además, muchos factores externos, como la inmersión bajo el agua, la exposición al frío y el ejercicio disminuirán el tiempo hasta la aparición de los síntomas del sistema nervioso central. [1] La disminución de la tolerancia está estrechamente relacionada con la retención de dióxido de carbono . [22] [23] [24] Otros factores, como la oscuridad y la cafeína , aumentan la tolerancia en animales de prueba, pero estos efectos no se han demostrado en humanos. [25] [26]
La exposición a presiones de oxígeno superiores a 0,5 bar, como durante el buceo, la prerespiración de oxígeno antes del vuelo o la terapia hiperbárica, se asocia con la aparición de síntomas de toxicidad pulmonar. [27] Los síntomas de toxicidad pulmonar son el resultado de una inflamación que comienza en las vías respiratorias que conducen a los pulmones y luego se propaga a los pulmones ( árbol traqueobronquial ). Los síntomas aparecen en la región superior del tórax ( regiones subesternal y carinal ). [28] [29] [30] Esto comienza como un cosquilleo leve al inhalar y progresa a tos frecuente. [28] Si continúa la respiración a presiones parciales de oxígeno aumentadas, los sujetos experimentan un ardor leve al inhalar junto con tos incontrolable y dificultad para respirar ocasional ( disnea ). [28] Los hallazgos físicos relacionados con la toxicidad pulmonar han incluido sonidos burbujeantes escuchados a través de un estetoscopio ( estertores burbujeantes ), fiebre y aumento del flujo sanguíneo al revestimiento de la nariz ( hiperemia de la mucosa nasal ). [30] Inicialmente, hay una fase exudativa que resulta en edema pulmonar . Se puede ver un aumento en el ancho del espacio intersticial en el examen histológico. [27] Las radiografías de los pulmones muestran pocos cambios a corto plazo, pero la exposición prolongada conduce a un aumento de la sombra difusa en ambos pulmones. [28] Las mediciones de la función pulmonar se reducen, como lo indica una reducción en la cantidad de aire que los pulmones pueden contener ( capacidad vital ) y cambios en la función espiratoria y la elasticidad pulmonar. [30] [31] La capacidad de difusión pulmonar disminuye, lo que finalmente conduce a hipoxemia. [27] Las pruebas en animales han indicado una variación en la tolerancia similar a la encontrada en la toxicidad del sistema nervioso central, así como variaciones significativas entre especies. Cuando la exposición al oxígeno por encima de 0,5 bar (50 kPa) es intermitente, permite que los pulmones se recuperen y retrasa la aparición de la toxicidad. [32] Una progresión similar es común a todas las especies de mamíferos. [27] Si la muerte por hipoxemia no se ha producido tras la exposición durante varios días, se produce una fase proliferativa, en la que se produce un engrosamiento crónico de la membrana alveolar y una disminución de la capacidad de difusión pulmonar. Estos cambios son en su mayoría reversibles al volver a la normoxia, pero no se conoce el tiempo necesario para la recuperación completa. [27]
En los bebés prematuros, los signos de daño en el ojo ( retinopatía del prematuro o ROP) se observan a través de un oftalmoscopio como una demarcación entre las regiones vascularizadas y no vascularizadas de la retina de un bebé. El grado de esta demarcación se utiliza para designar cuatro etapas: (I) la demarcación es una línea; (II) la demarcación se convierte en una cresta; (III) el crecimiento de nuevos vasos sanguíneos ocurre alrededor de la cresta; (IV) la retina comienza a desprenderse de la pared interna del ojo ( coroides ). [5]
La toxicidad por oxígeno es causada por hiperoxia, exposición al oxígeno a presiones parciales mayores que las que el cuerpo está expuesto normalmente. Esto ocurre en tres entornos principales: buceo submarino, [33] terapia con oxígeno hiperbárico, [34] y el suministro de oxígeno suplementario, en cuidados críticos, [35] y para el tratamiento a largo plazo de trastornos crónicos, y particularmente en bebés prematuros. [36] En cada caso, los factores de riesgo son marcadamente diferentes. [33] [34] [36]
En condiciones de presión ambiental normal o reducida, los efectos de la hiperoxia se limitan inicialmente a los pulmones, que están directamente expuestos, pero después de una exposición prolongada o a presiones hiperbáricas, otros órganos pueden estar en riesgo. A presiones parciales normales de oxígeno inhalado, la mayor parte del oxígeno transportado en la sangre es transportado por la hemoglobina, pero la cantidad de oxígeno disuelto aumentará a presiones parciales de oxígeno arterial superiores a 100 milímetros de mercurio (0,13 bar), cuando la saturación de oxihemoglobina es casi completa. A concentraciones más altas, los efectos de la hiperoxia se extienden más a los tejidos corporales más allá de los pulmones. [37]
Las exposiciones, de minutos a unas pocas horas, a presiones parciales de oxígeno superiores a 1,6 bares (160 kPa ), aproximadamente ocho veces la presión parcial atmosférica normal, suelen estar asociadas a toxicidad por oxígeno del sistema nervioso central y es más probable que se produzcan entre pacientes sometidos a terapia de oxígeno hiperbárico y buceadores. Dado que la presión atmosférica a nivel del mar es de aproximadamente 1 bar (100 kPa), la toxicidad del sistema nervioso central solo puede producirse en condiciones hiperbáricas , donde la presión ambiental es superior a la normal. [34] [38] Los buceadores que respiran aire a profundidades superiores a los 60 m (200 pies) se enfrentan a un riesgo cada vez mayor de sufrir una "convulsión" por toxicidad por oxígeno. Los buceadores que respiran una mezcla de gases enriquecida con oxígeno, como el nitrox , aumentan de forma similar el riesgo de sufrir una convulsión a profundidades menores, si descienden por debajo de la profundidad operativa máxima aceptada para la mezcla. [39] La toxicidad del SNC se agrava por una presión parcial alta de dióxido de carbono, estrés, fatiga y frío, todos ellos mucho más probables en el buceo que en la terapia hiperbárica. [40]

Los pulmones y el resto del tracto respiratorio están expuestos a la mayor concentración de oxígeno del cuerpo humano y, por lo tanto, son los primeros órganos en mostrar toxicidad. La toxicidad pulmonar ocurre solo con la exposición a presiones parciales de oxígeno mayores de 0,5 bar (50 kPa), que corresponden a una fracción de oxígeno del 50% a presión atmosférica normal. Los primeros signos de toxicidad pulmonar comienzan con evidencia de traqueobronquitis, o inflamación de las vías respiratorias superiores, después de un período asintomático de entre 4 y 22 horas con más del 95% de oxígeno, [41] y algunos estudios sugieren que los síntomas generalmente comienzan después de aproximadamente 14 horas con este nivel de oxígeno. [42]
A presiones parciales de oxígeno de 2 a 3 bares (200 a 300 kPa) (oxígeno al 100 % a 2 a 3 veces la presión atmosférica), estos síntomas pueden comenzar tan pronto como 3 horas después de la exposición al oxígeno. [41] Los experimentos en ratas que respiraban oxígeno a presiones entre 1 y 3 bares (100 y 300 kPa) sugieren que las manifestaciones pulmonares de toxicidad por oxígeno pueden no ser las mismas para condiciones normobáricas que para condiciones hiperbáricas . [43] La evidencia de disminución de la función pulmonar medida por pruebas de función pulmonar puede ocurrir tan pronto como 24 horas de exposición continua al 100 % de oxígeno, [42] con evidencia de daño alveolar difuso y la aparición del síndrome de dificultad respiratoria aguda que generalmente ocurre después de 48 horas con oxígeno al 100 %. [41] Respirar oxígeno al 100% también conduce eventualmente al colapso de los alvéolos ( atelectasia ), mientras que, a la misma presión parcial de oxígeno, la presencia de presiones parciales significativas de gases inertes, típicamente nitrógeno, evitará este efecto. [44]
Se sabe que los recién nacidos prematuros tienen un mayor riesgo de displasia broncopulmonar con la exposición prolongada a altas concentraciones de oxígeno. [45] Otros grupos con mayor riesgo de toxicidad por oxígeno son los pacientes con ventilación mecánica con exposición a niveles de oxígeno superiores al 50% y los pacientes expuestos a sustancias químicas que aumentan el riesgo de toxicidad por oxígeno, como el agente quimioterapéutico bleomicina . [42] Por lo tanto, las directrices actuales para pacientes con ventilación mecánica en cuidados intensivos recomiendan mantener la concentración de oxígeno por debajo del 60%. [41] Del mismo modo, los buceadores que se someten a un tratamiento de la enfermedad por descompresión tienen un mayor riesgo de toxicidad por oxígeno, ya que el tratamiento implica la exposición a largos períodos de respiración de oxígeno en condiciones hiperbáricas, además de cualquier exposición al oxígeno durante la inmersión. [34]
La exposición prolongada a fracciones elevadas de oxígeno inspirado causa daño a la retina . [46] [47] [48] El daño al ojo en desarrollo de los bebés expuestos a una fracción elevada de oxígeno a presión normal tiene un mecanismo y efecto diferentes del daño ocular experimentado por los buceadores adultos en condiciones hiperbáricas. [49] [50] La hiperoxia puede ser un factor que contribuye al trastorno llamado fibroplasia retrolental o retinopatía del prematuro (ROP) en los bebés. [49] [51] En los bebés prematuros, la retina a menudo no está completamente vascularizada. La retinopatía del prematuro ocurre cuando el desarrollo de la vasculatura retiniana se detiene y luego procede de manera anormal. Asociado con el crecimiento de estos nuevos vasos hay tejido fibroso (tejido cicatricial) que puede contraerse para causar desprendimiento de retina. La exposición al oxígeno suplementario, aunque es un factor de riesgo , no es el principal factor de riesgo para el desarrollo de esta enfermedad. Restringir el uso de oxígeno suplementario no necesariamente reduce la tasa de retinopatía del prematuro y puede aumentar el riesgo de complicaciones sistémicas relacionadas con la hipoxia. [49]
Se ha producido miopía hiperóxica en buceadores con rebreather de oxígeno de circuito cerrado con exposiciones prolongadas. [50] [52] [53] También ocurre con frecuencia en aquellos sometidos a terapia de oxígeno hiperbárico repetida. [47] [54] Esto se debe a un aumento en el poder refractivo del cristalino , ya que las lecturas de longitud axial y queratometría no revelan una base corneal o de longitud para un cambio miópico. [54] [55] Por lo general, es reversible con el tiempo. [47] [54]
Un posible efecto secundario de la terapia con oxígeno hiperbárico es el desarrollo inicial o posterior de cataratas , que son un aumento de la opacidad del cristalino del ojo que reduce la agudeza visual y puede eventualmente resultar en ceguera. Este es un evento raro, asociado con la exposición de por vida a una concentración elevada de oxígeno, y puede estar subnotificado ya que se desarrolla muy lentamente. La causa no se entiende completamente, pero la evidencia sugiere que los niveles elevados de oxígeno pueden causar un deterioro acelerado del humor vítreo debido a la degradación de los cristalinos del cristalino por reticulación, formando agregados capaces de dispersar la luz. Esto puede ser un desarrollo del estado final del cambio miope observado más comúnmente asociado con el tratamiento hiperbárico. [6]

La base bioquímica de la toxicidad del oxígeno es la reducción parcial del oxígeno por uno o dos electrones para formar especies reactivas de oxígeno, [56] que son subproductos naturales del metabolismo normal del oxígeno y tienen papeles importantes en la señalización celular . [57] Una especie producida por el cuerpo, el anión superóxido ( O−
2), [58] posiblemente esté involucrado en la adquisición de hierro. [59] Concentraciones de oxígeno más altas de lo normal conducen a mayores niveles de especies reactivas de oxígeno. [60] El oxígeno es necesario para el metabolismo celular y la sangre lo suministra a todas las partes del cuerpo. Cuando se respira oxígeno a altas presiones parciales, una condición hiperóxica se propagará rápidamente, siendo los tejidos más vascularizados los más vulnerables. Durante épocas de estrés ambiental, los niveles de especies reactivas de oxígeno pueden aumentar drásticamente, lo que puede dañar las estructuras celulares y producir estrés oxidativo . [21] [61]
Aunque todavía no se comprenden del todo todos los mecanismos de reacción de estas especies en el organismo, [62] uno de los productos más reactivos del estrés oxidativo es el radical hidroxilo ( ·OH ), que puede iniciar una reacción en cadena dañina de peroxidación lipídica en los lípidos insaturados dentro de las membranas celulares . [63] Las altas concentraciones de oxígeno también aumentan la formación de otros radicales libres , como el óxido nítrico , el peroxinitrito y el trioxidano , que dañan el ADN y otras biomoléculas. [21] [64] Aunque el cuerpo tiene muchos sistemas antioxidantes como el glutatión que protegen contra el estrés oxidativo, estos sistemas acaban por verse abrumados a concentraciones muy altas de oxígeno libre, y la tasa de daño celular supera la capacidad de los sistemas que lo previenen o lo reparan. [65] [66] [67] Entonces se produce daño celular y muerte celular. [68]
El diagnóstico de toxicidad por oxígeno en el sistema nervioso central en buceadores antes de una convulsión es difícil, ya que los síntomas de alteración visual, problemas de oído, mareos, confusión y náuseas pueden deberse a muchos factores comunes al entorno submarino, como narcosis , congestión y frío. Sin embargo, estos síntomas pueden ser útiles para diagnosticar las primeras etapas de toxicidad por oxígeno en pacientes sometidos a terapia de oxígeno hiperbárico. En cualquier caso, a menos que haya antecedentes de epilepsia o las pruebas indiquen hipoglucemia , una convulsión que se produzca en el entorno de respirar oxígeno a presiones parciales superiores a 1,4 bar (140 kPa) sugiere un diagnóstico de toxicidad por oxígeno. [69]
El diagnóstico de displasia broncopulmonar en recién nacidos con dificultades respiratorias es difícil durante las primeras semanas. Sin embargo, si la respiración del bebé no mejora durante este tiempo, se pueden utilizar análisis de sangre y radiografías para confirmar la displasia broncopulmonar. Además, un ecocardiograma puede ayudar a descartar otras posibles causas, como defectos cardíacos congénitos o hipertensión arterial pulmonar . [70]
El diagnóstico de retinopatía del prematuro en los lactantes suele ser sugerido por el contexto clínico. La prematuridad, el bajo peso al nacer y los antecedentes de exposición al oxígeno son los principales indicadores, mientras que no se ha demostrado que los factores hereditarios produzcan un patrón. [71]
El diagnóstico clínico se puede confirmar con los niveles de oxígeno arterial. [40] Hay otras afecciones que pueden confundirse con la toxicidad del oxígeno, entre ellas: [40]

La prevención de la toxicidad del oxígeno depende totalmente del entorno. Tanto bajo el agua como en el espacio, las precauciones adecuadas pueden eliminar los efectos más perniciosos. Los bebés prematuros suelen necesitar oxígeno suplementario para tratar las complicaciones del parto prematuro. En este caso, la prevención de la displasia broncopulmonar y la retinopatía del prematuro debe llevarse a cabo sin comprometer un suministro de oxígeno adecuado para preservar la vida del bebé. [72]
La toxicidad del oxígeno es un peligro catastrófico en el buceo , porque una convulsión resulta en un alto riesgo de muerte por ahogamiento. [39] [73] La convulsión puede ocurrir repentinamente y sin síntomas de advertencia. [19] Los efectos son convulsiones repentinas e inconsciencia, durante las cuales las víctimas pueden perder su regulador y ahogarse. [74] [75] Una de las ventajas de una máscara de buceo de cara completa es la prevención de la pérdida del regulador en caso de una convulsión. Las correas de retención de la boquilla son una alternativa relativamente económica con una función similar pero menos efectiva. [73] Como existe un mayor riesgo de toxicidad por oxígeno del sistema nervioso central en inmersiones profundas, inmersiones largas e inmersiones donde se utilizan gases respirables ricos en oxígeno, a los buceadores se les enseña a calcular una profundidad operativa máxima para gases respirables ricos en oxígeno , y los cilindros que contienen tales mezclas deben estar claramente marcados con esa profundidad. [24] [76]
El riesgo de convulsiones parece ser una función de la dosis, una combinación acumulativa de presión parcial y duración. No se ha establecido el umbral de presión parcial de oxígeno por debajo del cual nunca se producen convulsiones, y puede depender de muchas variables, algunas de ellas personales. El riesgo para una persona específica puede variar considerablemente según la sensibilidad individual, el nivel de ejercicio y la retención de dióxido de carbono, que se ve influida por el trabajo respiratorio. [73]
En algunos cursos de formación de buceadores para modalidades de buceo en las que la exposición puede alcanzar niveles de riesgo significativo, se enseña a los buceadores a planificar y controlar lo que se denomina el "reloj de oxígeno" de sus inmersiones. [76] Se trata de un despertador teórico que funciona más rápidamente a mayor presión de oxígeno y está configurado para activarse en el límite máximo de exposición única recomendado en el Manual de buceo de la Administración Nacional Oceánica y Atmosférica . [24] [76] Para las siguientes presiones parciales de oxígeno, los límites son: 45 minutos a 1,6 bar (160 kPa), 120 minutos a 1,5 bar (150 kPa), 150 minutos a 1,4 bar (140 kPa), 180 minutos a 1,3 bar (130 kPa) y 210 minutos a 1,2 bar (120 kPa), pero es imposible predecir con fiabilidad si se producirán síntomas de toxicidad o cuándo. [77] [78] Muchos ordenadores de buceo con capacidad para nitrox calculan una carga de oxígeno y pueden realizar un seguimiento de ella a lo largo de varias inmersiones. El objetivo es evitar que se active la alarma reduciendo la presión parcial de oxígeno en el gas respirable o reduciendo el tiempo que se pasa respirando un gas con una presión parcial de oxígeno mayor. A medida que la presión parcial de oxígeno aumenta con la fracción de oxígeno en el gas respirable y la profundidad de la inmersión, el buceador obtiene más tiempo en el reloj de oxígeno buceando a una profundidad menor, respirando un gas menos rico en oxígeno o acortando la duración de la exposición a gases ricos en oxígeno. [79] [80] Esta función la proporcionan algunos ordenadores de descompresión para buceo técnico y hardware de control y monitorización de rebreathers. [81] [82]
Bucear por debajo de los 56 m (184 pies) con aire expondría al buceador a un peligro creciente de toxicidad por oxígeno, ya que la presión parcial de oxígeno excede los 1,4 bares (140 kPa), por lo que se debe utilizar una mezcla de gases que contenga menos del 21 % de oxígeno (denominada mezcla hipóxica). Aumentar la proporción de nitrógeno no es viable, ya que produciría una mezcla fuertemente narcótica . Sin embargo, el helio no es narcótico y se puede mezclar una mezcla utilizable reemplazando completamente el nitrógeno con helio (la mezcla resultante se llama heliox ), o reemplazando parte del nitrógeno con helio, produciendo un trimix . [83]
La toxicidad pulmonar por oxígeno es un evento totalmente evitable durante el buceo. La duración limitada y la naturaleza intermitente de la mayoría de las inmersiones hacen que esta sea una complicación relativamente rara (e incluso reversible) para los buceadores. [84] Las pautas establecidas permiten a los buceadores calcular cuándo corren el riesgo de sufrir toxicidad pulmonar. [85] [86] [87] En el buceo de saturación, se puede evitar limitando el contenido de oxígeno del gas en las áreas habitadas a menos de 0,4 bar. [88]
La intención de la detección mediante una prueba de tolerancia al oxígeno es identificar a los buceadores con baja tolerancia a altas presiones parciales de oxígeno hiperbárico que pueden ser más propensos a sufrir convulsiones por oxígeno durante las operaciones de buceo o durante el tratamiento hiperbárico para la enfermedad de descompresión. Se ha cuestionado el valor de esta prueba y los estudios estadísticos han demostrado una baja incidencia de convulsiones durante los programas estándar de tratamiento hiperbárico, por lo que algunas armadas han dejado de utilizarla, aunque otras siguen exigiendo la prueba a todos los buceadores candidatos. [89]
La variabilidad de la tolerancia y otros factores variables como la carga de trabajo han hecho que la Marina de los EE. UU. abandone la detección de la tolerancia al oxígeno. De las 6250 pruebas de tolerancia al oxígeno realizadas entre 1976 y 1997, solo se observaron 6 episodios de toxicidad por oxígeno (0,1%). [90] [91]
La prueba de tolerancia al oxígeno utilizada por la Armada de la India , que sigue las recomendaciones de la Armada de los EE. UU. y la Administración Nacional Oceánica y Atmosférica de los EE. UU., consiste en respirar oxígeno al 100 % suministrado por una máscara BIBS a una presión ambiental de 2,8 bar absolutos (18 msw) durante 30 minutos, en reposo en una cámara hiperbárica seca. El asistente no puede observar síntomas de toxicidad por oxígeno en el sistema nervioso central. [89]
La presencia de fiebre o antecedentes de convulsiones es una contraindicación relativa para el tratamiento con oxígeno hiperbárico. [92] Los programas utilizados para el tratamiento de la enfermedad por descompresión permiten períodos de respiración con aire en lugar de oxígeno al 100% (pausas de aire) para reducir la posibilidad de convulsiones o daño pulmonar. La Marina de los EE. UU. utiliza tablas de tratamiento basadas en períodos que alternan entre oxígeno al 100% y aire. Por ejemplo, la tabla 6 de la USN requiere 75 minutos (tres períodos de 20 minutos de oxígeno/5 minutos de aire) a una presión ambiental de 2,8 atmósferas estándar (280 kPa), equivalente a una profundidad de 18 metros (60 pies). A esto le sigue una reducción lenta de la presión a 1,9 atm (190 kPa) durante 30 minutos con oxígeno. Luego, el paciente permanece a esa presión durante otros 150 minutos, que consisten en dos períodos de 15 minutos de aire/60 minutos de oxígeno, antes de que la presión se reduzca a la atmosférica durante 30 minutos con oxígeno. [93]
La vitamina E y el selenio fueron propuestos y luego rechazados como un método potencial de protección contra la toxicidad pulmonar del oxígeno. [94] [95] [96] Sin embargo, hay cierta evidencia experimental en ratas de que la vitamina E y el selenio ayudan a prevenir la peroxidación lipídica in vivo y el daño de los radicales libres y, por lo tanto, previenen los cambios en la retina después de exposiciones repetidas al oxígeno hiperbárico. [97]
La displasia broncopulmonar es reversible en las primeras etapas mediante el uso de períodos de descanso con presiones de oxígeno más bajas, pero puede acabar provocando una lesión pulmonar irreversible si se permite que progrese hasta causar un daño grave. Se necesitan uno o dos días de exposición sin descansos de oxígeno para provocar dicho daño. [16]
La retinopatía del prematuro se puede prevenir en gran medida mediante pruebas de detección. Las directrices actuales exigen que todos los bebés de menos de 32 semanas de edad gestacional o que hayan nacido con un peso inferior a 1,5 kg (3,3 lb) se sometan a pruebas de detección de retinopatía del prematuro al menos cada dos semanas. [98] El Estudio Cooperativo Nacional de 1954 mostró una relación causal entre el oxígeno suplementario y la retinopatía del prematuro, pero la posterior reducción del oxígeno suplementario provocó un aumento de la mortalidad infantil. Para equilibrar los riesgos de hipoxia y retinopatía del prematuro, los protocolos modernos exigen ahora la monitorización de los niveles de oxígeno en sangre de los bebés prematuros que reciben oxígeno. [99]
Una titulación cuidadosa de la dosis para minimizar la concentración administrada y al mismo tiempo lograr el nivel deseado de oxigenación minimizará el riesgo de daño por toxicidad del oxígeno y la cantidad de oxígeno utilizada para la terapia a largo plazo. [37] Un objetivo típico para la saturación de oxígeno cuando se recibe oxigenoterapia estaría en el rango de 91-95%, tanto en bebés a término como prematuros. [72]
En entornos de baja presión, la toxicidad del oxígeno puede evitarse ya que la toxicidad es causada por una alta presión parcial de oxígeno, no por una alta fracción de oxígeno. Esto se ilustra con el uso de oxígeno puro en los trajes espaciales, que deben operar a baja presión, y una alta fracción de oxígeno y una presión de cabina más baja que la presión atmosférica normal en las primeras naves espaciales, por ejemplo, las naves espaciales Gemini y Apollo . [100] En aplicaciones como la actividad extravehicular , el oxígeno de alta fracción no es tóxico, incluso en fracciones de mezcla respirable que se acercan al 100%, porque no se permite que la presión parcial de oxígeno exceda crónicamente los 0,3 bar (4,4 psi). [100]


Durante la terapia con oxígeno hiperbárico, el paciente generalmente respirará oxígeno al 100 % a través de una máscara mientras se encuentra dentro de una cámara hiperbárica presurizada con aire a aproximadamente 2,8 bares (280 kPa). Las convulsiones durante la terapia se controlan quitándole la máscara al paciente, lo que reduce la presión parcial de oxígeno inspirado por debajo de los 0,6 bares (60 kPa). [19]
Una convulsión bajo el agua requiere que el buceador sea llevado a la superficie tan pronto como sea posible. Aunque durante muchos años la recomendación ha sido no elevar al buceador durante la convulsión misma, debido al peligro de embolia gaseosa arterial (AGE), [101] hay alguna evidencia de que la glotis no obstruye completamente la vía aérea. [102] Esto ha llevado a la recomendación actual del Comité de Buceo de la Sociedad Médica Submarina e Hiperbárica de que un buceador debe ser elevado durante la fase clónica (convulsiva) de la convulsión si el regulador no está en la boca del buceador, ya que el peligro de ahogamiento es entonces mayor que el de AGE, pero el ascenso debe retrasarse hasta el final de la fase clónica de lo contrario. [74] Los rescatadores se aseguran de que su propia seguridad no se vea comprometida durante la fase convulsiva. Luego se aseguran de que donde se establece el suministro de aire de la víctima se mantenga, y realizan una elevación flotante controlada . La mayoría de las agencias de formación de buceadores recreativos enseñan a levantar un cuerpo inconsciente como una habilidad avanzada, y para los buceadores profesionales es una habilidad básica, ya que es una de las funciones principales del buceador de reserva . Al llegar a la superficie, siempre se contacta a los servicios de emergencia, ya que existe la posibilidad de que surjan más complicaciones que requieran atención médica. [103] Si se desarrollan síntomas distintos a una convulsión bajo el agua, el buceador debe cambiar inmediatamente a un gas con una fracción de oxígeno más baja o ascender a una profundidad menor si las obligaciones de descompresión lo permiten. Si hay una cámara disponible en la superficie, la descompresión superficial es una opción recomendada. La Marina de los EE. UU. ha publicado procedimientos para completar las paradas de descompresión cuando no hay una cámara de recompresión disponible de inmediato. [104] Algunas computadoras de buceo recalcularán los requisitos de descompresión para mezclas alternativas siempre que se active la configuración de gas real. [81]
La aparición de síntomas de displasia broncopulmonar o síndrome de dificultad respiratoria aguda se trata reduciendo la fracción de oxígeno administrada, junto con una reducción de los períodos de exposición y un aumento de los períodos de descanso en los que se suministra aire normal. Cuando se requiere oxígeno suplementario para el tratamiento de otra enfermedad (en particular en lactantes), puede ser necesario un respirador para asegurar que el tejido pulmonar se mantenga inflado. Las reducciones de la presión y la exposición se realizarán progresivamente, y se pueden utilizar medicamentos como broncodilatadores y surfactantes pulmonares . [105]
Los buzos controlan el riesgo de daño pulmonar limitando la exposición a niveles que se han demostrado generalmente aceptables según la evidencia experimental, utilizando un sistema de unidades de toxicidad por oxígeno acumulado que se basan en el tiempo de exposición a presiones parciales específicas. En caso de tratamiento de emergencia por enfermedad descompresiva, puede ser necesario superar los límites de exposición normales para controlar síntomas más críticos. [33]
La retinopatía del prematuro puede remitir espontáneamente, pero si la enfermedad progresa más allá de un umbral (definido como cinco horas consecutivas u ocho horas acumuladas de retinopatía del prematuro en estadio 3 ), se ha demostrado que tanto la criocirugía como la cirugía láser reducen el riesgo de ceguera como resultado. Cuando la enfermedad ha progresado más, técnicas como el cerclaje escleral y la vitrectomía pueden ayudar a volver a unir la retina. [106]
La exposición repetida a concentraciones de oxígeno potencialmente tóxicas en el gas respirable es bastante común en la actividad hiperbárica, particularmente en la medicina hiperbárica , el buceo de saturación , los hábitats submarinos y el buceo con descompresión repetitiva . La investigación de la Administración Nacional Oceánica y Atmosférica (NOAA) realizada por RW Hamilton y otros determinó los niveles aceptables de exposición para exposiciones únicas y repetidas. Se hace una distinción entre la exposición aceptable para la toxicidad aguda y crónica, pero estos son realmente los extremos de un posible rango continuo de exposiciones. Se puede hacer una distinción adicional entre la exposición rutinaria y la exposición requerida para el tratamiento de emergencia, donde un mayor riesgo de toxicidad por oxígeno puede estar justificado para lograr una reducción de una lesión más crítica, particularmente cuando se está en un entorno controlado y monitoreado relativamente seguro. [33] [93]
El método Repex (exposición repetitiva), desarrollado en 1988, permite calcular la dosis de toxicidad del oxígeno utilizando un valor de dosis única equivalente a 1 minuto de oxígeno al 100 % a presión atmosférica, denominado Unidad de tolerancia al oxígeno (OTU), y se utiliza para evitar efectos tóxicos a lo largo de varios días de exposición operativa. Algunas computadoras de buceo rastrearán automáticamente la dosis en función de la profundidad medida y la mezcla de gases seleccionada. Los límites permiten una mayor exposición cuando la persona no ha estado expuesta recientemente, y la dosis diaria permitida disminuye con un aumento en los días consecutivos de exposición. [33] Estos valores pueden no estar totalmente respaldados por los datos actuales. [107]
Una propuesta más reciente utiliza una ecuación de potencia simple, el índice de toxicidad (TI) = t 2 × P O 2 c , donde t es el tiempo y c es el término de potencia. Esto se derivó de las reacciones químicas que producen especies reactivas de oxígeno o nitrógeno, y se ha demostrado que da buenas predicciones para la toxicidad del SNC con c = 6,8 y para la toxicidad pulmonar con c = 4,57. [107]
Para la toxicidad pulmonar, el tiempo se expresa en horas y el P O 2 en atmósferas absolutas. La TI debe limitarse a 250.
Para la toxicidad del SNC, el tiempo se expresa en minutos, la P O 2 en atmósferas absolutas y un TI de 26 108 indica un riesgo del 1 %.
Aunque las convulsiones causadas por la toxicidad del oxígeno en el sistema nervioso central pueden provocar lesiones incidentales a la víctima, durante muchos años no se supo con certeza si se podía producir daño al sistema nervioso después de la convulsión y varios estudios buscaron pruebas de dicho daño. En un análisis general de estos estudios realizado por Bitterman en 2004 se llegó a la conclusión de que, tras la eliminación del gas respirable que contiene altas fracciones de oxígeno, no quedan daños neurológicos a largo plazo a causa de la convulsión. [21] [108]
La mayoría de los bebés que han sobrevivido a un episodio de displasia broncopulmonar acaban recuperando una función pulmonar casi normal, ya que los pulmones siguen creciendo durante los primeros 5 a 7 años y el daño causado por la displasia broncopulmonar es hasta cierto punto reversible (incluso en adultos). Sin embargo, es probable que sean más susceptibles a las infecciones respiratorias durante el resto de sus vidas y la gravedad de las infecciones posteriores suele ser mayor que en sus pares. [109] [110]
La retinopatía del prematuro (ROP) en los bebés suele remitir sin intervención y la visión puede ser normal en años posteriores. Cuando la enfermedad ha progresado a las etapas que requieren cirugía, los resultados son generalmente buenos para el tratamiento de la ROP en etapa 3, pero son mucho peores para las etapas posteriores. Aunque la cirugía suele tener éxito en la restauración de la anatomía del ojo, el daño al sistema nervioso por la progresión de la enfermedad conduce a resultados comparativamente peores en la restauración de la visión. La presencia de otras enfermedades que la complican también reduce la probabilidad de un resultado favorable. [111]
El suministro de oxígeno suplementario sigue siendo de importancia vital en los cuidados críticos y puede aumentar la supervivencia en algunas enfermedades crónicas, pero la hiperoxia y la formación de especies reactivas de oxígeno están implicadas en la patogenia de varias enfermedades potencialmente mortales. Los efectos tóxicos de la hiperoxia son particularmente frecuentes en el compartimento pulmonar, y las circulaciones cerebral y coronaria están en riesgo cuando se producen cambios vasculares. La hiperoxia a largo plazo daña las respuestas inmunitarias y aumenta la susceptibilidad a complicaciones infecciosas y lesiones tisulares. [37]
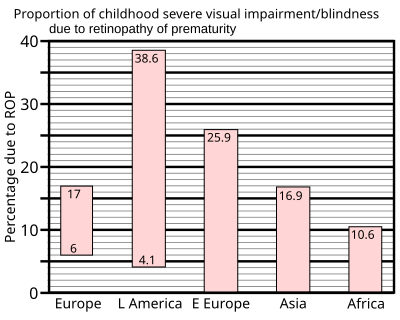
La incidencia de toxicidad del sistema nervioso central entre los buceadores ha disminuido desde la Segunda Guerra Mundial, a medida que se han desarrollado protocolos para limitar la exposición y la presión parcial de oxígeno inspirado. En 1947, Donald recomendó limitar la profundidad permitida para respirar oxígeno puro a 7,6 m (25 pies), lo que equivale a una presión parcial de oxígeno de 1,8 bar (180 kPa). [112] Con el tiempo, este límite se ha reducido, hasta hoy en día generalmente se recomienda un límite de 1,4 bar (140 kPa) durante una inmersión recreativa y 1,6 bar (160 kPa) durante paradas de descompresión poco profundas, [113] aunque los buceadores militares que usan rebreathers de oxígeno pueden operar a mayores profundidades durante períodos limitados, con mayor riesgo. [114] La toxicidad del oxígeno ahora se ha convertido en un suceso poco común, excepto cuando es causado por un mal funcionamiento del equipo y un error humano. Históricamente, la Marina de los EE. UU. ha refinado sus tablas de aire y gases mixtos del Manual de buceo de la Marina para reducir los incidentes de toxicidad del oxígeno. Entre 1995 y 1999, los informes mostraron 405 inmersiones con apoyo en la superficie utilizando las tablas de helio-oxígeno; de éstas, se observaron síntomas de toxicidad por oxígeno en 6 inmersiones (1,5%). Como resultado, en 2000 la Marina de los EE. UU. modificó los cronogramas y realizó pruebas de campo en 150 inmersiones, ninguna de las cuales produjo síntomas de toxicidad por oxígeno. Las tablas revisadas se publicaron en 2001. [115]
La variabilidad de la tolerancia y otros factores variables como la carga de trabajo han hecho que la Marina de los EE. UU. abandone la detección de la tolerancia al oxígeno. De las 6250 pruebas de tolerancia al oxígeno realizadas entre 1976 y 1997, solo se observaron 6 episodios de toxicidad por oxígeno (0,1%). [90] [91]
La toxicidad del oxígeno en el sistema nervioso central entre los pacientes sometidos a terapia de oxígeno hiperbárico es poco frecuente y está influenciada por una serie de factores: la sensibilidad individual y el protocolo de tratamiento; y probablemente la indicación de la terapia y el equipo utilizado. Un estudio realizado por Welslau en 1996 informó de 16 incidentes en una población de 107.264 pacientes (0,015%), mientras que Hampson y Atik en 2003 encontraron una tasa del 0,03%. [116] [117] Yildiz, Ay y Qyrdedi, en un resumen de 36.500 tratamientos de pacientes entre 1996 y 2003, informaron sólo 3 incidentes de toxicidad del oxígeno, lo que arroja una tasa del 0,008%. [116] Una revisión posterior de más de 80.000 tratamientos de pacientes reveló una tasa incluso menor: 0,0024%. La reducción de la incidencia puede deberse en parte al uso de una máscara en lugar de una capucha para administrar oxígeno, ya que hay menos espacio muerto en una máscara. [118]
El riesgo general de toxicidad del SNC puede ser tan alto como 1 en 2000 a 3000 tratamientos, pero varía con la presión y puede ser tan alto como 1 en 200 en programas de tratamiento de presión más alta de 2,8 a 3,0 ATA, o tan bajo como 1 en 10 000 para programas de 2 ATA o menos. [40]
La displasia broncopulmonar es una de las complicaciones más comunes de los bebés prematuros y su incidencia ha aumentado a medida que ha aumentado la supervivencia de los bebés extremadamente prematuros. Sin embargo, la gravedad ha disminuido a medida que un mejor manejo del oxígeno suplementario ha hecho que la enfermedad ahora esté relacionada principalmente con factores distintos de la hiperoxia. [45]
En 1997, un resumen de estudios sobre unidades de cuidados intensivos neonatales en países industrializados mostró que hasta el 60% de los bebés con bajo peso al nacer desarrollaban retinopatía del prematuro, cifra que ascendía al 72% en los bebés con peso extremadamente bajo al nacer, definido como aquellos que pesaban menos de 1 kg (2,2 lb) al nacer. Sin embargo, los resultados graves son mucho menos frecuentes: en el caso de los bebés con peso muy bajo al nacer (menos de 1,5 kg (3,3 lb) al nacer), se encontró que la incidencia de ceguera no era superior al 8%. [36]
La administración de oxígeno suplementario se utiliza de forma extensa y eficaz en la medicina de urgencias y cuidados intensivos, pero las especies reactivas de oxígeno causadas por la oxigenación excesiva tienden a provocar un círculo vicioso de lesión tisular, caracterizada por daño celular, muerte celular e inflamación, principalmente en los pulmones, que puede exacerbar los problemas de oxigenación tisular para los que se pretendía tratar el oxígeno suplementario. Pueden producirse problemas similares en la oxigenoterapia para enfermedades crónicas que implican hipoxia. Una titulación cuidadosa del suministro de oxígeno para minimizar el exceso respecto de la necesidad fisiológica también reduce la exposición hiperóxica pulmonar al mínimo razonablemente practicable. [37] La incidencia de síntomas pulmonares de toxicidad por oxígeno es de alrededor del 5%, y algunos fármacos pueden aumentar el riesgo, como el agente quimioterapéutico bleomicina. [40]

La toxicidad del sistema nervioso central fue descrita por primera vez por Paul Bert en 1878. [119] [120] Demostró que el oxígeno era tóxico para los insectos, arácnidos , miriápodos , moluscos, lombrices de tierra, hongos, semillas en germinación, pájaros y otros animales. La toxicidad del sistema nervioso central puede denominarse "efecto Paul Bert". [16]
La toxicidad pulmonar por oxígeno fue descrita por primera vez por J. Lorrain Smith en 1899, cuando observó la toxicidad del sistema nervioso central y descubrió en experimentos con ratones y aves que 0,43 bar (43 kPa) no tenían ningún efecto, pero 0,75 bar (75 kPa) de oxígeno eran un irritante pulmonar. [32] La toxicidad pulmonar puede denominarse "efecto Lorrain Smith". [16] La primera exposición humana registrada fue realizada en 1910 por Bornstein cuando dos hombres respiraron oxígeno a 2,8 bar (280 kPa) durante 30 minutos, mientras que él pasó 48 minutos sin síntomas. En 1912, Bornstein desarrolló calambres en las manos y las piernas mientras respiraba oxígeno a 2,8 bar (280 kPa) durante 51 minutos. [3] Smith luego demostró que la exposición intermitente a un gas respirable con menos oxígeno permitía que los pulmones se recuperaran y retrasaba la aparición de toxicidad pulmonar. [32]
En 1935, Albert R. Behnke y otros fueron los primeros en observar la contracción del campo visual ( visión de túnel ) en inmersiones entre 1,0 bar (100 kPa) y 4,1 bar (410 kPa). [121] [122] Durante la Segunda Guerra Mundial, Donald y Yarbrough y otros realizaron más de 2000 experimentos sobre toxicidad del oxígeno para apoyar el uso inicial de rebreathers de oxígeno de circuito cerrado . [46] [123] Los buzos navales en los primeros años del buceo con rebreathers de oxígeno desarrollaron una mitología sobre un monstruo llamado "Oxygen Pete", que acechaba en el fondo de la "olla húmeda" (una cámara hiperbárica llena de agua ) de la Unidad de Buceo Experimental del Almirantazgo para atrapar a los buceadores incautos. Llamaban a sufrir un ataque de toxicidad por oxígeno "recibir un Pete". [124] [125]
En la década posterior a la Segunda Guerra Mundial, Lambertsen et al. hicieron más descubrimientos sobre los efectos de respirar oxígeno bajo presión y los métodos de prevención. [126] [127] Su trabajo sobre exposiciones intermitentes para la extensión de la tolerancia al oxígeno y sobre un modelo para la predicción de la toxicidad pulmonar por oxígeno basado en la función pulmonar son documentos clave en el desarrollo de procedimientos operativos estándar cuando se respiran presiones aumentadas de oxígeno. [128] El trabajo de Lambertsen que muestra el efecto del dióxido de carbono en la disminución del tiempo hasta la aparición de los síntomas del sistema nervioso central ha influido en el trabajo desde las pautas de exposición actuales hasta el diseño futuro de aparatos respiratorios . [23] [24] [129]
La retinopatía del prematuro no se había observado antes de la Segunda Guerra Mundial, pero con la disponibilidad de oxígeno suplementario en la década siguiente, se convirtió rápidamente en una de las principales causas de ceguera infantil en los países desarrollados. En 1960, el uso de oxígeno se había identificado como un factor de riesgo y se restringió su administración. La caída resultante de la retinopatía del prematuro estuvo acompañada de un aumento de la mortalidad infantil y de las complicaciones relacionadas con la hipoxia . Desde entonces, un seguimiento y un diagnóstico más sofisticados han establecido protocolos para el uso de oxígeno que apuntan a equilibrar las condiciones hipóxicas y los problemas de la retinopatía del prematuro. [36]
La displasia broncopulmonar fue descrita por primera vez por Northway en 1967, quien describió las condiciones que llevarían al diagnóstico. [130] Esto fue ampliado posteriormente por Bancalari y en 1988 por Shennan, quien sugirió que la necesidad de oxígeno suplementario a las 36 semanas podría predecir los resultados a largo plazo. [131] Sin embargo, Palta et al. en 1998 concluyeron que la evidencia radiográfica era el predictor más preciso de los efectos a largo plazo. [132]

Bitterman et al. en 1986 y 1995 demostraron que la oscuridad y la cafeína retrasarían la aparición de cambios en la actividad eléctrica cerebral en ratas. [25] [26] En los años transcurridos desde entonces, la investigación sobre la toxicidad del sistema nervioso central se ha centrado en métodos de prevención y extensión segura de la tolerancia. [133] Se ha demostrado que la sensibilidad a la toxicidad del oxígeno del sistema nervioso central se ve afectada por factores como el ritmo circadiano , los fármacos, la edad y el género. [134] [135] [136] [137] En 1988, Hamilton et al. escribieron procedimientos para que la Administración Nacional Oceánica y Atmosférica estableciera límites de exposición al oxígeno para las operaciones de hábitat . [85] [86] [87] Incluso hoy en día, los modelos para la predicción de la toxicidad del oxígeno pulmonar no explican todos los resultados de la exposición a altas presiones parciales de oxígeno. [138]
Los buceadores recreativos suelen respirar nitrox que contiene hasta un 40 % de oxígeno, mientras que los buceadores técnicos utilizan oxígeno puro o nitrox que contiene hasta un 80 % de oxígeno para acelerar la descompresión. Los buceadores que respiran fracciones de oxígeno superiores a las del aire (21 %) deben recibir información sobre los peligros de la toxicidad del oxígeno y sobre cómo gestionar el riesgo. [76] Para comprar nitrox, es posible que se le pida a un buceador que muestre evidencia de la cualificación pertinente. [139]
Desde finales de los años 1990, el uso recreativo del oxígeno ha sido promovido por los bares de oxígeno, donde los clientes respiran oxígeno a través de una cánula nasal . Se ha afirmado que esto reduce el estrés, aumenta la energía y disminuye los efectos de las resacas y los dolores de cabeza, a pesar de la falta de evidencia científica que los respalde. [140] También hay dispositivos a la venta que ofrecen "masaje de oxígeno" y "desintoxicación de oxígeno" con afirmaciones de eliminar toxinas corporales y reducir la grasa corporal. [141] La Asociación Estadounidense del Pulmón ha declarado que "no hay evidencia de que el oxígeno a los niveles de flujo bajo utilizados en los bares pueda ser peligroso para la salud de una persona normal", pero el Centro de Evaluación e Investigación de Medicamentos de EE. UU. advierte que las personas con enfermedades cardíacas o pulmonares necesitan que su oxígeno suplementario esté cuidadosamente regulado y no deben usar bares de oxígeno. [140]
La sociedad victoriana sentía fascinación por el campo de la ciencia, que se expandía rápidamente. En " El experimento del doctor Ox ", un cuento escrito por Julio Verne en 1872, el doctor epónimo utiliza la electrólisis del agua para separar el oxígeno del hidrógeno. Luego bombea el oxígeno puro por toda la ciudad de Quiquendone, lo que hace que los habitantes, normalmente tranquilos, y sus animales se vuelvan agresivos y las plantas crezcan rápidamente. Una explosión de hidrógeno y oxígeno en la fábrica del doctor Ox pone fin a su experimento. Verne resumió su historia explicando que los efectos del oxígeno descritos en el cuento eran de su propia invención (no están respaldados de ninguna manera por evidencia empírica). [142] También hay un breve episodio de intoxicación por oxígeno en su " De la Tierra a la Luna ". [143]
{{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace )(se requiere suscripción){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite book}}: CS1 maint: URL no apta ( enlace )Los siguientes sitios externos contienen recursos específicos para temas particulares: