El yodo-131 ( 131 I , I-131 ) es un radioisótopo importante del yodo descubierto por Glenn Seaborg y John Livingood en 1938 en la Universidad de California, Berkeley. [3] Tiene una vida media de desintegración radiactiva de unos ocho días. Está asociado con la energía nuclear, los procedimientos de diagnóstico y tratamiento médicos y la producción de gas natural. También desempeña un papel importante como isótopo radiactivo presente en los productos de fisión nuclear , y fue un contribuyente significativo a los riesgos para la salud de las pruebas de bombas atómicas al aire libre en la década de 1950 y del desastre de Chernóbil , además de ser una gran fracción del riesgo de contaminación en las primeras semanas de la crisis nuclear de Fukushima . Esto se debe a que el 131 I es un importante producto de fisión del uranio y el plutonio , que comprende casi el 3% de los productos totales de fisión (en peso). Consulte el rendimiento del producto de fisión para una comparación con otros productos de fisión radiactivos. El 131 I también es un importante producto de fisión del uranio-233 , producido a partir del torio .
Debido a su modo de desintegración beta , el yodo-131 causa mutación y muerte en las células en las que penetra, y en otras células a varios milímetros de distancia. Por esta razón, las dosis altas del isótopo a veces son menos peligrosas que las dosis bajas, ya que tienden a matar tejidos tiroideos que de otro modo se volverían cancerosos como resultado de la radiación. Por ejemplo, los niños tratados con dosis moderadas de 131 I para adenomas tiroideos tuvieron un aumento detectable de cáncer de tiroides, pero los niños tratados con una dosis mucho más alta no lo tuvieron. [4] De la misma manera, la mayoría de los estudios de 131 I en dosis muy altas para el tratamiento de la enfermedad de Graves no han logrado encontrar ningún aumento en el cáncer de tiroides, a pesar de que existe un aumento lineal en el riesgo de cáncer de tiroides con la absorción de 131 I en dosis moderadas. [5] Por lo tanto, el yodo-131 se utiliza cada vez menos en pequeñas dosis en uso médico (especialmente en niños), pero cada vez más se usa solo en dosis de tratamiento grandes y máximas, como una forma de matar tejidos específicos. Esto se conoce como "uso terapéutico".
El yodo-131 puede ser "visto" por técnicas de imagenología de medicina nuclear (por ejemplo, cámaras gamma ) siempre que se administre para uso terapéutico, ya que aproximadamente el 10% de su energía y dosis de radiación es a través de radiación gamma. Sin embargo, dado que el otro 90% de la radiación (radiación beta) causa daño tisular sin contribuir a ninguna capacidad de ver o "obtener imágenes" del isótopo, se prefieren otros radioisótopos de yodo menos dañinos, como el yodo-123 (ver isótopos de yodo ) en situaciones en las que solo se requieren imágenes nucleares. El isótopo 131 I todavía se usa ocasionalmente para trabajo puramente diagnóstico (es decir, imágenes), debido a su bajo costo en comparación con otros radioisótopos de yodo. Dosis muy pequeñas de 131 I para imágenes médicas no han demostrado ningún aumento en el cáncer de tiroides. La disponibilidad a bajo costo del 131 I, a su vez, se debe a la relativa facilidad de crear 131 I mediante el bombardeo de neutrones de telurio natural en un reactor nuclear, para luego separarlo mediante varios métodos simples (es decir, calentándolo para eliminar el yodo volátil). Por el contrario, otros radioisótopos de yodo se crean generalmente mediante técnicas mucho más costosas, comenzando con la radiación ciclotrónica de cápsulas de gas xenón presurizado . [6]
El yodo-131 es también uno de los trazadores industriales radiactivos emisores de rayos gamma más utilizados . Los isótopos trazadores radiactivos se inyectan con fluido de fracturación hidráulica para determinar el perfil de inyección y la ubicación de las fracturas creadas por la fracturación hidráulica. [7]
Algunos estudios consideran que la principal causa del aumento de cánceres de tiroides tras una contaminación nuclear accidental son dosis incidentales de yodo-131 mucho menores que las utilizadas en procedimientos terapéuticos médicos. Estos estudios suponen que los cánceres se producen a partir de daños residuales en los tejidos causados por la radiación del 131I y que deberían aparecer en su mayoría años después de la exposición, mucho después de que el 131I se haya desintegrado. [8] [9] Otros estudios no encontraron una correlación. [10] [11]
La mayor parte de la producción de 131 I se produce a partir de la irradiación con neutrones de un blanco de telurio natural en un reactor nuclear. La irradiación de telurio natural produce casi en su totalidad 131 I, el único radionucleido con una vida media superior a horas, ya que la mayoría de los isótopos más ligeros del telurio se convierten en isótopos estables más pesados, o bien en yodo o xenón estables. Sin embargo, el nucleido de telurio más pesado que se encuentra en la naturaleza, el 130 Te (34 % del telurio natural), absorbe un neutrón para convertirse en telurio-131, que se desintegra en 131 I con una vida media de 25 minutos .
Un compuesto de telurio puede irradiarse mientras está unido como óxido a una columna de intercambio iónico, y luego el 131 I evolucionado se eluye en una solución alcalina. [12] Más comúnmente, el telurio elemental en polvo se irradia y luego el 131 I se separa de él mediante destilación en seco del yodo, que tiene una presión de vapor mucho más alta . Luego, el elemento se disuelve en una solución ligeramente alcalina de la manera estándar, para producir 131 I como yoduro e hipoyodato (que pronto se reduce a yoduro). [13]
El 131 I es un producto de fisión con un rendimiento del 2,878 % a partir del uranio-235 [ 14] y puede liberarse en pruebas de armas nucleares y accidentes nucleares . Sin embargo, su corta vida media significa que no está presente en cantidades significativas en el combustible nuclear gastado enfriado , a diferencia del yodo-129, cuya vida media es casi mil millones de veces mayor que la del 131 I.
Algunas centrales nucleares lo liberan a la atmósfera en pequeñas cantidades. [15]
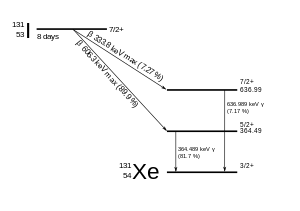
El 131 I se desintegra con una vida media de 8,0249(6) días [1] con emisiones beta negativas y gamma . Este isótopo del yodo tiene 78 neutrones en su núcleo, mientras que el único nucleido estable, el 127 I, tiene 74. Al desintegrarse, el 131 I gasta con mayor frecuencia (el 89 % de las veces) su energía de desintegración de 971 keV transformándose en xenón-131 estable en dos pasos, con la desintegración gamma que sigue rápidamente a la desintegración beta:
Las emisiones primarias de la desintegración del 131 I son, por tanto, electrones con una energía máxima de 606 keV (89% de abundancia, otros 248-807 keV) y rayos gamma de 364 keV (81% de abundancia, otros 723 keV). [16] La desintegración beta también produce un antineutrino , que se lleva cantidades variables de la energía de desintegración beta. Los electrones, debido a su alta energía media (190 keV, con espectros típicos de desintegración beta presentes) tienen una penetración en el tejido de 0,6 a 2 mm . [17]
El yodo presente en los alimentos es absorbido por el cuerpo y se concentra preferentemente en la tiroides , donde es necesario para el funcionamiento de esa glándula. Cuando el 131 I está presente en niveles altos en el ambiente debido a la lluvia radiactiva , puede ser absorbido a través de alimentos contaminados y también se acumulará en la tiroides. A medida que se descompone, puede causar daños a la tiroides. El riesgo principal de la exposición al 131 I es un mayor riesgo de cáncer inducido por radiación en etapas posteriores de la vida. Otros riesgos incluyen la posibilidad de crecimientos no cancerosos y tiroiditis . [5]
El riesgo de cáncer de tiroides en etapas posteriores de la vida parece disminuir a medida que aumenta la edad en el momento de la exposición. La mayoría de las estimaciones de riesgo se basan en estudios en los que la exposición a la radiación se produjo en niños o adolescentes. Cuando los adultos están expuestos, ha sido difícil para los epidemiólogos detectar una diferencia estadísticamente significativa en las tasas de enfermedad de tiroides por encima de la de un grupo similar pero por lo demás no expuesto. [5] [19]
El riesgo puede mitigarse tomando suplementos de yodo, que aumentan la cantidad total de yodo en el cuerpo y, por lo tanto, reducen la absorción y retención en la cara y el pecho y disminuyen la proporción relativa de yodo radiactivo. Sin embargo, estos suplementos no se distribuyeron de manera sistemática a la población que vivía más cerca de la central nuclear de Chernóbil después del desastre [20] , aunque sí se distribuyeron ampliamente entre los niños de Polonia.
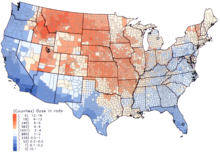
En los Estados Unidos, las dosis más altas de 131 I se produjeron durante los años 1950 y principios de los 1960 en niños que habían consumido leche fresca de fuentes contaminadas como resultado de pruebas de armas nucleares en la superficie. [8] El Instituto Nacional del Cáncer proporciona información adicional sobre los efectos en la salud de la exposición al 131 I en la lluvia radiactiva, [21] así como estimaciones individualizadas, para los nacidos antes de 1971, para cada uno de los 3070 condados de los Estados Unidos. Los cálculos se toman de los datos recopilados sobre la lluvia radiactiva de las pruebas de armas nucleares realizadas en el Sitio de Pruebas de Nevada . [22]
El 27 de marzo de 2011, el Departamento de Salud Pública de Massachusetts informó que se había detectado 131 I en concentraciones muy bajas en el agua de lluvia de muestras recogidas en Massachusetts, EE.UU., y que probablemente se originó en la central eléctrica de Fukushima. [23] Los granjeros que se encontraban cerca de la planta arrojaron leche cruda, mientras que en una prueba realizada en Estados Unidos se encontraron 0,8 picocurios por litro de yodo-131 en una muestra de leche, pero los niveles de radiación eran 5.000 veces inferiores al "nivel de intervención definido" de la FDA. Se esperaba que los niveles cayeran con relativa rapidez [24]
Un método de tratamiento común para prevenir la exposición al yodo-131 es saturar la tiroides con yodo-127 regular y estable, como sal de yoduro o yodato .

El yodo-131 se utiliza en la radioterapia con fuentes no selladas en medicina nuclear para tratar varias afecciones. También se puede detectar con cámaras gamma para diagnóstico por imágenes , sin embargo, rara vez se administra solo con fines diagnósticos; las imágenes normalmente se realizan después de una dosis terapéutica. [26] El uso del 131 I como sal de yoduro aprovecha el mecanismo de absorción del yodo por las células normales de la glándula tiroides .
Los principales usos del 131 I incluyen el tratamiento de la tirotoxicosis (hipertiroidismo) debido a la enfermedad de Graves y, a veces, nódulos tiroideos hiperactivos (tejido tiroideo anormalmente activo que no es maligno). El uso terapéutico del yodo radiactivo para tratar el hipertiroidismo de la enfermedad de Graves fue informado por primera vez por Saul Hertz en 1941. La dosis se administra típicamente por vía oral (ya sea como líquido o cápsula), en un entorno ambulatorio , y suele ser de 400 a 600 megabecquerels (MBq). [27] El yodo radiactivo (yodo-131) solo puede empeorar potencialmente la tirotoxicosis en los primeros días posteriores al tratamiento. Un efecto secundario del tratamiento es un período inicial de unos pocos días de aumento de los síntomas de hipertiroidismo. Esto ocurre porque cuando el yodo radiactivo destruye las células tiroideas, pueden liberar hormona tiroidea en el torrente sanguíneo. Por este motivo, en ocasiones se administra a los pacientes un tratamiento previo con medicamentos tirostáticos como el metimazol y/o un tratamiento sintomático como el propranolol. El tratamiento con yodo radiactivo está contraindicado en la lactancia y el embarazo [28]
El yodo-131, en dosis más altas que para la tirotoxicosis, se utiliza para la ablación del tejido tiroideo remanente después de una tiroidectomía completa para tratar el cáncer de tiroides . [29] [27]
Las dosis terapéuticas típicas de I-131 oscilan entre 2220 y 7400 megabecquerels (MBq). [30] Debido a esta alta radiactividad y a que la exposición del tejido del estómago a la radiación beta sería alta cerca de una cápsula no disuelta, el I-131 a veces se administra a pacientes humanos en una pequeña cantidad de líquido. La administración de esta forma líquida se realiza habitualmente mediante una pajita que se utiliza para succionar lenta y cuidadosamente el líquido de un recipiente blindado. [31] Para la administración a animales (por ejemplo, gatos con hipertiroidismo), por razones prácticas, el isótopo debe administrarse mediante inyección. Las directrices europeas recomiendan la administración de una cápsula, debido a "una mayor comodidad para el paciente y una mayor protección radiológica para los cuidadores". [32]
Las dosis de ablación se administran generalmente en pacientes hospitalizados , y las Normas Básicas Internacionales de Seguridad del OIEA recomiendan que los pacientes no sean dados de alta hasta que la actividad caiga por debajo de 1100 MBq. [33] El asesoramiento de la ICRP establece que los "consoladores y cuidadores" de los pacientes sometidos a terapia con radionúclidos deben ser tratados como miembros del público a los efectos de restricción de dosis y cualquier restricción sobre el paciente debe diseñarse en base a este principio. [34]
A los pacientes que reciben tratamiento con yodo radiactivo I-131 se les puede advertir que no tengan relaciones sexuales durante un mes (o menos, según la dosis administrada), y se les puede indicar que no se queden embarazadas durante los seis meses siguientes. "Esto se debe a que existe un riesgo teórico para el feto en desarrollo, aunque la cantidad de radiactividad retenida puede ser pequeña y no hay pruebas médicas de un riesgo real del tratamiento con yodo radiactivo. Esa precaución eliminaría esencialmente la exposición fetal directa a la radiactividad y reduciría notablemente la posibilidad de concepción con espermatozoides que teóricamente podrían haber sido dañados por la exposición al yodo radiactivo". [35] Estas pautas varían de un hospital a otro y dependerán de la legislación y las directrices nacionales, así como de la dosis de radiación administrada. Algunos también recomiendan no abrazar ni sostener a los niños cuando la radiación aún es alta, y puede recomendarse una distancia de uno o dos metros con los demás. [36]
El I-131 se eliminará del cuerpo durante las semanas siguientes a su administración. La mayor parte del I-131 se eliminará del cuerpo humano en 3 a 5 días, a través de la descomposición natural y por excreción en el sudor y la orina. Se seguirán liberando cantidades más pequeñas durante las siguientes semanas, a medida que el cuerpo procese las hormonas tiroideas creadas con el I-131. Por este motivo, se recomienda limpiar regularmente los inodoros, lavabos, sábanas y ropa que haya utilizado la persona que haya recibido el tratamiento. También se puede recomendar a los pacientes que usen pantuflas o calcetines en todo momento y que eviten el contacto cercano prolongado con otras personas. Esto minimiza la exposición accidental de los miembros de la familia, especialmente los niños. [37] Se puede recomendar el uso de un descontaminante especialmente elaborado para la eliminación de yodo radiactivo. No se recomienda el uso de soluciones de cloro o limpiadores que contengan cloro para la limpieza, ya que se puede liberar gas de yodo elemental radiactivo. [38] El I-131 en el aire puede causar un mayor riesgo de exposición pasiva, extendiendo la contaminación por un área amplia. Se aconseja al paciente que, si es posible, permanezca en una habitación con baño conectado para limitar la exposición no intencionada a los miembros de la familia.
Muchos aeropuertos cuentan con detectores de radiación para detectar el contrabando de materiales radiactivos. Se debe advertir a los pacientes que, si viajan en avión, pueden activar los detectores de radiación en los aeropuertos hasta 95 días después de su tratamiento con 131 I. [39]
El isótopo 131 I también se utiliza como marcador radiactivo para ciertos radiofármacos que se pueden utilizar para terapia, por ejemplo, 131 I- metayodobencilguanidina ( 131 I-MIBG) para la obtención de imágenes y el tratamiento del feocromocitoma y el neuroblastoma . En todos estos usos terapéuticos, el 131 I destruye el tejido mediante radiación beta de corto alcance . Aproximadamente el 90% de su daño por radiación al tejido se produce a través de la radiación beta, y el resto se produce a través de su radiación gamma (a una distancia mayor del radioisótopo). Se puede ver en exploraciones de diagnóstico después de su uso como terapia, porque el 131 I también es un emisor gamma.
Debido a la carcinogenicidad de su radiación beta en la tiroides en pequeñas dosis, el I-131 rara vez se utiliza principalmente o únicamente para el diagnóstico (aunque en el pasado esto era más común debido a la relativa facilidad de producción de este isótopo y su bajo costo). En cambio, el yodo radiactivo yodo-123, que emite más rayos gamma , se utiliza en pruebas diagnósticas ( exploración de medicina nuclear de la tiroides). El yodo-125, de vida media más larga , también se utiliza ocasionalmente cuando se necesita un yodo radiactivo de vida media más larga para el diagnóstico y en el tratamiento de braquiterapia (isótopo confinado en pequeñas cápsulas metálicas con forma de semilla), donde la radiación gamma de baja energía sin un componente beta hace que el yodo-125 sea útil. Los otros radioisótopos del yodo nunca se utilizan en braquiterapia.
Se ha culpado al uso de 131 I como isótopo médico de que un envío rutinario de biosólidos fuera rechazado al cruzar la frontera entre Canadá y Estados Unidos. [40] Dicho material puede ingresar a las alcantarillas directamente desde las instalaciones médicas o al ser excretado por los pacientes después de un tratamiento.
Utilizado por primera vez en 1951 para localizar fugas en un sistema de suministro de agua potable de Munich , Alemania, el yodo-131 se convirtió en uno de los trazadores radiactivos industriales emisores de rayos gamma más utilizados , con aplicaciones en hidrología isotópica y detección de fugas. [41] [42] [43] [44]
Desde finales de la década de 1940, la industria petrolera ha utilizado trazadores radiactivos. Una vez marcados en la superficie, se rastrea el agua en el fondo del pozo utilizando el detector gamma apropiado para determinar los flujos y detectar fugas subterráneas. El I-131 ha sido el isótopo de marcado más utilizado en una solución acuosa de yoduro de sodio . [45] [46] [47] Se utiliza para caracterizar el fluido de fracturación hidráulica para ayudar a determinar el perfil de inyección y la ubicación de las fracturas creadas por la fracturación hidráulica . [48] [49] [50]
En 1997, el NCI realizó una evaluación detallada de la dosis a las glándulas tiroides de los residentes de los EE. UU. de I-131 en la lluvia radiactiva de las pruebas en Nevada. (...) evaluamos los riesgos de cáncer de tiroides por esa exposición y estimamos que podrían ocurrir alrededor de 49.000 casos relacionados con la lluvia radiactiva en los Estados Unidos, casi todos ellos entre personas menores de 20 años en algún momento durante el período 1951-57, con límites de incertidumbre del 95 por ciento de 11.300 y 212.000.
{{cite journal}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace )no se observaron asociaciones entre las liberaciones de yodo-131 de Hanford y la enfermedad tiroidea. [Los hallazgos] muestran que si existe un mayor riesgo de enfermedad tiroidea por la exposición al yodo-131 de Hanford, probablemente sea demasiado pequeño para observarlo utilizando los mejores métodos epidemiológicos disponiblesResumen ejecutivo
{{cite book}}: |website=ignorado ( ayuda ){{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )