Temperatura de llama adiabática
Su temperatura es más alta que la que se produce en la combustión a presión constante, ya que en este último caso parte de la energía se utiliza para aumentar el volumen del sistema, produciendo trabajo.
En la vida diaria, la gran mayoría de los combustibles que se utilizan habitualmente son compuestos orgánicos como la madera, cera, grasa, plásticos comunes, propano, gas y gasolina.
Suponiendo condiciones atmosféricas (1 bar y 20 °C), la siguiente tabla muestra las temperaturas de llama adiabática para varios gases a presión constante.
Nota: estos son datos teóricos de la temperatura de llama que se producen por un proceso que no pierde calor.
son, respectivamente, la energía interna de los reactivos y productos.
En el caso de la temperatura de llama adiabática a volumen constante, el volumen del sistema se mantiene constante por lo que no se produce ningún trabajo; y no hay transferencia de calor debido a que el proceso está definido para ser adiabático:
Esto se debe a que parte de la energía realizada durante la combustión se invierte en cambiar el volumen de control del sistema.
Para el proceso adiabático a volumen constante, se considera que la combustión ocurre instantáneamente cuando el pistón alcanza el punto puerto superior (ciclo de Otto o ciclo de volumen constante).
Esto se debe a que hay suficientes variables y ecuaciones molares para equilibrar los lados izquierdo y derecho, Como la mezcla aún es rica, no se dispone de suficientes variables, por lo que se debe añadir
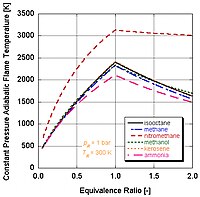
Dado que cada mol de nitrometano contiene dos moles de oxígeno, este puede arder a altas temperaturas porque proporciona su propio oxidante junto con el combustible.
Es interesante observar que el nitrometano ya contiene su propio oxidante en la estequiometría.
Sin embargo, el funcionamiento continuo de un motor alimentado con nitrometano finalmente funde el pistón y/o cilindro debido a esta temperatura más alta.
En aplicaciones reales, generalmente no se produce la combustión completa.
La química dicta que la disociación y cinética cambiarán los componentes relativos del producto.
Estos resultados pueden explicarse a través del principio de Le Chatelier.