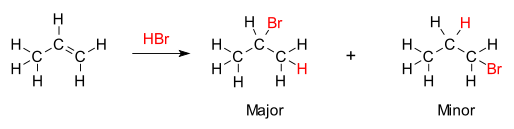
Regla de Markovnikov
En consecuencia, el producto principal de la adición del HX (donde X es un halógeno, átomo o grupo funcional más electronegativo que el átomo de hidrógeno) a un alqueno tiene el átomo de hidrógeno en la posición menos sustituida y el grupo X en la posición más sustituidas.
Se dice que tales reacciones son anti-Markóvnikov, dado que el átomo de hidrógeno se une al átomo de carbono más sustituido.
Una manifestación anti-Markóvnikov se observa en la hidratación del fenilacetileno que, catalizado con oro, produce la acetofenona esperada, pero con un catalizador especial de rutenio[4] el otro regioisómero 2-fenilacetaldehído:[5] El comportamiento anti-Markóvnikov también se puede manifestar en ciertas reacciones de transposición.
En una sustitución nucleofílica formal catalizada por cloruro de titanio (IV) en el compuesto 1 enantiopuro en el esquema seguido, se forman los dos productos racémicos 2a y 2b:[6] Esta distribución del producto puede ser racionalizada asumiendo que la pérdida del grupo hidroxilo en 1 produce el carbocatión terciario A, que se rearregla al aparentemente menos estable carbocatión secundario B.
El cloro puede aproximarse a este centro desde las dos caras, conduciendo a la mezcla observada de isómeros Sin embargo, tal vez el ejemplo más conocido de adición anti-Markóvnikov es la hidroboración.