Dicroísmo circular
[3] Este fenómeno fue descubierto por Jean-Baptiste Biot, Augustin Fresnel, y Aimé Cotton en la primera mitad del siglo XIX.
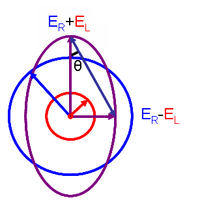
[2] Para la luz con polarización circular derecha (RCP), el vector eléctrico gira en el sentido de las agujas del reloj.
Cuando la luz polarizada circularmente atraviesa un medio ópticamente activo absorbente, las velocidades entre las polarizaciones derecha e izquierda difieren (cL ≠ cR) así como su longitud de onda (λL ≠ λR) y el grado de absorción (εL≠εR).
Es decir, los dos tipos de luz polarizada circularmente son absorbidos en diferente medida.
Por definición, donde ΔA (Delta Absorbancia) es la diferencia entre la absorbancia de la luz con polarización circular izquierda (LCP) y la luz con polarización circular derecha (RCP) (esto es lo que se suele medir).
También se puede expresar, aplicando la ley de Beer, como dónde Entonces es el dicroísmo circular molar.
Esta propiedad intrínseca es lo que se suele entender por dicroísmo circular de la sustancia.
En muchas aplicaciones prácticas del dicroísmo circular (DC), como se comenta a continuación, la DC medida no es simplemente una propiedad intrínseca de la molécula, sino que depende de la conformación molecular.
En este caso, la DC también puede ser una función de la temperatura, la concentración y el entorno químico, incluidos los disolventes.
En este caso, el valor de la DC notificado debe especificar también estos otros factores relevantes para que tenga sentido.
En este caso, la llamada quiralidad extrínseca 3d está asociada a la orientación mutua del haz de luz y la estructura.
El dicroísmo circular molar y la elipticidad molar, [θ], se interconvierten fácilmente mediante la ecuación: Esta relación se obtiene definiendo la elipticidad de la polarización como: dónde Cuando ER es igual a EL (cuando no hay diferencia en la absorbencia de la luz polarizada circularmente a la derecha y a la izquierda), θ es 0° y la luz está polarizada linealmente.
Los métodos para estimar la estructura secundaria en polímeros, proteínas y polipéptidos en particular, a menudo requieren que el espectro de elipticidad molar medido se convierta en un valor normalizado, específicamente un valor independiente de la longitud del polímero.
En consecuencia, las moléculas biológicas presentan dicroísmo circular, debido a sus componentes dextrógiros y levógiros.
Aún más importante es que una estructura secundaria también impartirá un DC distinto a sus respectivas moléculas.
El DC está estrechamente relacionada con la técnica de dispersión óptica rotatoria (ORD), y generalmente se considera más avanzada.
[13][14][15][16] Estas asignaciones fraccionarias imponen importantes restricciones a las posibles conformaciones secundarias en las que puede estar la proteína.
En general, el DC no puede decir dónde se encuentran las hélices alfa detectadas dentro de la molécula, ni siquiera predecir completamente cuántas hay.
Las señales obtenidas en la región de 250-300 nm se deben a la absorción, la orientación dipolar y la naturaleza del entorno de los aminoácidos fenilalanina, tirosina, cisteína (o puentes disulfuro S-S) y triptófano.
Más bien, los espectros de DC en UV cercano proporcionan información estructural sobre la naturaleza de los grupos prostéticos en las proteínas, por ejemplo, los grupos hemo en la hemoglobina y el citocromo c. La espectroscopia DC visible es una técnica muy potente para estudiar las interacciones metal-proteína y puede resolver transiciones electrónicas d-d individuales como bandas separadas.
La medición del DC también se complica por el hecho de que los sistemas tampón acuosos típicos suelen absorber en el rango en el que las características estructurales muestran una absorción diferencial de la luz polarizada circularmente.
Sin embargo, los disolventes orgánicos más comunes, como el acetonitrilo, el THF, el cloroformo y el diclorometano, son incompatibles con el DC de ultravioleta lejana.
Una vez eliminado el oxígeno, quizá el segundo factor técnico más importante para trabajar por debajo de 200 nm sea diseñar el resto del sistema óptico para que tenga bajas pérdidas en esta región.
En este sentido, es fundamental el uso de espejos aluminizados cuyos revestimientos hayan sido optimizados para tener bajas pérdidas en esta región del espectro.
[19] A nivel mecánico cuántico, la densidad de características del dicroísmo circular y la rotación óptica son idénticas.
La dispersión óptica rotativa y el dicroísmo circular comparten el mismo contenido de información cuántica.
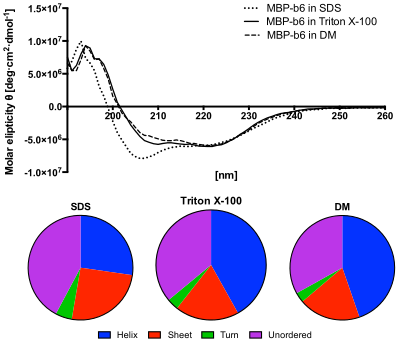
Panel inferior: El contenido de las estructuras secundarias predichas a partir de los espectros de DC utilizando el algoritmo CDSSTR. La proteína en solución SDS muestra un mayor contenido de estructuras desordenadas y un menor contenido de hélices. [ 12 ]