Óxido de zinc
El ZnO puro es un polvo blanco, en la naturaleza se encuentra de manera natural como el mineral cincita, el cual usualmente contiene manganeso y otras impurezas que le confieren un color entre amarillo y rojo.
Debido a la polaridad de los enlaces Zn-O, los niveles del Zinc y el oxígeno están eléctricamente cargados.
Para mantener la neutralidad eléctrica, esos niveles se reconstruyen en el nivel atómico de la mayoría de los materiales relativos, pero no para el ZnO -sus superficies son atómicamente planas, estables y no presentan reconstrucción.
[20] Esta propiedad lo hace un material de importancia tecnológica para diversas aplicaciones piezoeléctricas, las cuales requieren una amplia unión electromecánica.
El ZnO tiene un “band gap” relativamente amplio de ~3,3 eV a temperatura ambiente.
La no estequiometria es típicamente el origen del carácter de tipo n, pero el tema sigue siendo controvertido.
[22] La adición de impurezas de tipo n es controlable cuando se substituye el Zn con elementos del grupo III, tales como Al, Ga, In o al sustituir el oxígeno con elementos del grupo VII como cloro o yodo.
Sin embargo, muchos de estos elementos son receptores y no producen conducción tipo p significativa a temperatura ambiente.
El vapor de zinc reacciona con el oxígeno del aire para formar el ZnO, acompañado por un descenso en su temperatura y luminiscencia brillante.
Este método indirecto se popularizó gracias a LeClaire (Francia) en 1844 y por ello es comúnmente conocido como el proceso francés.
Después el precipitado es filtrado, lavado, secado y calcinado a temperaturas de aproximadamente 800 °C.
Cristales individuales grandes (muchos centímetros cúbicos) pueden ser desarrollados por transporte de gas (deposición en fase vapor), síntesis hidrotérmica[17][27][28] o por fusión.
Sin embargo, debido a la alta presión de vapor del ZnO, producirlo por fusión es problemático.
[17][29] Las nanoestructuras como barras del ZnO pueden ser producidas por métodos acuosos, los cuales son baratos, escalables y amigables con el ambiente.
Además, existen una variedad de parámetros que pueden ser sintonizados para controlar efectivamente la morfología y las propiedades del producto final.
Este era presuntamente hecho de la misma forma y usado para producir latón.
Por lo tanto, es añadido a materiales y productos incluyendo plásticos, cerámicas, cristales, cemento,[47] caucho, lubricantes,[3] pinturas, ungüentos, adhesivos, selladores, fabricación de hormigón, pigmentos, comidas, baterías, ferritas, retardadores de fuego, etc.[48] Entre el 50% y el 60% del ZnO es usado en la industria del caucho.
[49] El óxido de Zinc junto con el ácido esteárico es usado en la vulcanización del caucho.
[18][50][51] La adición del ZnO también protege al caucho de hongos (ver aplicaciones médicas) y luz UV.
Sin embargo, de cantidades moderadas a altas, produce superficies mate y cristalinas.
Se ha demostrado que el ZnO nano que tiene un tamaño promedio de 20 nm y 45 nm puede mejorar la actividad antibacterial de la ciprofloxacina contra Staphylococcus aureus y Escherichia coli in vitro.
[72] Ha reemplazado al blanco de plomo y fue usado por pintores como Böcklin, Van Gogh,[73] Manet, Munch, entre otros.
Los revestimientos ZnO:Al son utilizados para ventanas que ahorran energía o protegen del calor.
La reducción es necesaria pues el 64Zn es transformado en 65Zn radiactivo bajo irradiación por los neutrones del reactor.
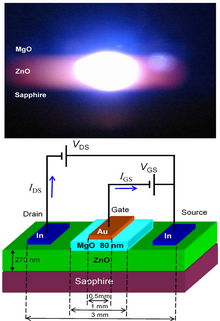
[81] El ZnO tiene un amplio y directo “band gap” (3.37 eV o 375 nm a temperatura ambiente).
Comparado con el GaN el ZnO tiene más energía de enlace en los excitones (~60 meV, 2.4 veces de la energía térmica a temperatura ambiente), lo que resulta en una emisión brillante a temperatura ambiente del ZnO.
[86] La resistencia a la radiación[87] hace al ZnO un candidato adecuado para aplicaciones en el espacio.
[88] Las capas de ZnO dopadas con aluminio son usadas como electrodos transparentes.
Ese ferromagnetismo a temperatura ambiente ha sido observado con la unión ZnO:Mn,[94] pero no es claro aún si se originó de la matriz por sí misma o por fases secundarias de óxido.
Por esta razón, típicamente el acero galvanizado no es soldado, o el zinc se remueve primero.