
La vía MAPK/ERK (también conocida como vía Ras-Raf-MEK-ERK ) es una cadena de proteínas en la célula que comunica una señal desde un receptor en la superficie de la célula al ADN en el núcleo de la célula.
La señal comienza cuando una molécula de señalización se une al receptor en la superficie celular y termina cuando el ADN en el núcleo expresa una proteína y produce algún cambio en la célula, como la división celular . La vía incluye muchas proteínas, como las proteínas quinasas activadas por mitógenos (MAPK), originalmente llamadas quinasas reguladas por señales extracelulares (ERK), que se comunican añadiendo grupos fosfato a una proteína vecina ( fosforilándola ), actuando así como un "encendido". o interruptor de "apagado".
Cuando una de las proteínas de la vía sufre una mutación, puede quedar atrapada en la posición "encendido" o "apagado", un paso necesario en el desarrollo de muchos cánceres. De hecho, los componentes de la vía MAPK/ERK se descubrieron por primera vez en células cancerosas, y se están investigando medicamentos que invierten el interruptor de "encendido" o "apagado" como tratamientos contra el cáncer. [1]
La señal que inicia la vía MAPK/ERK es la unión del mitógeno extracelular a un receptor de la superficie celular . Esto permite que una proteína Ras (una GTPasa pequeña ) intercambie una molécula de GDP por una molécula de GTP , activando el "interruptor de encendido/apagado" de la vía. La proteína Ras puede entonces activar MAP3K (p. ej., Raf ), que activa MAP2K , que activa MAPK . Finalmente, MAPK puede activar un factor de transcripción , como Myc . Este proceso se describe con más detalle a continuación.
Las tirosina quinasas ligadas a receptores , como el receptor del factor de crecimiento epidérmico (EGFR), son activadas por ligandos extracelulares , como el factor de crecimiento epidérmico (EGF). La unión de EGF al EGFR activa la actividad tirosina quinasa del dominio citoplasmático del receptor. El EGFR se fosforila en residuos de tirosina. Las proteínas de acoplamiento como GRB2 contienen un dominio SH2 que se une a los residuos de fosfotirosina del receptor activado. [2] GRB2 se une al factor de intercambio de nucleótidos de guanina SOS mediante los dos dominios SH3 de GRB2. Cuando el complejo GRB2-SOS se acopla al EGFR fosforilado, SOS se activa. [3] El SOS activado promueve la eliminación del GDP de un miembro de la subfamilia Ras (más notablemente H-Ras o K-Ras ). La proteína Ras puede entonces unirse al GTP y volverse activa.
Además de EGFR, otros receptores de la superficie celular que pueden activar esta vía a través de GRB2 incluyen Trk A/B , el receptor del factor de crecimiento de fibroblastos (FGFR) y PDGFR .
Ras activado luego activa la actividad de la proteína quinasa de una quinasa RAF . [4] La quinasa RAF fosforila y activa una quinasa MAPK/ERK ( MEK1 o MEK2 ). La MEK fosforila y activa una proteína quinasa activada por mitógenos (MAPK).
RAF y MAPK/ERK son proteínas quinasas específicas de serina/treonina . MEK es una serina/tirosina/treonina quinasa.
En un sentido técnico, RAF, MEK y MAPK son todas quinasas activadas por mitógenos , al igual que MNK (ver más abajo). Las MAPK se denominaron originalmente " quinasas reguladas por señales extracelulares " (ERK) y "proteínas quinasas asociadas a microtúbulos" (MAPK). Una de las primeras proteínas que se sabe que fue fosforilada por ERK fue una proteína asociada a microtúbulos (MAP). Como se analiza más adelante, más tarde se encontraron muchos objetivos adicionales para la fosforilación por MAPK y la proteína pasó a llamarse "proteína quinasa activada por mitógenos" (MAPK). La serie de quinasas desde RAF hasta MEK y MAPK es un ejemplo de cascada de proteína quinasa . Estas series de quinasas brindan oportunidades para la regulación de la retroalimentación y la amplificación de la señal.

En la figura de la derecha se muestran tres de las muchas proteínas fosforiladas por MAPK. Un efecto de la activación de MAPK es alterar la traducción del ARNm a proteínas. "MAPK fosforila la proteína ribosómica S6 quinasa (RSK) 40S" . Esto activa RSK, que, a su vez, fosforila la proteína ribosómica S6 . [5] Las proteínas quinasas activadas por mitógenos que fosforilan la proteína ribosómica S6 fueron las primeras en aislarse. [4]
MAPK regula las actividades de varios factores de transcripción . MAPK puede fosforilar C-myc . MAPK fosforila y activa MNK, que, a su vez, fosforila CREB . MAPK también regula la transcripción del gen C-Fos . Al alterar los niveles y las actividades de los factores de transcripción, MAPK conduce a una transcripción alterada de genes que son importantes para el ciclo celular .
Los genes 22q11, 1q42 y 19p13, al afectar la vía ERK, se asocian con esquizofrenia , trastorno esquizoafectivo , trastorno bipolar y migrañas .
Papel de la señalización de mitógenos en la progresión del ciclo celular.
La vía ERK desempeña un papel importante en la integración de señales externas de la presencia de mitógenos, como el factor de crecimiento epidérmico (EGF), en eventos de señalización que promueven el crecimiento y la proliferación celular en muchos tipos de células de mamíferos. En un modelo simplificado, la presencia de mitógenos y factores de crecimiento desencadena la activación de receptores tirosina quinasas canónicos como EGFR, lo que lleva a su dimerización y posterior activación de la pequeña GTPasa Ras. [6] Esto luego conduce a una serie de eventos de fosforilación aguas abajo en la cascada MAPK (Raf-MEK-ERK), lo que finalmente resulta en la fosforilación y activación de ERK. La fosforilación de ERK da como resultado una activación de su actividad quinasa y conduce a la fosforilación de sus numerosos objetivos implicados en la regulación de la proliferación celular. En la mayoría de las células, se requiere alguna forma de actividad sostenida de ERK para que las células activen genes que inducen la entrada al ciclo celular y suprimen los reguladores negativos del ciclo celular. Dos de estos objetivos importantes incluyen los complejos de ciclina D con Cdk4 y Cdk6 (Cdk4/6), ambos fosforilados por ERK. [7] La transición de la fase G1 a la fase S está coordinada por la actividad de la ciclina D-Cdk4/6, que aumenta durante la fase G1 tardía a medida que las células se preparan para entrar en la fase S en respuesta a los mitógenos. La activación de Cdk4/6 contribuye a la hiperfosforilación y la posterior desestabilización de la proteína del retinoblastoma (Rb). [7] La Rb hipofosforilada normalmente se une al factor de transcripción E2F en las etapas iniciales de G1 e inhibe su actividad transcripcional, previniendo la expresión de genes de entrada en la fase S, incluidos la ciclina E, la ciclina A2 y la Emi1. [6] La activación de ERK1/2 aguas abajo de la señalización de Ras inducida por mitógenos es necesaria y suficiente para eliminar este bloqueo del ciclo celular y permitir que las células progresen a la fase S en la mayoría de las células de mamíferos.

Control de retroalimentación aguas abajo y generación de un interruptor biestable G1/S
El punto de restricción (punto R) marca el evento crítico cuando una célula de mamífero se compromete a proliferar y se vuelve independiente de la estimulación del crecimiento. Es fundamental para la diferenciación normal y la homeostasis de los tejidos, y parece estar desregulado en prácticamente todos los cánceres. Aunque el punto R se ha relacionado con diversas actividades implicadas en la regulación de la transición G1-S del ciclo celular de los mamíferos, el mecanismo subyacente sigue sin estar claro. Utilizando mediciones unicelulares, Yao et al., muestran que la vía Rb-E2F funciona como un interruptor biestable para convertir entradas de suero graduadas en respuestas E2F de todo o nada. [8]
Las señales de crecimiento y mitógenos se transmiten aguas abajo de la vía ERK y se incorporan en múltiples bucles de retroalimentación positiva para generar un interruptor biestable al nivel de activación de E2F. [8] Esto ocurre debido a tres interacciones principales durante la última fase G1. El primero es el resultado de la estimulación de mitógenos a través de ERK que conduce a la expresión del factor de transcripción Myc, que es un activador directo de E2F. [7] La segunda vía es el resultado de la activación de ERK que conduce a la acumulación de complejos activos de ciclina D y Cdk4/6 que desestabilizan Rb mediante fosforilación y además sirven para activar E2F y promover la expresión de sus objetivos. Finalmente, todas estas interacciones se ven reforzadas por un circuito de retroalimentación positiva adicional de E2F sobre sí mismo, ya que su propia expresión conduce a la producción del complejo activo de ciclina E y CDK2, que además sirve para bloquear la decisión de una célula de entrar en la fase S. Como resultado, cuando la concentración sérica aumenta de manera gradual, la mayoría de las células de mamíferos responden como un interruptor al entrar en la fase S. Este interruptor E2F biestable estimulado por mitógenos muestra histéresis, ya que se inhibe que las células regresen a G1 incluso después de la retirada de mitógenos después de la activación de E2F. [8]
Procesamiento dinámico de señales mediante la vía ERK
La vía EGFR-ERK/MAPK (quinasa regulada extracelularmente/proteína quinasa activada por mitógenos del receptor del factor de crecimiento epidérmico) estimulada por EGF es crítica para la proliferación celular, pero la separación temporal entre señal y respuesta oscurece la señal -Relación respuesta en investigaciones anteriores. En 2013, Albeck et al. [9] proporcionó evidencia experimental clave para llenar este vacío de conocimiento. Midieron la intensidad y la dinámica de la señal con estimulación EGF en estado estacionario, en el que la señalización y la salida se pueden relacionar fácilmente. Además, mapearon la relación señal-respuesta en todo el rango dinámico de la vía. Utilizando la detección por inmunofluorescencia de alto contenido (HCIF) de ERK fosforilada (pERK) y biosensores FRET de células vivas, monitorearon la salida posterior de la vía ERK tanto en células vivas como en células fijadas. Para vincular aún más las características cuantitativas de la señalización de ERK con las tasas de proliferación, establecieron una serie de condiciones de estado estacionario utilizando un rango de concentraciones de EGF aplicando EGF con diferentes concentraciones.
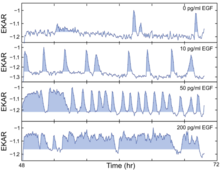
Los experimentos de imágenes de células individuales han demostrado que ERK se activa en ráfagas estocásticas en presencia de EGF. Además, se ha demostrado que la vía codifica la intensidad de las entradas de señalización a través de pulsos de frecuencia modulada de su actividad. Utilizando biosensores FRET de células vivas, las células inducidas con diferentes concentraciones de actividad ilícita de EGF explotaron de diferente frecuencia, donde niveles más altos de EGF dieron como resultado explosiones más frecuentes de actividad ERK. Para descubrir cómo la entrada en la fase S puede verse afectada por pulsos esporádicos de actividad de ERK en concentraciones bajas de EGF, utilizaron células MCF-10A que coexpresan EKAR-EV y RFP-geminina e identificaron los pulsos de actividad de ERK con la puntuación y luego los alinearon. Este perfil de actividad de ERK con el tiempo de inducción de GFP-geminin. Descubrieron que períodos más prolongados de actividad ERK estimulan la entrada a la fase S, como lo sugiere el aumento de la longitud del pulso. Para comprender la dinámica de la vía EGFR-ERK, específicamente cómo se modula la frecuencia y la amplitud, aplicaron el inhibidor de EGFR gefitinib o el inhibidor altamente selectivo de la quinasa MAPK/ERK (MEK) PD0325901 (PD). En realidad, dos inhibidores producen resultados un poco diferentes: gefitinib, en una concentración intermedia, induciría un comportamiento pulsatorio y también un cambio bimodal, lo que no se observa en la EP. Además, combinan EGF y PD y llegan a la conclusión de que la frecuencia de las actividades de ERK está modulada por la variación cuantitativa, mientras que la amplitud está modulada por el cambio de la actividad de MEK. Por último, recurrieron a Fra-1, uno de los efectores posteriores de la vía ERK, ya que es técnicamente difícil estimar las actividades de ERK directamente. Para comprender cómo la salida integrada de la vía ERK (que debería ser independiente de la frecuencia o la amplitud) afecta la tasa de proliferación, utilizaron la combinación de una amplia gama de concentraciones de EGF y PD y descubrieron que en realidad hay una única forma curvilínea en forma de "L" invertida. relación, lo que sugiere que a niveles bajos de salida de la vía ERK, pequeños cambios en la intensidad de la señal corresponden a grandes cambios en la tasa proliferativa, mientras que grandes cambios en la intensidad de la señal cerca del extremo superior del rango dinámico tienen poco impacto en la proliferación. La fluctuación de la señalización de ERK resalta problemas potenciales con los enfoques terapéuticos actuales, proporcionando una nueva perspectiva en términos de pensamiento sobre la dirección de fármacos en la vía ERK en el cáncer.
Integración de mitógenos y señales de estrés en la proliferación.
Experimentos recientes de imágenes de células vivas en células MCF10A y MCF7 han demostrado que una combinación de señalización de mitógenos a través de ERK y señales de estrés a través de la activación de p53 en células madre contribuye a la probabilidad de que las células hijas recién formadas reingresen inmediatamente al ciclo celular o entren. quiescencia (G0) que precede a la mitosis. [10] En lugar de que las células hijas comiencen sin proteínas de señalización clave después de la división, el ARNm de ciclina D1 inducido por mitógenos/ERK y la proteína p53 inducida por daños en el ADN, ambos factores de larga vida en las células, pueden heredarse de manera estable de las células madre después de la división celular. Los niveles de estos reguladores varían de una célula a otra después de la mitosis y la estequiometría entre ellos influye fuertemente en el compromiso del ciclo celular mediante la activación de Cdk2. Las perturbaciones químicas que utilizan inhibidores de la señalización de ERK o inductores de la señalización de p53 en las células madre sugieren que las células hijas con altos niveles de proteína p53 y bajos niveles de transcripciones de ciclina D1 ingresan principalmente a G0, mientras que las células con altos niveles de ciclina D1 y bajos niveles de p53 son las más probables. para volver a entrar en el ciclo celular. Estos resultados ilustran una forma de memoria molecular codificada a través de la historia de la señalización de mitógenos a través de ERK y la respuesta al estrés a través de p53. [11] [12]
El crecimiento descontrolado es un paso necesario para el desarrollo de todos los cánceres. [13] En muchos cánceres (por ejemplo, melanoma ), un defecto en la vía MAP/ERK conduce a ese crecimiento descontrolado. Muchos compuestos pueden inhibir pasos en la vía MAP/ERK y, por lo tanto, son fármacos potenciales para tratar el cáncer, [14] [15] [16] [17] [18] como la enfermedad de Hodgkin . [19]
El primer fármaco autorizado para actuar en esta vía es el sorafenib , un inhibidor de la quinasa Raf . Otros inhibidores de Raf incluyen SB590885, PLX4720, XL281, RAF265, encorafenib , dabrafenib y vemurafenib . [18]
Algunos inhibidores de MEK incluyen cobimetinib , CI-1040, PD0325901, binimetinib (MEK162), selumetinib , [18] y trametinib (GSK1120212) [20].
Se ha descubierto que la moxibustión del punto de acupuntura tiene un papel en el alivio de la lesión de la mucosa gástrica inducida por el alcohol en un modelo de ratón, lo que puede estar estrechamente asociado con sus efectos en la regulación positiva de las actividades de la vía de transducción de señales del factor de crecimiento epidérmico/ERK. [21]
La vía RAF-ERK también participa en la fisiopatología del síndrome de Noonan , una enfermedad polimalformativa.
El análisis de microarrays de proteínas se puede utilizar para detectar cambios sutiles en la actividad de las proteínas en las vías de señalización. [22] Los síndromes del desarrollo causados por mutaciones de la línea germinal en genes que alteran los componentes RAS de la vía de transducción de señales MAP/ERK se denominan RASopatías .
{{cite journal}}: Citar diario requiere |journal=( ayuda )