El cáncer colorrectal ( CCR ), también conocido como cáncer de intestino , cáncer de colon o cáncer rectal , es el desarrollo de cáncer del colon o recto (partes del intestino grueso ). [5] Los signos y síntomas pueden incluir sangre en las heces , un cambio en los movimientos intestinales , pérdida de peso, dolor abdominal y fatiga. [9] La mayoría de los cánceres colorrectales se deben a factores de estilo de vida y trastornos genéticos. [2] [3] Los factores de riesgo incluyen la dieta, la obesidad , el tabaquismo y la falta de actividad física . [2] Los factores dietéticos que aumentan el riesgo incluyen la carne roja , la carne procesada y el alcohol . [2] [4] Otro factor de riesgo es la enfermedad inflamatoria intestinal , que incluye la enfermedad de Crohn y la colitis ulcerosa . [2] Algunos de los trastornos genéticos hereditarios que pueden causar cáncer colorrectal incluyen la poliposis adenomatosa familiar y el cáncer de colon hereditario sin poliposis ; sin embargo, estos representan menos del 5% de los casos. [2] [3] Generalmente comienza como un tumor benigno , a menudo en forma de pólipo , que con el tiempo se vuelve canceroso . [2]
El cáncer colorrectal se puede diagnosticar obteniendo una muestra del colon durante una sigmoidoscopia o colonoscopia . [1] A esto le sigue una prueba de imagen médica para determinar si la enfermedad se ha propagado. [5] La detección es eficaz para prevenir y reducir las muertes por cáncer colorrectal. [10] La detección, mediante uno de varios métodos, se recomienda a partir de los 45 a 75 años. Se recomendaba a partir de los 50 años, pero se cambió a los 45 debido al aumento de la cantidad de cánceres de colon. [10] [11] Durante la colonoscopia, se pueden extirpar pequeños pólipos si se encuentran. [2] Si se encuentra un pólipo o tumor grande, se puede realizar una biopsia para verificar si es canceroso. La aspirina y otros medicamentos antiinflamatorios no esteroides disminuyen el riesgo de dolor durante la escisión de pólipos. [2] [12] Sin embargo, su uso general no se recomienda para este propósito debido a los efectos secundarios. [13]
Los tratamientos utilizados para el cáncer colorrectal pueden incluir alguna combinación de cirugía, radioterapia , quimioterapia y terapia dirigida . [5] Los cánceres que están confinados dentro de la pared del colon pueden ser curables con cirugía, mientras que el cáncer que se ha diseminado ampliamente generalmente no es curable, y el tratamiento se dirige a mejorar la calidad de vida y los síntomas. [5] La tasa de supervivencia a cinco años en los Estados Unidos fue de alrededor del 65% en 2014. [6] La probabilidad individual de supervivencia depende de qué tan avanzado esté el cáncer, si se puede extirpar o no todo el cáncer con cirugía y la salud general de la persona. [1] A nivel mundial, el cáncer colorrectal es el tercer tipo de cáncer más común y representa aproximadamente el 10% de todos los casos. [14] En 2018, hubo 1,09 millones de casos nuevos y 551 000 muertes por la enfermedad. [8] Es más común en los países desarrollados , donde se encuentran más del 65% de los casos. [2] Es menos común en mujeres que en hombres. [2]
Los signos y síntomas del cáncer colorrectal dependen de la ubicación del tumor en el intestino y de si se ha diseminado a otras partes del cuerpo ( metástasis ). Los signos de advertencia clásicos incluyen: empeoramiento del estreñimiento , sangre en las heces , disminución del calibre (grosor) de las heces, pérdida de apetito, pérdida de peso y náuseas o vómitos en alguien mayor de 50 años. [15] Alrededor del 50% de las personas que tienen cáncer colorrectal no informan ningún síntoma. [16]
El sangrado rectal o la anemia son síntomas de alto riesgo en personas mayores de 50 años. [17] La pérdida de peso y los cambios en los hábitos intestinales de una persona suelen ser preocupantes solo si están asociados con sangrado rectal. [17] [18]
Entre el 75 y el 95 % de los casos de cáncer colorrectal se dan en personas con poco o ningún riesgo genético. [19] [20] Los factores de riesgo incluyen la edad avanzada, el sexo masculino, [20] la ingesta elevada de grasas, azúcar , alcohol , carnes rojas , carnes procesadas , obesidad , tabaquismo y falta de ejercicio físico . [19] [21] La Calculadora de Supervivencia del Cáncer Rectal desarrollada por el MD Anderson Cancer Center también considera la raza como un factor de riesgo; sin embargo, existen cuestiones de equidad sobre si esto podría conducir a una inequidad en la toma de decisiones clínicas. [22] [23] Aproximadamente el 10 % de los casos están relacionados con una actividad insuficiente. [24] El riesgo del alcohol parece aumentar con más de una bebida al día. [25] Beber cinco vasos de agua al día está relacionado con una disminución del riesgo de cáncer colorrectal y pólipos adenomatosos . [26] Streptococcus gallolyticus está asociado con el cáncer colorrectal. [27] Millones de personas consumen diariamente algunas cepas del complejo Streptococcus bovis/Streptococcus equinus , por lo que pueden ser seguras. [28] Entre el 25 y el 80 % de las personas con bacteriemia por Streptococcus bovis/gallolyticus tienen tumores colorrectales concomitantes. [29] La seroprevalencia de Streptococcus bovis/gallolyticus se considera un marcador práctico candidato para la predicción temprana de una lesión intestinal subyacente en la población de alto riesgo. [29] Se ha sugerido que la presencia de anticuerpos contra antígenos de Streptococcus bovis/gallolyticus o los propios antígenos en el torrente sanguíneo pueden actuar como marcadores de la carcinogénesis en el colon. [29]
La Escherichia coli patógena puede aumentar el riesgo de cáncer colorrectal al producir el metabolito genotóxico , colibactina . [30]
Las personas con enfermedad inflamatoria intestinal ( colitis ulcerosa y enfermedad de Crohn ) tienen un mayor riesgo de cáncer de colon. [31] [32] El riesgo aumenta cuanto más tiempo una persona tiene la enfermedad y peor es la gravedad de la inflamación. [33] En estos grupos de alto riesgo, se recomiendan tanto la prevención con aspirina como las colonoscopias regulares . [34] La vigilancia endoscópica en esta población de alto riesgo puede reducir el desarrollo de cáncer colorrectal a través del diagnóstico temprano y también puede reducir las probabilidades de morir de cáncer de colon. [34] Las personas con enfermedad inflamatoria intestinal representan menos del 2% de los casos de cáncer de colon al año. [33] En aquellos con enfermedad de Crohn, el 2% desarrolla cáncer colorrectal después de 10 años, el 8% después de 20 años y el 18% después de 30 años. [33] En las personas que tienen colitis ulcerosa, aproximadamente el 16% desarrolla un precursor de cáncer o cáncer de colon durante 30 años. [33]
Las personas con antecedentes familiares en dos o más parientes de primer grado (como un padre o un hermano) tienen un riesgo dos o tres veces mayor de padecer la enfermedad, y este grupo representa alrededor del 20% de todos los casos. Una serie de síndromes genéticos también se asocian con tasas más altas de cáncer colorrectal. El más común de ellos es el cáncer colorrectal hereditario no asociado a poliposis (HNPCC o síndrome de Lynch), que está presente en alrededor del 3% de las personas con cáncer colorrectal. [20] Otros síndromes que están fuertemente asociados con el cáncer colorrectal incluyen el síndrome de Gardner y la poliposis adenomatosa familiar (FAP). [35] Para las personas con estos síndromes, el cáncer casi siempre ocurre y representa el 1% de los casos de cáncer. [36] Se puede recomendar una proctocolectomía total para las personas con FAP como medida preventiva debido al alto riesgo de malignidad. La colectomía, la extirpación del colon, puede no ser suficiente como medida preventiva debido al alto riesgo de cáncer rectal si el recto permanece. [37] El síndrome de poliposis más común que afecta al colon es el síndrome de poliposis serrada , [38] que se asocia con un riesgo de CCR del 25-40%. [39]
Las mutaciones en el par de genes ( POLE y POLD1 ) se han asociado con el cáncer de colon familiar. [40]
La mayoría de las muertes por cáncer de colon están asociadas con la enfermedad metastásica. Se ha aislado un gen que parece contribuir al potencial de enfermedad metastásica, la metástasis asociada al cáncer de colon 1 ( MACC1 ). [41] Es un factor transcripcional que influye en la expresión del factor de crecimiento de hepatocitos . Este gen está asociado con la proliferación, invasión y dispersión de células de cáncer de colon en cultivos celulares , y con el crecimiento tumoral y la metástasis en ratones. MACC1 puede ser un objetivo potencial para la intervención contra el cáncer, pero esta posibilidad necesita ser confirmada con estudios clínicos. [42]
Los factores epigenéticos , como la metilación anormal del ADN de los promotores supresores de tumores , desempeñan un papel en el desarrollo del cáncer colorrectal. [43]
Los judíos asquenazíes tienen un riesgo 6% mayor de desarrollar adenomas y luego cáncer de colon debido a que las mutaciones en el gen APC son más comunes. [44]
El cáncer colorrectal es una enfermedad que se origina en las células epiteliales que recubren el colon o el recto del tracto gastrointestinal , con mayor frecuencia como resultado de mutaciones genéticas en la vía de señalización Wnt que aumenta la actividad de señalización. [45] La vía de señalización Wnt normalmente juega un papel importante para el funcionamiento normal de estas células, incluido el mantenimiento de este revestimiento. Las mutaciones pueden ser heredadas o adquiridas , y lo más probable es que ocurran en la célula madre de la cripta intestinal . [46] [47] [48] El gen mutado más comúnmente en todos los cánceres colorrectales es el gen APC , que produce la proteína APC. [45] La proteína APC previene la acumulación de la proteína β-catenina . Sin APC, la β-catenina se acumula en niveles altos y se transloca (se mueve) al núcleo , se une al ADN y activa la transcripción de protooncogenes . Estos genes normalmente son importantes para la renovación y diferenciación de las células madre, pero cuando se expresan de manera inapropiada en niveles altos, pueden causar cáncer. [45] Si bien el APC está mutado en la mayoría de los cánceres de colon, algunos cánceres tienen un aumento de β-catenina debido a mutaciones en β-catenina (CTNNB1) que bloquean su propia degradación, o tienen mutaciones en otros genes con funciones similares al APC, como AXIN1 , AXIN2 , TCF7L2 o NKD1 . [49]
Además de los defectos en la vía de señalización Wnt , deben ocurrir otras mutaciones para que la célula se vuelva cancerosa. La proteína p53 , producida por el gen TP53 , normalmente controla la división celular e induce su muerte programada si tienen defectos en la vía Wnt. Finalmente, una línea celular adquiere una mutación en el gen TP53 y transforma el tejido de un tumor epitelial benigno en un cáncer de células epiteliales invasivo . A veces, el gen que codifica p53 no está mutado, sino otra proteína protectora llamada BAX . [49]
Otras proteínas responsables de la muerte celular programada que se desactivan comúnmente en los cánceres colorrectales son TGF-β y DCC ( Deleted in Colorectal Cancer ). TGF-β tiene una mutación desactivadora en al menos la mitad de los cánceres colorrectales. A veces TGF-β no se desactiva, pero una proteína dependiente llamada SMAD sí lo está. [49] DCC comúnmente tiene un segmento eliminado de un cromosoma en el cáncer colorrectal. [50]
Aproximadamente el 70% de todos los genes humanos se expresan en el cáncer colorrectal, y poco más del 1% de ellos tienen una expresión aumentada en el cáncer colorrectal en comparación con otras formas de cáncer. [51] Algunos genes son oncogenes : se sobreexpresan en el cáncer colorrectal. Por ejemplo, los genes que codifican las proteínas KRAS , RAF y PI3K , que normalmente estimulan la división celular en respuesta a factores de crecimiento, pueden adquirir mutaciones que resultan en una sobreactivación de la proliferación celular. El orden cronológico de las mutaciones a veces es importante. Si se produjo una mutación previa de APC, una mutación primaria de KRAS a menudo progresa a cáncer en lugar de una lesión hiperplásica o limítrofe autolimitante. [52] PTEN , un supresor tumoral, normalmente inhibe PI3K, pero a veces puede mutar y desactivarse. [49]
Un análisis exhaustivo a escala del genoma ha revelado que los carcinomas colorrectales se pueden clasificar en tipos de tumores hipermutados y no hipermutados. [53] Además de las mutaciones oncogénicas e inactivadoras descritas para los genes anteriores, las muestras no hipermutadas también contienen CTNNB1 , FAM123B , SOX9 , ATM y ARID1A mutados . Al progresar a través de un conjunto distinto de eventos genéticos, los tumores hipermutados muestran formas mutadas de ACVR2A , TGFBR2 , MSH3 , MSH6 , SLC9A9, TCF7L2 y BRAF . El tema común entre estos genes, en ambos tipos de tumores, es su participación en las vías de señalización de Wnt y TGF-β, lo que resulta en una mayor actividad de MYC , un actor central en el cáncer colorrectal. [53]
Los tumores deficientes en reparación de desajustes (MMR) se caracterizan por una cantidad relativamente alta de repeticiones en tándem de polinucleótidos . [54] Esto es causado por una deficiencia en las proteínas MMR, que generalmente son causadas por silenciamiento epigenético y/o mutaciones hereditarias ( por ejemplo , síndrome de Lynch ). [55] Entre el 15 y el 18 por ciento de los tumores de cáncer colorrectal tienen deficiencias de MMR, y el 3 por ciento se desarrolla debido al síndrome de Lynch. [56] El papel del sistema de reparación de desajustes es proteger la integridad del material genético dentro de las células ( es decir , detectar y corregir errores). [55] En consecuencia, una deficiencia en las proteínas MMR puede conducir a una incapacidad para detectar y reparar el daño genético, lo que permite que se produzcan más mutaciones causantes de cáncer y que el cáncer colorrectal progrese. [55]
La secuencia de progresión de pólipo a cáncer es el modelo clásico de la patogénesis del cáncer colorrectal . [57] En esta secuencia de adenoma-carcinoma , [58] las células epiteliales normales progresan a células displásicas como adenomas , y luego a carcinoma, mediante un proceso de mutación genética progresiva. [59] En el centro de la secuencia de pólipo a CRC están las mutaciones genéticas, las alteraciones epigenéticas y los cambios inflamatorios locales. [57] La secuencia de pólipo a CRC se puede utilizar como un marco subyacente para ilustrar cómo los cambios moleculares específicos conducen a varios subtipos de cáncer. [57]

El término "cancerización de campo" se utilizó por primera vez en 1953 para describir un área o "campo" de epitelio que ha sido preacondicionado (por procesos en gran parte desconocidos en ese momento) para predisponerlo al desarrollo de cáncer. [60] Desde entonces, los términos "cancerización de campo", "carcinogénesis de campo", "defecto de campo" y " efecto de campo " se han utilizado para describir tejido premaligno o preneoplásico en el que es probable que surjan nuevos cánceres. [61]
Los defectos de campo son importantes en la progresión al cáncer de colon. [62] [63]
Sin embargo, como señala Rubin, "la gran mayoría de los estudios en investigación del cáncer se han realizado en tumores bien definidos in vivo o en focos neoplásicos discretos in vitro . Sin embargo, hay evidencia de que más del 80% de las mutaciones somáticas encontradas en tumores colorrectales humanos de fenotipo mutador ocurren antes del inicio de la expansión clonal terminal". [64] [65] De manera similar, Vogelstein et al. [66] señalaron que más de la mitad de las mutaciones somáticas identificadas en tumores ocurrieron en una fase preneoplásica (en un defecto de campo), durante el crecimiento de células aparentemente normales. Asimismo, las alteraciones epigenéticas presentes en los tumores pueden haber ocurrido en defectos de campo preneoplásicos. [67]
Una visión ampliada del efecto de campo se ha denominado "efecto de campo etiológico", que abarca no sólo los cambios moleculares y patológicos en las células preneoplásicas sino también las influencias de factores ambientales exógenos y los cambios moleculares en el microambiente local en la evolución neoplásica desde la iniciación del tumor hasta la muerte. [68]
Las alteraciones epigenéticas son mucho más frecuentes en el cáncer de colon que las alteraciones genéticas (mutacionales). Como describen Vogelstein et al., [66] un cáncer de colon promedio tiene sólo 1 o 2 mutaciones de oncogenes y de 1 a 5 mutaciones supresoras de tumores (en conjunto denominadas "mutaciones impulsoras"), con alrededor de 60 mutaciones "pasajeras" más. Los oncogenes y los genes supresores de tumores están bien estudiados y se describen más arriba en Patogenia. [69] [70]
Además de la alteración epigenética de la expresión de los miRNA, otros tipos comunes de alteraciones epigenéticas en los cánceres que cambian los niveles de expresión génica incluyen la hipermetilación o hipometilación directa de las islas CpG de los genes que codifican proteínas y las alteraciones en las histonas y la arquitectura cromosómica que influyen en la expresión génica. [71] Como ejemplo, 147 hipermetilaciones y 27 hipometilaciones de genes que codifican proteínas se asociaron con frecuencia con cánceres colorrectales. De los genes hipermetilados, 10 estaban hipermetilados en el 100% de los cánceres de colon, y muchos otros estaban hipermetilados en más del 50% de los cánceres de colon. [72] Además, 11 hipermetilaciones y 96 hipometilaciones de miRNA también se asociaron con cánceres colorrectales. [72] La metilación anormal (aberrante) ocurre como una consecuencia normal del envejecimiento normal y el riesgo de cáncer colorrectal aumenta a medida que una persona envejece. [73] Se desconoce la fuente y el desencadenante de esta metilación relacionada con la edad. [73] [74] Aproximadamente la mitad de los genes que muestran cambios de metilación relacionados con la edad son los mismos genes que se han identificado como implicados en el desarrollo del cáncer colorrectal. [73] Estos hallazgos pueden sugerir una razón para que la edad esté asociada con el mayor riesgo de desarrollar cáncer colorrectal. [73]
Las reducciones epigenéticas de la expresión de la enzima reparadora del ADN probablemente pueden conducir a la inestabilidad genómica y epigenómica característica del cáncer. [75] [76] [67] Como se resume en los artículos Carcinogenesis y Neoplasm , para los cánceres esporádicos en general, una deficiencia en la reparación del ADN se debe ocasionalmente a una mutación en un gen de reparación del ADN, pero con mucha más frecuencia se debe a alteraciones epigenéticas que reducen o silencian la expresión de genes de reparación del ADN. [77]
Las alteraciones epigenéticas implicadas en el desarrollo del cáncer colorrectal pueden afectar la respuesta de una persona a la quimioterapia. [78]
La clasificación de subtipos moleculares de consenso (CMS) del cáncer colorrectal se introdujo por primera vez en 2015. Hasta el momento, la clasificación CMS se ha considerado el sistema de clasificación más sólido disponible para el CCR, que tiene una clara interpretabilidad biológica y es la base para la futura estratificación clínica e intervenciones específicas basadas en subtipos. [79]
En 2021 se propuso una nueva clasificación basada en el epigenoma (EpiC) del cáncer colorrectal que introduce 4 subtipos potenciadores en personas con CCR. Los estados de la cromatina se caracterizan utilizando 6 marcas de histonas para identificar los subtipos de EpiC. Un enfoque terapéutico combinatorio basado en los subtipos moleculares de consenso (CMS) y EpiC introducidos anteriormente podría mejorar significativamente las estrategias de tratamiento actuales. [80]
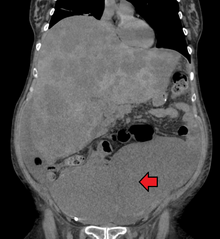
El diagnóstico de cáncer colorrectal se realiza mediante el muestreo de áreas del colon sospechosas de un posible desarrollo de tumor, generalmente durante una colonoscopia o una sigmoidoscopia, dependiendo de la ubicación de la lesión. [20]
A veces, el cáncer colorrectal se descubre inicialmente en una tomografía computarizada . [81]
La presencia de metástasis se determina mediante una tomografía computarizada del tórax, el abdomen y la pelvis. [20] En ciertos casos se pueden utilizar otras pruebas de diagnóstico por imagen como la PET y la MRI . [20] La MRI es particularmente útil para determinar el estadio local del tumor y planificar el abordaje quirúrgico óptimo. [81]
También se realiza una resonancia magnética después de completar la quimiorradioterapia neoadyuvante para identificar a los pacientes que logran una respuesta completa. Los pacientes con una respuesta completa tanto en la resonancia magnética como en la endoscopia pueden no requerir una resección quirúrgica y pueden evitar la morbilidad y las complicaciones quirúrgicas innecesarias. [82] Los pacientes seleccionados para el tratamiento no quirúrgico del cáncer rectal deben realizarse resonancias magnéticas periódicas, recibir exámenes físicos y someterse a procedimientos endoscópicos para detectar cualquier recrecimiento del tumor, que puede ocurrir en una minoría de estos pacientes. Cuando ocurre una recurrencia local, el seguimiento periódico puede detectarla cuando aún es pequeña y curable con cirugía de rescate. Además, se pueden asignar grados de regresión tumoral mediante resonancia magnética después de la quimiorradioterapia que se correlacionan con los resultados de supervivencia a largo plazo de los pacientes. [83]


Las características histopatológicas del tumor se informan a partir del análisis de tejido tomado de una biopsia o cirugía. Un informe patológico contiene una descripción de las características microscópicas del tejido tumoral, incluidas tanto las células tumorales como la forma en que el tumor invade los tejidos sanos y, finalmente, si el tumor parece eliminarse por completo. La forma más común de cáncer de colon es el adenocarcinoma , que constituye entre el 95% [85] y el 98% [86] de todos los casos de cáncer colorrectal. Otros tipos más raros incluyen el linfoma , el carcinoma adenoescamoso y el carcinoma de células escamosas . Algunos subtipos son más agresivos. [87] La inmunohistoquímica se puede utilizar en casos inciertos. [88]
La estadificación del cáncer se basa en hallazgos radiológicos y patológicos. Al igual que con la mayoría de las otras formas de cáncer, la estadificación del tumor se basa en el sistema TNM , que considera cuánto se ha propagado el tumor inicial y la presencia de metástasis en los ganglios linfáticos y órganos más distantes. [20] La octava edición del AJCC se publicó en 2018. [89]
Se ha estimado que aproximadamente la mitad de los casos de cáncer colorrectal se deben a factores relacionados con el estilo de vida y que aproximadamente una cuarta parte de todos los casos son prevenibles. [90] Aumentar la vigilancia, realizar actividad física, consumir una dieta rica en fibra, dejar de fumar y limitar el consumo de alcohol disminuyen el riesgo. [91] [92]
Los factores de riesgo del estilo de vida con evidencia sólida incluyen la falta de ejercicio, el tabaquismo, el alcohol y la obesidad. [93] [94] [95] El riesgo de cáncer de colon se puede reducir manteniendo un peso corporal normal mediante una combinación de ejercicio suficiente y una dieta saludable . [96]
Las investigaciones actuales vinculan de forma consistente el consumo de más carne roja y procesada con un mayor riesgo de padecer la enfermedad. [97] A partir de la década de 1970, las recomendaciones dietéticas para prevenir el cáncer colorrectal a menudo incluían aumentar el consumo de cereales integrales , frutas y verduras, y reducir la ingesta de carne roja y carnes procesadas . Esto se basó en estudios animales y estudios observacionales retrospectivos. Sin embargo, los estudios prospectivos a gran escala no han logrado demostrar un efecto protector significativo y, debido a las múltiples causas del cáncer y la complejidad de estudiar las correlaciones entre la dieta y la salud, no está claro si alguna intervención dietética específica tendrá efectos protectores significativos. [98] : 432–433 [99] : 125–126 En 2018, el Instituto Nacional del Cáncer declaró que "no hay evidencia confiable de que una dieta iniciada en la edad adulta que sea baja en grasas y carne y alta en fibra, frutas y verduras reduzca el riesgo de CCR en un grado clínicamente importante". [93] [100]
El consumo de bebidas alcohólicas y de carne procesada aumenta el riesgo de cáncer colorrectal. [101]
El informe de la Organización Mundial de la Salud sobre el cáncer de 2014 señaló que se había planteado la hipótesis de que la fibra dietética podría ayudar a prevenir el cáncer colorrectal, pero que la mayoría de los estudios en ese momento aún no habían estudiado la correlación. [99] Sin embargo, una revisión de 2019 encontró evidencia de beneficios de la fibra dietética y los cereales integrales. [102] El Fondo Mundial para la Investigación del Cáncer enumeró el beneficio de la fibra para la prevención del cáncer colorrectal como "probable" a partir de 2017. [103] Una revisión general de 2022 dice que hay "evidencia convincente" de esa asociación. [104]
Se recomienda una mayor actividad física. [21] [105] El ejercicio físico se asocia con una reducción modesta del riesgo de cáncer de colon, pero no del de recto. [106] [107] Los niveles elevados de actividad física reducen el riesgo de cáncer de colon en un 21 % aproximadamente. [108] Estar sentado regularmente durante períodos prolongados se asocia con una mayor mortalidad por cáncer de colon. El ejercicio regular no anula el riesgo, pero lo reduce. [109]
La aspirina y el celecoxib parecen disminuir el riesgo de cáncer colorrectal en aquellas personas con alto riesgo. [110] [111] La aspirina se recomienda en aquellas personas de 50 a 60 años de edad, que no tienen un mayor riesgo de sangrado y tienen riesgo de enfermedad cardiovascular para prevenir el cáncer colorrectal. [112] No se recomienda en aquellas personas con riesgo promedio. [113]
Hay evidencia tentativa a favor de la suplementación con calcio , pero no es suficiente para hacer una recomendación. [114] La ingesta de vitamina D y los niveles sanguíneos están asociados con un menor riesgo de cáncer de colon. [115] [116]
Como más del 80% de los cánceres colorrectales surgen de pólipos adenomatosos , la detección de este cáncer es eficaz tanto para la detección temprana como para la prevención. [20] [117] El diagnóstico de casos de cáncer colorrectal mediante detección tiende a ocurrir 2 a 3 años antes del diagnóstico de casos con síntomas. [20] Cualquier pólipo que se detecte se puede extirpar, generalmente mediante colonoscopia o sigmoidoscopia , y así evitar que se convierta en cáncer. La detección tiene el potencial de reducir las muertes por cáncer colorrectal en un 60%. [118]
Las tres pruebas de detección principales son la colonoscopia, la prueba de sangre oculta en heces y la sigmoidoscopia flexible . De las tres, solo la sigmoidoscopia no puede detectar el lado derecho del colon , donde se detecta el 42 % de los cánceres. [119] Sin embargo, la sigmoidoscopia flexible tiene la mejor evidencia de que disminuye el riesgo de muerte por cualquier causa. [120]
La prueba de sangre oculta en heces (FOBT, por sus siglas en inglés) se recomienda generalmente cada dos años y puede ser a base de guayacol o inmunoquímica . [20] Si se encuentran resultados anormales en la FOBT, los participantes generalmente son derivados para un examen de colonoscopia de seguimiento. Cuando se realiza una vez cada 1 o 2 años, la detección FOBT reduce las muertes por cáncer colorrectal en un 16% y entre los que participan en la detección, las muertes por cáncer colorrectal se pueden reducir hasta en un 23%, aunque no se ha demostrado que reduzca la mortalidad por todas las causas. [121] Las pruebas inmunoquímicas son precisas y no requieren cambios en la dieta o la medicación antes de la prueba. [122] Sin embargo, la investigación en el Reino Unido ha encontrado que para estas pruebas inmunoquímicas, el umbral para una mayor investigación se establece en un punto que puede pasar por alto más de la mitad de los casos de cáncer de intestino. La investigación sugiere que el Programa de detección de cáncer de intestino del NHS de Inglaterra podría hacer un mejor uso de la capacidad de la prueba para proporcionar la concentración exacta de sangre en las heces (en lugar de solo si está por encima o por debajo de un nivel de corte). [123] [124]
Otras opciones incluyen la colonoscopia virtual y la prueba de detección de ADN en heces (FIT-DNA). La colonoscopia virtual a través de una tomografía computarizada parece tan buena como la colonoscopia estándar para detectar cánceres y adenomas grandes, pero es costosa, está asociada con la exposición a la radiación y no puede eliminar ningún crecimiento anormal detectado como lo hace la colonoscopia estándar. [20] La prueba de detección de ADN en heces busca biomarcadores asociados con el cáncer colorrectal y las lesiones precancerosas, incluido el ADN alterado y la hemoglobina en sangre . Un resultado positivo debe ser seguido por una colonoscopia . La FIT-DNA tiene más falsos positivos que la FIT y, por lo tanto, produce más efectos adversos. [10] Se requieren más estudios a partir de 2016 para determinar si un intervalo de detección de tres años es correcto. [10]
En los Estados Unidos, las pruebas de detección se recomiendan generalmente entre los 50 y los 75 años. [10] [125] La Sociedad Estadounidense del Cáncer recomienda comenzar a los 45 años. [126] Para las personas entre 76 y 85 años, la decisión de hacerse la prueba de detección debe ser individualizada. [10] Para las personas con alto riesgo, las pruebas de detección suelen comenzar alrededor de los 40 años. [20] [127]
Se recomiendan varios métodos de detección, entre ellos, análisis de heces cada 2 años, sigmoidoscopia cada 10 años con análisis inmunoquímico fecal cada dos años y colonoscopia cada 10 años. [125] No está claro cuál de estos dos métodos es mejor. [128] La colonoscopia puede encontrar más cánceres en la primera parte del colon, pero está asociada con un mayor costo y más complicaciones. [128] Para las personas con riesgo promedio que se han realizado una colonoscopia de alta calidad con resultados normales, la Asociación Estadounidense de Gastroenterología no recomienda ningún tipo de detección en los 10 años posteriores a la colonoscopia. [129] [130] Para las personas mayores de 75 años o aquellas con una expectativa de vida de menos de 10 años, no se recomienda la detección. [131] Se necesitan aproximadamente 10 años después de la detección para que una de cada 1000 personas se beneficie. [132] El USPSTF enumera siete posibles estrategias para la detección, siendo lo más importante que al menos una de estas estrategias se use adecuadamente. [10]
En Canadá, entre las personas de 50 a 75 años con riesgo normal, se recomienda una prueba inmunoquímica fecal o FOBT cada dos años o una sigmoidoscopia cada 10 años. [133] La colonoscopia es menos preferida. [133]
Algunos países tienen programas nacionales de detección colorrectal que ofrecen pruebas de detección con sangre oculta en heces para todos los adultos dentro de un determinado grupo de edad, comenzando generalmente entre los 50 y 60 años. Algunos ejemplos de países con detección organizada son el Reino Unido, [134] Australia, [135] los Países Bajos, [136] Hong Kong y Taiwán. [137]
El Programa de Detección del Cáncer de Intestino del Reino Unido tiene como objetivo detectar signos de alarma en personas de entre 60 y 74 años, recomendando una prueba inmunoquímica fecal (FIT) cada dos años. La FIT mide la sangre en las heces y las personas con niveles superiores a un cierto umbral pueden someterse a un examen del tejido intestinal para detectar signos de cáncer. Se eliminan los crecimientos que tienen potencial canceroso. [138] [124]
El tratamiento del cáncer colorrectal puede tener como objetivo la curación o la paliación. La decisión sobre qué objetivo adoptar depende de diversos factores, entre ellos la salud y las preferencias de la persona, así como el estadio del tumor. [139] La evaluación en equipos multidisciplinarios es una parte fundamental para determinar si el paciente es apto o no para la cirugía. [140] Cuando el cáncer colorrectal se detecta a tiempo, la cirugía puede ser curativa. Sin embargo, cuando se detecta en estadios más avanzados (en los que hay metástasis ), esto es menos probable y el tratamiento suele estar dirigido a la paliación, para aliviar los síntomas causados por el tumor y mantener a la persona lo más cómoda posible. [20]



En una etapa temprana, el cáncer colorrectal se puede extirpar durante una colonoscopia utilizando una de varias técnicas, incluida la resección mucosa endoscópica o la disección submucosa endoscópica . [5] La resección endoscópica es posible si hay una baja posibilidad de metástasis en los ganglios linfáticos y el tamaño y la ubicación del tumor hacen posible la resección en bloque. [141] Para las personas con cáncer localizado, el tratamiento preferido es la extirpación quirúrgica completa con márgenes adecuados , con el intento de lograr una cura. El procedimiento de elección es una colectomía parcial (o proctocolectomía para lesiones rectales) donde se extirpa la parte afectada del colon o recto junto con partes de su mesocolon y suministro de sangre para facilitar la eliminación de los ganglios linfáticos drenantes . Esto se puede hacer mediante una laparotomía abierta o por laparoscopia , dependiendo de factores relacionados con la persona individual y los factores de la lesión. [20] Luego, se puede volver a conectar el colon o se puede realizar una colostomía a la persona . [5]
Si sólo hay unas pocas metástasis en el hígado o los pulmones, también se pueden extirpar. Se puede utilizar quimioterapia antes de la cirugía para reducir el tamaño del cáncer antes de intentar extirparlo. Los dos sitios más comunes de recurrencia del cáncer colorrectal son el hígado y los pulmones . [20] Para la carcinomatosis peritoneal , se puede utilizar cirugía citorreductora , a veces en combinación con HIPEC , en un intento de extirpar el cáncer. [142]
En el cáncer de colon y recto , se puede utilizar quimioterapia además de la cirugía en ciertos casos. La decisión de agregar quimioterapia al tratamiento del cáncer de colon y recto depende del estadio de la enfermedad. [143]
En el cáncer de colon en estadio I no se ofrece quimioterapia y la cirugía es el tratamiento definitivo. El papel de la quimioterapia en el cáncer de colon en estadio II es discutible y, por lo general, no se ofrece a menos que se identifiquen factores de riesgo como un tumor T4, un tumor indiferenciado, invasión vascular y perineural o un muestreo inadecuado de los ganglios linfáticos. [144] También se sabe que las personas que son portadoras de anomalías en los genes de reparación de desajustes no se benefician de la quimioterapia. En el caso del cáncer de colon en estadio III y IV, la quimioterapia es una parte integral del tratamiento. [20]
Si el cáncer se ha propagado a los ganglios linfáticos u órganos distantes, que es el caso del cáncer de colon en estadio III y estadio IV respectivamente, agregar agentes de quimioterapia fluorouracilo , capecitabina u oxaliplatino aumenta la expectativa de vida. Si los ganglios linfáticos no contienen cáncer, los beneficios de la quimioterapia son controvertidos. Si el cáncer es ampliamente metastásico o irresecable, el tratamiento es entonces paliativo . Típicamente en este contexto, se pueden usar varios medicamentos de quimioterapia diferentes. [20] Los medicamentos de quimioterapia para esta afección pueden incluir capecitabina , fluorouracilo , irinotecán , oxaliplatino y UFT . [145] Los medicamentos capecitabina y fluorouracilo son intercambiables, siendo la capecitabina un medicamento oral y el fluorouracilo un medicamento intravenoso. Algunos regímenes específicos utilizados para el CCR son CAPOX , FOLFOX , FOLFOXIRI y FOLFIRI . [146] Los fármacos antiangiogénicos como el bevacizumab se añaden a menudo en la terapia de primera línea. [147] Otra clase de fármacos utilizados en el entorno de segunda línea son los inhibidores del receptor del factor de crecimiento epidérmico , de los cuales los tres aprobados por la FDA son aflibercept , cetuximab y panitumumab . [148] [149]
La principal diferencia en el abordaje del cáncer rectal en estadio bajo es la incorporación de radioterapia. A menudo, se utiliza junto con quimioterapia de manera neoadyuvante para permitir la resección quirúrgica, de modo que en última instancia no se requiere una colostomía . Sin embargo, puede que no sea posible en tumores de localización baja, en cuyo caso, puede ser necesaria una colostomía permanente. El cáncer rectal en estadio IV se trata de manera similar al cáncer de colon en estadio IV.
El cáncer colorrectal en estadio IV debido a carcinomatosis peritoneal se puede tratar utilizando HIPEC combinada con cirugía citorreductora en algunas personas. [150] [151] [152] Además, el cáncer colorrectal T4 se puede tratar con HIPEC para evitar futuras recaídas. [153]
Si bien una combinación de radiación y quimioterapia puede ser útil para el cáncer rectal , [20] para algunas personas que requieren tratamiento, la quimiorradioterapia puede aumentar la toxicidad aguda relacionada con el tratamiento y no se ha demostrado que mejore las tasas de supervivencia en comparación con la radioterapia sola, aunque se asocia con una menor recurrencia local. [142] Para el carcinoma de células escamosas del canal anal, la quimiorradioterapia (QRT) con 5-FU y mitomicina C se prefiere a la radiación sola, ofreciendo mejores resultados de supervivencia pero con mayores riesgos de toxicidad aguda. [154] El uso de radioterapia en el cáncer de colon no es rutinario debido a la sensibilidad de los intestinos a la radiación. [155]
Al igual que con la quimioterapia, la radioterapia se puede utilizar como neoadyuvante para los estadios clínicos T3 y T4 del cáncer rectal. [156] Esto da como resultado la reducción del tamaño o la reducción del estadio del tumor, preparándolo para la resección quirúrgica y también disminuye las tasas de recurrencia local. [156] Para el cáncer rectal localmente avanzado, la quimiorradioterapia neoadyuvante se ha convertido en el tratamiento estándar. [157] Además, cuando la cirugía no es posible, se ha sugerido que la radioterapia es un tratamiento eficaz contra las metástasis pulmonares del CCR, que se desarrollan en el 10-15% de las personas con CCR. [158]
Se ha descubierto que la inmunoterapia con inhibidores de puntos de control inmunitario es útil para un tipo de cáncer colorrectal con deficiencia de reparación de desajustes e inestabilidad de microsatélites. [159] [160] [161] El pembrolizumab está aprobado para tumores de cáncer colorrectal avanzado que son deficientes en MMR y que no han respondido a los tratamientos habituales. [162] Sin embargo, la mayoría de las personas que mejoran empeoran después de meses o años. [160]
Por otra parte, en un estudio prospectivo de fase 2 publicado en junio de 2022 en The New England Journal of Medicine, a 12 pacientes con adenocarcinoma rectal en estadio II o III con reparación deficiente de desajustes (dMMR) se les administró dostarlimab como agente único , un anticuerpo monoclonal anti-PD-1, cada tres semanas durante seis meses. Después de una mediana de seguimiento de 12 meses (rango, 6 a 25 meses), los 12 pacientes tuvieron una respuesta clínica completa sin evidencia de tumor en la resonancia magnética, la tomografía por emisión de positrones con 18F-fluorodesoxiglucosa, la evaluación endoscópica, el examen rectal digital o la biopsia. Además, ningún paciente del ensayo necesitó quimiorradioterapia o cirugía, y ningún paciente informó eventos adversos de grado 3 o superior. Sin embargo, aunque los resultados de este estudio son prometedores, el estudio es pequeño y tiene incertidumbres sobre los resultados a largo plazo. [163]
Se recomiendan cuidados paliativos para cualquier persona que tenga cáncer de colon avanzado o que presente síntomas significativos. [164] [165]
La implementación de cuidados paliativos puede ser beneficiosa para mejorar la calidad de vida tanto de la persona como de su familia, al mejorar los síntomas, la ansiedad y prevenir ingresos hospitalarios. [166]
En las personas con cáncer colorrectal incurable, los cuidados paliativos pueden consistir en procedimientos que alivian los síntomas o las complicaciones del cáncer, pero no intentan curar el cáncer subyacente, mejorando así la calidad de vida . Las opciones quirúrgicas pueden incluir la extirpación quirúrgica no curativa de parte del tejido canceroso, la derivación de parte de los intestinos o la colocación de un stent. Estos procedimientos pueden considerarse para mejorar los síntomas y reducir las complicaciones, como el sangrado del tumor, el dolor abdominal y la obstrucción intestinal. [167] Los métodos no quirúrgicos de tratamiento sintomático incluyen la radioterapia para disminuir el tamaño del tumor, así como los analgésicos. [168]
Además de la intervención médica, se han implementado diversas intervenciones psicosociales para abordar las preocupaciones psicosociales en el contexto del cáncer colorrectal. [169] La depresión y la ansiedad son muy frecuentes en pacientes con diagnóstico de CCR, por lo que las intervenciones psicosociales pueden ser útiles para aliviar la angustia psicológica. [170] [171] Muchos pacientes continúan experimentando síntomas de ansiedad y depresión después del tratamiento, independientemente del resultado del mismo. [170] [172] Los estigmas sociales asociados con el cáncer colorrectal presentan más desafíos psicosociales para los pacientes con CCR y sus familias. [173] [174]
Los pacientes con cáncer colorrectal tienen un riesgo 51% mayor de sufrir depresión que las personas que no padecen esta enfermedad. [171] Además, los pacientes con cáncer colorrectal tienen un riesgo alto de sufrir ansiedad grave, baja autoestima, bajo concepto de sí mismos y ansiedad social. [170] [175]
Independientemente del resultado del tratamiento, muchos pacientes con CCR experimentan síntomas continuos de ansiedad, depresión y angustia. [170]
La supervivencia del cáncer colorrectal puede implicar importantes ajustes en el estilo de vida. [174] Las afecciones posoperatorias pueden incluir estomas, problemas intestinales, incontinencia, olor y cambios en el funcionamiento sexual. [174] [175] Estos cambios pueden dar lugar a una imagen corporal distorsionada, ansiedad social, depresión y angustia, todo lo cual contribuye a una peor calidad de vida. [174] [176]
El cáncer colorrectal es la segunda causa principal de muerte por cáncer en todo el mundo. [177] La transición a cuidados paliativos y enfrentarse a la mortalidad puede ser una experiencia profundamente angustiante para un paciente con CCR y sus seres queridos.
El cáncer colorrectal está altamente estigmatizado y puede provocar sentimientos de disgusto en los pacientes, los profesionales de la salud, la familia, las parejas íntimas y el público en general. [173] Los pacientes con estomas son especialmente vulnerables a la estigmatización debido a los olores inevitables, los gases y los ruidos desagradables de las bolsas de estoma. [173] Además, los factores de riesgo asociados con el CCR, como la mala alimentación, el consumo de alcohol y la falta de actividad física, provocan suposiciones negativas de culpa y responsabilidad personal en los pacientes con CCR. [174] El juicio de los demás junto con la autoculpa internalizada y la vergüenza pueden afectar negativamente la autoestima, la sociabilidad y la calidad de vida. [174]
Las intervenciones presenciales, como la terapia de conversación entre médico y paciente, las prácticas de cuerpo-mente-espíritu y las sesiones de grupos de apoyo, se han identificado como las más eficaces para reducir la ansiedad y la depresión en pacientes con cáncer colorrectal. [169] Además, se han implementado ejercicios de registro diario y sesiones de terapia de conversación por teléfono. [169] Aunque se consideran menos eficaces, estas intervenciones no presenciales son económicamente inclusivas y se ha comprobado que reducen tanto la depresión como la ansiedad en pacientes con cáncer colorrectal. [169]
La Red Nacional Integral del Cáncer de los Estados Unidos y la Sociedad Estadounidense de Oncología Clínica proporcionan pautas para el seguimiento del cáncer de colon. [178] [179] Se recomienda una historia clínica y un examen físico cada 3 a 6 meses durante 2 años, luego cada 6 meses durante 5 años. Las mediciones del nivel de antígeno carcinoembrionario en sangre siguen el mismo cronograma, pero solo se recomiendan para personas con lesiones T2 o mayores que sean candidatas a una intervención. Se puede considerar una tomografía computarizada del tórax, el abdomen y la pelvis anualmente durante los primeros 3 años para personas con alto riesgo de recurrencia (por ejemplo, aquellos que tuvieron tumores poco diferenciados o invasión venosa o linfática) y son candidatos a cirugía curativa (con el objetivo de curar). Se puede realizar una colonoscopia después de 1 año, excepto si no se pudo hacer durante la estadificación inicial debido a una masa obstructiva, en cuyo caso debe realizarse después de 3 a 6 meses. Si se encuentra un pólipo velloso, un pólipo >1 centímetro o una displasia de alto grado, se puede repetir la colonoscopia a los 3 años y luego cada 5 años. En caso de otras anomalías, se puede repetir la colonoscopia al año. [143]
No se recomiendan exploraciones PET o ecografías de rutina , radiografías de tórax , hemograma completo ni pruebas de función hepática . [178] [179]
En el caso de las personas que se han sometido a cirugía curativa o terapia adyuvante (o ambas) para tratar el cáncer colorrectal no metastásico, no se ha demostrado que la vigilancia intensa y el seguimiento estrecho proporcionen beneficios adicionales para la supervivencia. [180]
El ejercicio puede ser recomendado en el futuro como terapia secundaria para los sobrevivientes de cáncer. En estudios epidemiológicos, el ejercicio puede disminuir la mortalidad específica por cáncer colorrectal y la mortalidad por todas las causas. Los resultados para las cantidades específicas de ejercicio necesarias para observar un beneficio fueron contradictorios. Estas diferencias pueden reflejar diferencias en la biología tumoral y la expresión de biomarcadores. Las personas con tumores que carecían de expresión de CTNNB1 (β-catenina), involucrada en la vía de señalización de Wnt , necesitaron más de 18 horas de equivalente metabólico (MET) por semana, una medida de ejercicio, para observar una reducción en la mortalidad por cáncer colorrectal. El mecanismo de cómo el ejercicio beneficia la supervivencia puede estar involucrado en la vigilancia inmunológica y las vías de inflamación. En estudios clínicos, se encontró una respuesta proinflamatoria en personas con cáncer colorrectal en estadio II-III que se sometieron a 2 semanas de ejercicio moderado después de completar su terapia primaria. El equilibrio oxidativo puede ser otro posible mecanismo para los beneficios observados. Se encontró una disminución significativa en 8-oxo-dG en la orina de personas que se sometieron a 2 semanas de ejercicio moderado después de la terapia primaria. Otros mecanismos posibles pueden involucrar hormonas metabólicas y hormonas sexuales esteroides, aunque estas vías pueden estar involucradas en otros tipos de cáncer. [181] [182]
Otro posible biomarcador puede ser p27 . Se encontró que los sobrevivientes con tumores que expresaban p27 y realizaban más de 18 horas MET por semana tenían una menor supervivencia de mortalidad por cáncer colorrectal en comparación con aquellos con menos de 18 horas MET por semana. Se demostró que los sobrevivientes sin expresión de p27 que hacían ejercicio tenían peores resultados. La activación constitutiva de la vía PI3K/AKT/mTOR puede explicar la pérdida de p27 y el exceso de balance energético puede regular positivamente p27 para detener la división de las células cancerosas. [182]
La actividad física proporciona beneficios a las personas con cáncer colorrectal no avanzado. Se han observado mejoras en la capacidad aeróbica, la fatiga relacionada con el cáncer y la calidad de vida relacionada con la salud a corto plazo. [183] Sin embargo, estas mejoras no se observaron a nivel de la salud mental relacionada con la enfermedad, como la ansiedad y la depresión. [183]
Menos de 600 genes están vinculados a los resultados en el cáncer colorrectal. [51] Estos incluyen genes desfavorables, donde la expresión alta está relacionada con un mal resultado, por ejemplo, la proteína de choque térmico de 70 kDa 1 (HSPA1A) , y genes favorables donde la expresión alta está asociada con una mejor supervivencia, por ejemplo, la proteína putativa de unión al ARN 3 (RBM3) . [51] El pronóstico también se correlaciona con una baja fidelidad del aparato de empalme del pre-ARNm y, por lo tanto, un alto número de empalmes alternativos desviados. [184]
La tasa media de recurrencia a cinco años en personas con cáncer de colon en las que la cirugía es exitosa es del 5% para los cánceres en estadio I, del 12% en estadio II y del 33% en estadio III. Sin embargo, dependiendo del número de factores de riesgo, oscila entre el 9 y el 22% en el estadio II y entre el 17 y el 44% en el estadio III. [185] La tasa media de recurrencia a cinco años en personas con cáncer de recto en las que la cirugía es exitosa es del 9% para los cánceres en estadio 0 (después del tratamiento previo) , del 8% para los cánceres en estadio I, del 18% en estadio II y del 34% en estadio III. Dependiendo del número de factores de riesgo (0-2), el riesgo de metástasis a distancia en el cáncer de recto oscila entre el 4 y el 11% en el estadio 0, el 6 y el 12% en el estadio I, el 11 y el 28% en el estadio II y el 15 y el 43% en el estadio III. [186]
Las tasas de recurrencia han disminuido en las últimas décadas como resultado de las mejoras en el tratamiento del cáncer colorrectal. [187] El riesgo de recurrencia después de cinco años de vigilancia sigue siendo muy bajo. [188]
En Europa, la tasa de supervivencia a cinco años en el caso del cáncer colorrectal es inferior al 60%. En el mundo desarrollado, aproximadamente un tercio de las personas que contraen la enfermedad mueren a causa de ella. [20]
La supervivencia está directamente relacionada con la detección y el tipo de cáncer en cuestión, pero en general es mala para los cánceres sintomáticos, ya que suelen estar bastante avanzados. Las tasas de supervivencia para la detección en etapa temprana son aproximadamente cinco veces mayores que las de los cánceres en etapa tardía. Las personas con un tumor que no ha atravesado la muscularis mucosa (estadio TNM Tis, N0, M0) tienen una tasa de supervivencia a cinco años del 100%, mientras que aquellas con cáncer invasivo de T1 (dentro de la capa submucosa) o T2 (dentro de la capa muscular) tienen una tasa de supervivencia promedio a cinco años de aproximadamente el 90%. Aquellos con un tumor más invasivo pero sin afectación ganglionar (T3-4, N0, M0) tienen una tasa de supervivencia promedio a cinco años de aproximadamente el 70%. Las personas con ganglios linfáticos regionales positivos (cualquier T, N1-3, M0) tienen una tasa de supervivencia promedio a cinco años de aproximadamente el 40%, mientras que aquellas con metástasis distantes (cualquier T, cualquier N, M1) tienen un pronóstico malo y la supervivencia a cinco años varía de <5 por ciento a 31 por ciento. [189] [190] [191] [192] [193]
La supervivencia general (SG) a cinco años en el cáncer de recto después del tratamiento preoperatorio moderno y la cirugía fue del 90% para el estadio 0, del 86% para el estadio I, del 78% para el estadio II y del 67% para el estadio III según un estudio poblacional a nivel nacional. [186]
Si bien el impacto del cáncer colorrectal en quienes sobreviven varía mucho, a menudo habrá una necesidad de adaptarse a los resultados físicos y psicológicos de la enfermedad y su tratamiento. [194] Por ejemplo, es común que las personas experimenten incontinencia, [195] disfunción sexual, [196] problemas con el cuidado del estoma [197] y miedo a la recurrencia del cáncer [198] después de que haya concluido el tratamiento primario.
Una revisión sistemática cualitativa publicada en 2021 destacó que hay tres factores principales que influyen en la adaptación a la vida con y después del cáncer colorrectal: los mecanismos de apoyo, la gravedad de los efectos tardíos del tratamiento y el ajuste psicosocial. Por lo tanto, es esencial ofrecer a las personas el apoyo adecuado para ayudarlas a adaptarse mejor a la vida después del tratamiento. [199]
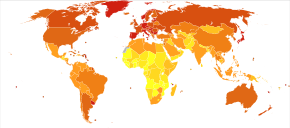
A nivel mundial, más de un millón de personas contraen cáncer colorrectal cada año [20], lo que da como resultado alrededor de 715.000 muertes en 2010, frente a 490.000 en 1990. [200]
A partir de 2012 [actualizar], es la segunda causa más común de cáncer en mujeres (9,2% de los diagnósticos) y la tercera más común en hombres (10,0%) [14] : 16 siendo la cuarta causa más común de muerte por cáncer después del cáncer de pulmón , estómago y hígado . [201] Es más común en países desarrollados que en desarrollo. [202] La incidencia global varía 10 veces, con las tasas más altas en Australia, Nueva Zelanda, Europa y los EE. UU. y las tasas más bajas en África y Asia central y meridional. [203]
En 2022, se anticipó que la incidencia de cáncer colorrectal en los Estados Unidos sería de aproximadamente 151 000 adultos, incluidos más de 106 000 casos nuevos de cáncer de colon (unos 54 000 hombres y 52 000 mujeres) y alrededor de 45 000 casos nuevos de cáncer de recto. [204] Desde la década de 1980, la incidencia de cáncer colorrectal disminuyó, cayendo aproximadamente un 2 % anual entre 2014 y 2018 en adultos de 50 años o más, debido principalmente a la mejora de las pruebas de detección. [204] Sin embargo, la incidencia del cáncer colorrectal ha aumentado en personas de 25 a 50 años. A principios de 2023, la Sociedad Estadounidense del Cáncer (ACS) informó que el 20% de los diagnósticos (de cáncer de colon) en 2019 se dieron en pacientes menores de 55 años, lo que supone aproximadamente el doble de la tasa de 1995, y las tasas de enfermedad avanzada aumentaron aproximadamente un 3% anual en personas menores de 50 años. Predijo que, en 2023, se estima que 19.550 diagnósticos y 3.750 muertes se darían en personas menores de 50 años. [205] El cáncer colorrectal también afecta desproporcionadamente a la comunidad negra, donde las tasas son las más altas de cualquier grupo racial/étnico en los EE. UU. Los afroamericanos tienen aproximadamente un 20% más de probabilidades de contraer cáncer colorrectal y aproximadamente un 40% más de probabilidades de morir a causa de él que la mayoría de los demás grupos. Los estadounidenses negros a menudo enfrentan mayores obstáculos para la prevención, detección, tratamiento y supervivencia del cáncer, incluidas disparidades raciales sistémicas que son complejas y van más allá de la conexión obvia con el cáncer.
En el Reino Unido, aproximadamente 41.000 personas al año padecen cáncer de colon, lo que lo convierte en el cuarto tipo más común. [206]
En Australia, uno de cada 19 hombres y una de cada 28 mujeres desarrollarán cáncer colorrectal antes de los 75 años; uno de cada 10 hombres y una de cada 15 mujeres lo desarrollarán antes de los 85 años de edad. [207]
En los países en desarrollo, como Papua Nueva Guinea y otros Estados insulares del Pacífico, incluidas las Islas Salomón, el cáncer colorrectal es un cáncer muy poco frecuente entre la población, y es menos común en comparación con el cáncer de pulmón, estómago, hígado o mama. Se estima que al menos 8 de cada 100.000 personas tienen más probabilidades de desarrollar cáncer colorrectal cada año, a diferencia del cáncer de pulmón o mama, donde en este último caso la incidencia es de 24 de cada 100.000 mujeres. [208]
El diagnóstico de cáncer colorrectal en pacientes menores de 50 años se denomina cáncer colorrectal de aparición temprana (EOCC). [177] [209] Los casos de EOCC han aumentado durante la última década, específicamente en poblaciones de pacientes de entre 20 y 40 años en América del Norte, Europa, Australia y China. [209] [210]
La incidencia del cáncer colorrectal en poblaciones más jóvenes ha aumentado durante la última década. [177] [209] [210] Si bien los avances en los procedimientos de diagnóstico pueden tener algún impacto, la menor probabilidad de detección entre estas poblaciones sugiere que el sesgo de detección no es un contribuyente importante a esta tendencia. Es más probable que los efectos de cohorte estén contribuyendo. [210]
La población que experimenta el mayor aumento de casos de CCPE son los hombres y mujeres de 20 a 29 años de edad, con una incidencia que aumentó un 7,9% por año entre 2004 y 2016. [210] De manera similar, aunque menos grave, los hombres y mujeres de 30 a 39 años experimentaron un aumento de casos a una tasa del 3,4% por año durante ese mismo período de tiempo. A pesar de estos aumentos, la tasa de mortalidad por cáncer colorrectal se ha mantenido igual. [210]
Los factores de riesgo asociados con el CCPE son similares a los de todos los casos de cáncer colorrectal. [209] Los efectos de cohorte observados probablemente sean el producto de cambios generacionales en el estilo de vida y los factores ambientales. [177] [209]
En 2018, la Sociedad Estadounidense del Cáncer modificó su directriz anterior de detección del cáncer colorrectal de los 50 a los 45 años tras el reconocimiento de un aumento de casos de CCPE. [210] Se ha identificado a las personas menores de 60 años como las más susceptibles a no participar en la detección del cáncer colorrectal. [211]
Se ha diagnosticado cáncer rectal en una momia del Antiguo Egipto que había vivido en el oasis de Dakhleh durante el período ptolemaico . [212]
En Estados Unidos, marzo es el mes de concientización sobre el cáncer colorrectal . [118]
La evidencia preliminar in vitro sugiere que las bacterias del ácido láctico (por ejemplo, lactobacilos , estreptococos o lactococos ) pueden ser protectoras contra el desarrollo y la progresión del cáncer colorrectal a través de varios mecanismos, como la actividad antioxidante , la inmunomodulación , la promoción de la muerte celular programada , los efectos antiproliferativos y la modificación epigenética de las células cancerosas. [213]
{{cite book}}: CS1 maint: location missing publisher (link)sobre la fibra dietética y el riesgo de cáncer de colon no han confirmado una asociación, aunque se observó una relación inversa en el estudio de investigación prospectiva europea sobre cáncer y nutrición (EPIC) y en un metanálisis reciente. Es necesario comprender mejor la variación en los resultados de los estudios prospectivos; la fibra dietética es compleja y heterogénea, y la relación con el cáncer colorrectal podría diferir según la fuente dietética. (p. 127)
A pesar de la hipótesis de larga data de que una dieta rica en fibra puede proteger contra el cáncer colorrectal... los estudios epidemiológicos que asocian la ingesta de fibra dietética con el riesgo posterior de cáncer colorrectal han arrojado resultados inconsistentes... No obstante, con base en la evidencia existente, el informe de expertos más reciente del Fondo Mundial para la Investigación del Cáncer y el Instituto Americano para la Investigación del Cáncer en 2017 concluye que existe evidencia probable
2010/2011