La toxoplasmosis es una enfermedad parasitaria causada por Toxoplasma gondii , un apicomplejo . [3] Las infecciones por toxoplasmosis se asocian a una variedad de afecciones neuropsiquiátricas y conductuales. [8] Ocasionalmente, las personas pueden tener algunas semanas o meses de enfermedad leve similar a la gripe , como dolores musculares y ganglios linfáticos sensibles . [1] En una pequeña cantidad de personas, pueden desarrollarse problemas oculares. [1] En aquellos con un sistema inmunológico débil , pueden ocurrir síntomas graves como convulsiones y falta de coordinación. [1] Si una persona se infecta durante el embarazo , una afección conocida como toxoplasmosis congénita puede afectar al niño. [1]
La toxoplasmosis se suele transmitir por comer alimentos mal cocinados que contienen quistes , por exposición a heces de gato infectadas o de una mujer infectada a su bebé durante el embarazo. [3] En raras ocasiones, la enfermedad puede transmitirse por transfusión de sangre u otro trasplante de órganos. [3] No se transmite de otra manera entre personas. [3] Se sabe que el parásito se reproduce sexualmente solo en la familia de los gatos . [9] Sin embargo, puede infectar a la mayoría de los tipos de animales de sangre caliente , incluidos los humanos. [9] El diagnóstico generalmente se realiza mediante un análisis de sangre para detectar anticuerpos o mediante un análisis del líquido amniótico en una paciente embarazada para detectar el ADN del parásito . [4]
La prevención se realiza mediante la preparación y cocción adecuadas de los alimentos. [10] También se recomienda a las mujeres embarazadas que no limpien las cajas de arena de los gatos o, si deben hacerlo, que utilicen guantes y se laven las manos después. [10] Por lo general, no es necesario tratar a personas sanas. [5] Durante el embarazo, se puede utilizar espiramicina o pirimetamina / sulfadiazina y ácido folínico para el tratamiento. [5]
Hasta la mitad de la población mundial está infectada por T. gondii , pero no presenta síntomas. [7] En los Estados Unidos, aproximadamente el 11% de las personas han sido infectadas, mientras que en algunas áreas del mundo esto es más del 60%. [3] Aproximadamente 200.000 casos de toxoplasmosis congénita ocurren al año. [6] Charles Nicolle y Louis Manceaux describieron por primera vez el organismo en 1908. [11] En 1941, se confirmó la transmisión durante el embarazo de una mujer embarazada a su bebé. [11] Hay evidencia tentativa de que la infección asintomática puede afectar el comportamiento de las personas. [12]
La infección tiene tres etapas:
La toxoplasmosis aguda suele ser asintomática en adultos sanos. [13] [14] Sin embargo, los síntomas pueden manifestarse y a menudo son similares a los de la gripe : ganglios linfáticos inflamados , dolores de cabeza, fiebre y fatiga, [15] o dolores musculares que duran un mes o más. Es raro que un humano con un sistema inmunológico completamente funcional desarrolle síntomas graves después de la infección. Las personas con sistemas inmunológicos debilitados son propensas a experimentar dolor de cabeza, confusión, mala coordinación, convulsiones, problemas pulmonares que pueden parecerse a la tuberculosis o neumonía por Pneumocystis jirovecii (una infección oportunista común que ocurre en personas con SIDA), o coriorretinitis causada por una inflamación grave de la retina (toxoplasmosis ocular). [15] Los niños pequeños y las personas inmunodeprimidas , como las que tienen VIH/SIDA, las que toman ciertos tipos de quimioterapia o las que han recibido recientemente un trasplante de órgano , pueden desarrollar toxoplasmosis grave. Esto puede causar daño al cerebro ( encefalitis ) o a los ojos ( retinocoroiditis necrosante ). [16] Los bebés infectados por transmisión placentaria pueden nacer con cualquiera de estos problemas o con malformaciones nasales, aunque estas complicaciones son poco frecuentes en los recién nacidos. Los trofozoítos toxoplásmicos que causan la toxoplasmosis aguda se denominan taquizoítos y suelen encontrarse en diversos tejidos y fluidos corporales, pero rara vez en la sangre o el líquido cefalorraquídeo. [17]
Los ganglios linfáticos inflamados se encuentran comúnmente en el cuello o debajo del mentón, seguidos de las axilas y la ingle. La hinchazón puede ocurrir en diferentes momentos después de la infección inicial, persistir y volver a aparecer durante varias veces independientemente del tratamiento antiparasitario. [18] Por lo general, se encuentra en un solo sitio en adultos, pero en niños, puede ser más común que se presente en varios sitios. Los ganglios linfáticos agrandados se resolverán en 1 a 2 meses en el 60% de los casos. Sin embargo, una cuarta parte de los afectados tarda de 2 a 4 meses en volver a la normalidad, y el 8% tarda de 4 a 6 meses. Un número sustancial (6%) no vuelve a la normalidad hasta mucho después. [19]
Debido a la ausencia de síntomas obvios, [13] [14] los huéspedes se infectan fácilmente con T. gondii y desarrollan toxoplasmosis sin saberlo. Aunque ocasionalmente ocurren síntomas leves similares a los de la gripe durante las primeras semanas posteriores a la exposición, la infección con T. gondii no produce síntomas fácilmente observables en adultos humanos sanos. [7] [20] En la mayoría de las personas inmunocompetentes , la infección entra en una fase latente, durante la cual solo están presentes los bradizoítos ( en los quistes tisulares ); [21] estos quistes tisulares e incluso lesiones pueden ocurrir en las retinas , el revestimiento alveolar de los pulmones (donde una infección aguda puede imitar una infección por Pneumocystis jirovecii ), el corazón, el músculo esquelético y el sistema nervioso central (SNC), incluido el cerebro. [22] Los quistes se forman en el SNC ( tejido cerebral ) tras la infección con T. gondii y persisten durante la vida del huésped. [23] La mayoría de los bebés que se infectan mientras están en el útero no presentan síntomas al nacer, pero pueden desarrollar síntomas más adelante en la vida. [24]
Las revisiones de estudios serológicos han estimado que entre el 30% y el 50% de la población mundial ha estado expuesta y puede estar infectada crónicamente con toxoplasmosis latente, aunque las tasas de infección difieren significativamente de un país a otro. [7] [25] [26] Este estado latente de infección se ha asociado recientemente con numerosas cargas de enfermedad , [7] alteraciones neuronales, [23] [25] y cambios conductuales sutiles dependientes del género en humanos inmunocompetentes, [27] [28] así como un mayor riesgo de colisiones de vehículos de motor. [29]
Aunque son poco frecuentes, pueden aparecer lesiones cutáneas en la forma adquirida de la enfermedad, como erupciones similares a la roséola y el eritema multiforme, nódulos similares al prurigo , urticaria y lesiones maculopapulares . Los recién nacidos pueden presentar máculas puntiformes, equimosis o lesiones en forma de "panecillo de arándanos".
El diagnóstico de la toxoplasmosis cutánea se basa en la presencia de la forma taquizoítica de T. gondii en la epidermis . [30] Se encuentra en todos los niveles de la epidermis, mide aproximadamente 6 por 2 μm y tiene forma de arco, con un núcleo que mide un tercio de su tamaño. Se puede identificar mediante microscopía electrónica o tinción de tejido con Giemsa , donde el citoplasma se muestra azul y el núcleo rojo. [31]
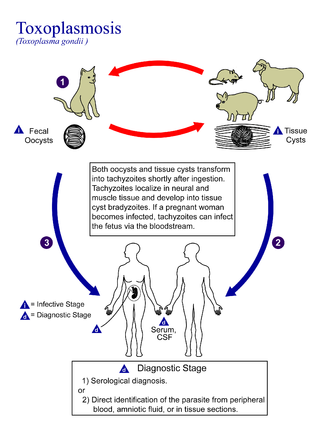
En su ciclo de vida, T. gondii adopta varias formas. [32] Los taquizoítos son responsables de la infección aguda; se dividen rápidamente y se propagan a través de los tejidos del cuerpo. Los taquizoítos también se conocen como "merozoítos taquizoicos", un término descriptivo que transmite con mayor precisión la naturaleza parasitológica de esta etapa. [33] Después de proliferar, los taquizoítos se convierten en bradizoítos , que se encuentran dentro de quistes tisulares intracelulares latentes que se forman principalmente en los músculos y el cerebro. La formación de quistes se desencadena en parte por la presión del sistema inmunológico del huésped. [34] Los bradizoítos (también llamados "merozoítos bradizoicos") no responden a los antibióticos. Los bradizoítos, una vez formados, pueden permanecer en los tejidos durante la vida útil del huésped. En un huésped sano, si algunos bradizoítos se convierten nuevamente en taquizoítos activos, el sistema inmunológico los destruirá rápidamente. Sin embargo, en individuos inmunodeprimidos o en fetos que carecen de un sistema inmunológico desarrollado, los taquizoítos pueden proliferar y causar daños neurológicos importantes. [32]
La supervivencia del parásito depende de un equilibrio entre la supervivencia del huésped y la proliferación del parásito. [34] T. gondii logra este equilibrio manipulando la respuesta inmune del huésped, reduciendo la respuesta inmune del huésped y mejorando la ventaja reproductiva del parásito. [34] Una vez que infecta una célula huésped normal, resiste el daño causado por el sistema inmune del huésped y cambia los procesos inmunes del huésped. [35] A medida que se abre paso hacia la célula huésped, el parásito forma una membrana de vacuola parasitófora (PV) a partir de la membrana de la célula huésped. [2] [36] La PV encapsula al parásito y es resistente a la actividad del sistema endolisosomal y puede tomar el control de las mitocondrias y el retículo endoplásmico del huésped . [2] [36]
Cuando invade por primera vez la célula, el parásito libera proteínas ROP del bulbo del orgánulo roptrio . [2] Estas proteínas se translocan al núcleo y la superficie de la membrana del PV donde pueden activar vías STAT para modular la expresión de citocinas a nivel transcripcional, unirse e inactivar proteínas IRG que destruyen la membrana del PV , entre otros posibles efectos. [2] [36] [37] Además, ciertas cepas de T. gondii pueden secretar una proteína conocida como GRA15, activando la vía NF-κB , que regula positivamente la citocina proinflamatoria IL-12 en la respuesta inmune temprana, posiblemente conduciendo a la fase latente del parásito. [2] La capacidad del parásito para secretar estas proteínas depende de su genotipo y afecta su virulencia. [2] [37]
El parásito también influye en un mecanismo antiapoptótico, permitiendo que las células huésped infectadas persistan y se repliquen. Un método de resistencia a la apoptosis es alterando las proteínas efectoras proapoptósicas, como BAX y BAK . [38] Para alterar estas proteínas, T. gondii provoca cambios conformacionales en las proteínas, que evitan que sean transportadas a varios compartimentos celulares donde inician eventos de apoptosis. Sin embargo, T. gondii no provoca una regulación negativa de las proteínas efectoras proapoptósicas. [38]
T. gondii también tiene la capacidad de iniciar la autofagia de las células del huésped. [39] Esto conduce a una disminución de las células sanas no infectadas y, en consecuencia, a menos células del huésped que ataquen a las células infectadas. La investigación de Wang et al. descubre que las células infectadas conducen a niveles más altos de autofagosomas en células normales e infectadas. [39] Su investigación revela que T. gondii causa la autofagia de la célula huésped utilizando una vía dependiente del calcio. [39] Otro estudio sugiere que el parásito puede afectar directamente la liberación de calcio de las reservas de calcio, que son importantes para los procesos de señalización de las células. [38]
Los mecanismos anteriores permiten que T. gondii persista en un huésped. Algunos factores limitantes para el toxoplasma son que su influencia en las células huésped es más fuerte en un sistema inmunológico débil y depende de la cantidad, por lo que una gran cantidad de T. gondii por célula huésped causa un efecto más severo. [40] El efecto en el huésped también depende de la fortaleza de su sistema inmunológico. Los individuos inmunocompetentes normalmente no presentan síntomas graves o ninguno, mientras que la muerte o complicaciones graves pueden resultar en individuos inmunodeprimidos. [40]
Se ha demostrado que T. gondii produce una proteína llamada GRA28, liberada por la vía secretora MYR1, que interfiere con la expresión genética en las células infectadas y da como resultado células que se comportan como células dendríticas y se vuelven altamente móviles en el cuerpo. [41]
Dado que el parásito puede cambiar la respuesta inmune del huésped, también puede tener un efecto, positivo o negativo, en la respuesta inmune a otras amenazas patógenas. [34] Esto incluye, pero no se limita a, las respuestas a infecciones por Helicobacter felis , Leishmania major u otros parásitos, como Nippostrongylus brasiliensis . [34]
La toxoplasmosis se transmite generalmente por la boca cuando se ingieren accidentalmente ooquistes de Toxoplasma gondii o quistes tisulares. [42] También puede producirse transmisión congénita de la madre al feto. [43] La transmisión también puede ocurrir durante el proceso de trasplante de órganos sólidos [44] o trasplantes de células madre hematógenas. [45]
La transmisión oral puede ocurrir a través de:
Los gatos excretan el patógeno en sus heces durante varias semanas después de contraer la enfermedad, generalmente al comer un huésped intermediario infectado que podría incluir mamíferos (como roedores) o pájaros. La eliminación de ooquistes generalmente comienza a partir del tercer día después de la ingestión de huéspedes intermediarios infectados y puede continuar durante semanas. Los ooquistes no son infecciosos cuando se excretan. Después de aproximadamente un día, el ooquiste sufre un proceso llamado esporulación y se vuelve potencialmente patógeno. [52] Además de los gatos, las aves y los mamíferos, incluidos los seres humanos, también son huéspedes intermediarios del parásito y están involucrados en el proceso de transmisión. Sin embargo, la patogenicidad varía con la edad y la especie involucrada en la infección y el modo de transmisión de T. gondii . [53]
La toxoplasmosis también puede transmitirse a través de trasplantes de órganos sólidos. Los receptores seronegativos al toxoplasma que reciben órganos de donantes seropositivos al toxoplasma recientemente infectados corren riesgo. Los receptores de órganos que tienen toxoplasmosis latente corren el riesgo de que la enfermedad se reactive en su sistema debido a la inmunosupresión que se produce durante el trasplante de órganos sólidos. [44] Los receptores de trasplantes hematógenos de células madre pueden experimentar un mayor riesgo de infección debido a períodos más prolongados de inmunosupresión. [45]
Los trasplantes de corazón y pulmón son los que presentan el mayor riesgo de infección por toxoplasmosis debido al músculo estriado que compone el corazón, [44] que puede contener quistes, y los riesgos para otros órganos y tejidos varían ampliamente. [54] El riesgo de transmisión se puede reducir examinando a los donantes y receptores antes del procedimiento de trasplante y brindándoles tratamiento. [54]
La toxoplasmosis congénita es una forma específica de toxoplasmosis en la que un feto no nacido se infecta a través de la placenta . [55] La toxoplasmosis congénita se asocia con muerte fetal y aborto espontáneo, y en los bebés, se asocia con hidrocefalia, calcificaciones cerebrales y coriorretinitis , lo que lleva a encefalopatía y posiblemente ceguera. [6] Si una mujer recibe su primera exposición a T. gondii durante el embarazo, el feto corre un riesgo particular. [6] Una simple extracción de sangre en la primera visita médica prenatal puede determinar si una mujer ha tenido o no exposición previa y, por lo tanto, si está o no en riesgo. Un título de anticuerpos positivo indica exposición previa e inmunidad, y garantiza en gran medida la seguridad del feto no nacido.
No existe mucha evidencia sobre el efecto de la educación antes del embarazo para prevenir la toxoplasmosis congénita. [56] Sin embargo, se ha sugerido que educar a los padres antes del nacimiento del bebé es eficaz porque puede mejorar la higiene alimentaria, personal y de las mascotas. [56] Se necesita más investigación para determinar si la educación prenatal puede reducir la toxoplasmosis congénita. [56]
En el caso de las mujeres embarazadas con títulos de anticuerpos negativos, lo que indica que no han estado expuestas a T. gondii anteriormente , se recomienda realizar pruebas serológicas con una frecuencia mensual, ya que el tratamiento durante el embarazo para aquellas mujeres expuestas a T. gondii por primera vez reduce drásticamente el riesgo de transmitir el parásito al feto. Dado que el sistema inmunológico de un bebé no se desarrolla completamente durante el primer año de vida y los quistes resistentes que se forman en todo el cuerpo son muy difíciles de erradicar con antiprotozoarios, una infección puede ser muy grave en los jóvenes. [ cita requerida ]
A pesar de estos riesgos, en la mayoría de los países no se realizan pruebas de detección de toxoplasmosis de forma rutinaria a las mujeres embarazadas, por razones de relación coste-eficacia y por el elevado número de falsos positivos generados; Portugal , [57] Francia , [58] Austria , [58] Uruguay , [59] e Italia [60] son excepciones notables, y algunos programas regionales de detección funcionan en Alemania , Suiza y Bélgica . [60] Como las pruebas prenatales invasivas implican cierto riesgo para el feto (18,5 pérdidas de embarazo por caso de toxoplasmosis evitado), [58] se prefiere la detección posnatal o neonatal . Las excepciones son los casos en los que se detectan anomalías fetales y, por tanto, la detección puede ser específica. [58]
Las mujeres embarazadas deben evitar manipular carne cruda , beber leche cruda (especialmente leche de cabra) y se les debe aconsejar que no coman carne cruda o poco cocida, independientemente del tipo. [61] Debido a la obvia relación entre Toxoplasma y gatos, también se suele aconsejar evitar la exposición a las heces de gato y abstenerse de hacer jardinería (las heces de gato son comunes en la tierra del jardín) o al menos usar guantes cuando se hace eso. [61] La mayoría de los gatos no eliminan activamente ooquistes , ya que se infectan en los primeros seis meses de su vida, cuando eliminan ooquistes durante un corto período de tiempo (1 a 2 semanas). [62] Sin embargo, estos ooquistes se entierran en el suelo, esporulan y siguen siendo infecciosos durante períodos que van desde varios meses hasta más de un año. [61] Numerosos estudios han demostrado que vivir en un hogar con un gato no es un factor de riesgo significativo para la infección por T. gondii , [61] [63] [64] aunque vivir con varios gatitos tiene cierta importancia. [65]
En 2006, un equipo de investigación checo [66] descubrió que las mujeres con altos niveles de anticuerpos contra la toxoplasmosis tenían significativamente más probabilidades de dar a luz niños que niñas. En la mayoría de las poblaciones, la tasa de natalidad es de alrededor del 51% de niños, pero las personas infectadas con T. gondii tenían hasta un 72% de probabilidades de tener un niño. [67]
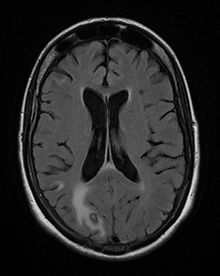
La toxoplasmosis en humanos se diagnostica mediante métodos biológicos, serológicos, histológicos o moleculares, o mediante alguna combinación de los anteriores. [62] La toxoplasmosis puede ser difícil de distinguir del linfoma primario del sistema nervioso central . Sus síntomas imitan a los de otras enfermedades infecciosas, por lo que los signos clínicos no son específicos y no son lo suficientemente característicos para un diagnóstico definitivo. Un ensayo fallido de terapia antimicrobiana ( pirimetamina , sulfadiazina y ácido folínico ( USAN : leucovorina)), hace que un diagnóstico alternativo sea más probable. [ cita requerida ]
T. gondii también puede detectarse en sangre , líquido amniótico o líquido cefalorraquídeo mediante la reacción en cadena de la polimerasa . [68] T. gondii puede existir en un huésped como un quiste inactivo que probablemente evadiría la detección. [ cita requerida ]
Las pruebas serológicas pueden detectar anticuerpos contra T. gondii en el suero sanguíneo, utilizando métodos que incluyen la prueba de coloración Sabin-Feldman (DT), el ensayo de hemaglutinación indirecta , el ensayo de anticuerpos fluorescentes indirectos (IFA) , la prueba de aglutinación directa , la prueba de aglutinación de látex (LAT), el ensayo inmunoabsorbente ligado a enzimas (ELISA) y la prueba de ensayo de aglutinación inmunoabsorbente (IAAT). [62]
Las pruebas más utilizadas para medir los anticuerpos IgG son la DT, la ELISA, la IFA y la prueba de aglutinación directa modificada. [69] Los anticuerpos IgG suelen aparecer una o dos semanas después de la infección, alcanzan su punto máximo en uno o dos meses y luego disminuyen a distintos ritmos. [69] Los anticuerpos IgG de Toxoplasma generalmente persisten de por vida y, por lo tanto, pueden estar presentes en el torrente sanguíneo como resultado de una infección actual o previa. [70]
Hasta cierto punto, las infecciones agudas por toxoplasmosis pueden diferenciarse de las infecciones crónicas mediante una prueba de avidez de IgG , que es una variación de la prueba ELISA. En la primera respuesta a la infección, la IgG específica del toxoplasma tiene una baja afinidad por el antígeno del toxoplasma; en las semanas y meses siguientes, la afinidad de la IgG por el antígeno aumenta. Según la prueba de avidez de IgG, si la IgG en el individuo infectado tiene una alta afinidad, significa que la infección comenzó entre tres y cinco meses antes de la prueba. Esto es particularmente útil en la infección congénita, donde el estado de embarazo y la edad gestacional en el momento de la infección determinan el tratamiento. [71]
A diferencia de la IgG, los anticuerpos IgM se pueden utilizar para detectar infecciones agudas, pero generalmente no infecciones crónicas. [70] Los anticuerpos IgM aparecen antes después de la infección que los anticuerpos IgG y desaparecen más rápido que los anticuerpos IgG después de la recuperación. [62] En la mayoría de los casos, los anticuerpos IgM específicos de T. gondii se pueden detectar por primera vez aproximadamente una semana después de adquirir la infección primaria y disminuyen en un plazo de uno a seis meses; el 25% de los infectados son negativos para la IgM específica de T. gondii en un plazo de siete meses. [70] Sin embargo, la IgM puede detectarse meses o años después de la infección, durante la fase crónica, y son posibles los falsos positivos para la infección aguda. [69] Las pruebas más utilizadas para la medición de anticuerpos IgM son la IgM-ELISA de doble sándwich , la prueba IFA y el ensayo de aglutinación inmunoabsorbente (IgM-ISAGA). Los kits de prueba comerciales a menudo tienen una baja especificidad y los resultados informados se malinterpretan con frecuencia. [69]
En 2021, se evaluaron veinte ensayos comerciales de IgG anti- Toxoplasma en una revisión sistemática , en comparación con un método de referencia aceptado. [72] La mayoría de ellos fueron inmunoensayos enzimáticos, seguidos de pruebas de aglutinación, pruebas inmunocromatográficas y un ensayo Western-Blot . La sensibilidad media de los ensayos de IgG osciló entre el 89,7% y el 100% para títulos estándar y entre el 13,4% y el 99,2% para títulos bajos de IgG. Algunos estudios señalaron la capacidad de algunos métodos, especialmente WB para detectar IgG temprano después de la infección primaria. La especificidad de los ensayos de IgG fue generalmente alta, oscilando entre el 91,3% y el 100%; y superior al 99% para la mayoría de los ensayos EIA. El valor predictivo positivo (VPP) no fue un indicador discriminante entre los métodos, mientras que se informaron disparidades significativas (87,5-100%) entre los valores predictivos negativos (VPN), un parámetro clave que evalúa la capacidad de descartar definitivamente una infección por Toxoplasma en pacientes con riesgo de infecciones oportunistas. [72]

Las recomendaciones para el diagnóstico de la toxoplasmosis congénita incluyen: diagnóstico prenatal basado en pruebas de líquido amniótico y exámenes de ultrasonido ; diagnóstico neonatal basado en pruebas moleculares de placenta y sangre del cordón umbilical y pruebas serológicas comparativas madre-hijo y un examen clínico al nacer; y diagnóstico en la primera infancia basado en exámenes neurológicos y oftalmológicos y una encuesta serológica durante el primer año de vida. [55] Durante el embarazo, se recomienda realizar pruebas serológicas a intervalos de tres semanas. [73]
Aunque el diagnóstico de la toxoplasmosis depende en gran medida de la detección serológica de inmunoglobulina anti- Toxoplasma específica , las pruebas serológicas tienen limitaciones. Por ejemplo, pueden no detectar la fase activa de la infección por T. gondii porque la IgG o IgM anti- Toxoplasma específica puede no producirse hasta después de varias semanas de infección. Como resultado, una mujer embarazada puede dar negativo en la prueba durante la fase activa de la infección por T. gondii , lo que lleva a una toxoplasmosis congénita no detectada y, por lo tanto, no tratada. [74] Además, la prueba puede no detectar infecciones por T. gondii en pacientes inmunodeprimidos porque los títulos de IgG o IgM anti - Toxoplasma específica pueden no aumentar en este tipo de pacientes. [ cita requerida ]
Se han desarrollado muchas técnicas basadas en PCR para diagnosticar la toxoplasmosis utilizando muestras clínicas que incluyen líquido amniótico, sangre , líquido cefalorraquídeo y biopsia de tejido . La técnica basada en PCR más sensible es la PCR anidada , seguida de la hibridación de los productos de PCR. [74] La principal desventaja de estas técnicas es que requieren mucho tiempo y no proporcionan datos cuantitativos. [74]
La PCR en tiempo real es útil para la detección de patógenos, la expresión y regulación de genes y la discriminación alélica. Esta técnica de PCR utiliza la actividad de la nucleasa 5' de la ADN polimerasa Taq para escindir una sonda de hibridación no extensible marcada con fluorescencia durante la fase de extensión de la PCR. [74] Un segundo colorante fluorescente, por ejemplo, 6-carboxi-tetrametil-rodamina, extingue la fluorescencia de la sonda intacta. [74] La escisión de la sonda de hibridación por la nucleasa durante la PCR libera el efecto de extinción, lo que da como resultado un aumento de la fluorescencia proporcional a la cantidad de producto de PCR, que puede controlarse mediante un detector de secuencias. [74]
Los ganglios linfáticos afectados por Toxoplasma presentan cambios característicos, incluidos centros germinales reactivos mal delimitados , grupos de células B monocitoides e histiocitos epitelioides dispersos . [ cita requerida ]
La tríada clásica de la toxoplasmosis congénita incluye: coriorretinitis , hidrocefalia y arteriosclerosis intracraneal . [75] Otras consecuencias incluyen sordera neurosensorial, convulsiones y discapacidad intelectual. [76]
La toxoplasmosis congénita también puede afectar la audición del niño. Hasta un 30% de los recién nacidos tienen algún grado de pérdida auditiva neurosensorial. [77] Las habilidades de comunicación del niño también pueden verse afectadas. Un estudio publicado en 2010 examinó a 106 pacientes, todos los cuales recibieron tratamiento para la toxoplasmosis antes de los 2,5 meses. De este grupo, el 26,4% presentó trastornos del lenguaje. [78]
Se recomienda el tratamiento para personas con problemas de salud graves, como las personas con VIH cuyos recuentos de CD4 son inferiores a 200 células/ mm3 . El trimetoprima/sulfametoxazol es el fármaco de elección para prevenir la toxoplasmosis, pero no para tratar la enfermedad activa. Un estudio de 2012 muestra una nueva y prometedora forma de tratar la forma activa y latente de esta enfermedad utilizando dos quinolonas similares a las endoquinas . [79]
Los medicamentos prescritos para la toxoplasmosis aguda son los siguientes: [ cita requerida ]
(Otros antibióticos, como la minociclina , se han utilizado como terapia de rescate ).
Si se produce la infección durante el embarazo, se recomienda espiramicina en el primer trimestre y a principios del segundo, mientras que pirimetamina/sulfadiazina y leucovorina se recomiendan a finales del segundo y tercer trimestre. [81]
En las personas con toxoplasmosis latente, los quistes son inmunes a estos tratamientos, ya que los antibióticos no llegan a los bradizoítos en concentración suficiente.
Los medicamentos prescritos para la toxoplasmosis latente son:
Cuando a una mujer embarazada se le diagnostica toxoplasmosis aguda, se puede utilizar la amniocentesis para determinar si el feto ha sido infectado o no. Cuando una mujer embarazada desarrolla toxoplasmosis aguda, los taquizoítos tienen aproximadamente un 30% de posibilidades de entrar en el tejido placentario y desde allí entrar e infectar al feto. A medida que aumenta la edad gestacional en el momento de la infección, también aumenta la probabilidad de infección fetal. [32]
Si el parásito aún no ha llegado al feto, la espiramicina puede ayudar a prevenir la transmisión placentaria. Si el feto ha sido infectado, la mujer embarazada puede ser tratada con pirimetamina y sulfadiazina , con ácido folínico , después del primer trimestre. Se tratan después del primer trimestre porque la pirimetamina tiene un efecto antifolato, y la falta de ácido fólico puede interferir con la formación del cerebro fetal y causar trombocitopenia . [84] La infección en etapas gestacionales tempranas se correlaciona con peores resultados fetales y neonatales, particularmente cuando la infección no se trata. [85]
Los recién nacidos que reciben un tratamiento antitoxoplasmosis posnatal de 12 meses tienen una baja probabilidad de sufrir pérdida auditiva neurosensorial. [86] Se ha creado información sobre los hitos del tratamiento para niños con toxoplasmosis congénita para este grupo. [87]
Las infecciones por T. gondii se producen en todo el mundo, aunque las tasas de infección difieren significativamente según el país. [26] En el caso de las mujeres en edad fértil, una encuesta de 99 estudios en 44 países encontró que las áreas de mayor prevalencia se encuentran en América Latina (alrededor del 50-80%), partes de Europa central y oriental (alrededor del 20-60%), Oriente Medio (alrededor del 30-50%), partes del sudeste asiático (alrededor del 20-60%) y partes de África (alrededor del 20-55%). [26]
En los Estados Unidos, los datos de la Encuesta Nacional de Examen de Salud y Nutrición (NHANES) de 1999 a 2004 encontraron que el 9,0% de las personas nacidas en los EE. UU. de 12 a 49 años de edad eran seropositivas para anticuerpos IgG contra T. gondii , por debajo del 14,1% medido en la NHANES 1988-1994. [88] En la encuesta de 1999-2004, el 7,7% de las mujeres nacidas en los EE. UU. y el 28,1% de las mujeres nacidas en el extranjero de 15 a 44 años de edad eran seropositivas a T. gondii . [88] Numerosos estudios en los Estados Unidos y muchos países europeos han observado una tendencia a la disminución de la seroprevalencia . [26] Toxoplasma gondii se considera la segunda causa principal de muertes relacionadas con los alimentos y la cuarta causa principal de hospitalizaciones relacionadas con los alimentos en los Estados Unidos. [89]
El protista responsable de la toxoplasmosis es T. gondii . Tres tipos principales de T. gondii son responsables de los patrones de toxoplasmosis en todo el mundo, denominados tipos I, II y III. Estos tres tipos de T. gondii tienen diferentes efectos en ciertos huéspedes, principalmente ratones y humanos, debido a su variación en los genotipos. [90]
Las técnicas actuales de serotipificación sólo pueden separar los parásitos de tipo I o III de los de tipo II. [91]
Debido a que el parásito representa una amenaza particular para los fetos cuando se contrae durante el embarazo, [92] gran parte de los datos epidemiológicos globales sobre T. gondii provienen de pruebas de seropositividad en mujeres en edad fértil. Las pruebas de seropositividad buscan la presencia de anticuerpos contra T. gondii en la sangre, por lo que, si bien la seropositividad garantiza que uno ha estado expuesto al parásito, no garantiza necesariamente que uno esté infectado crónicamente. [93]
Toxoplasma gondii fue descrito por primera vez en 1908 por Nicolle y Manceaux en Túnez, e independientemente por Splendore en Brasil. [11] Splendore reportó el protozoo en un conejo, mientras que Nicolle y Manceaux lo identificaron en un roedor del norte de África, el gundi ( Ctenodactylus gundi ). [42] En 1909 Nicolle y Manceaux diferenciaron el protozoo de Leishmania . [11] Nicolle y Manceaux luego lo llamaron Toxoplasma gondii por la forma curva de su etapa infecciosa (raíz griega toxon = arco). [11]
El primer caso registrado de toxoplasmosis congénita fue en 1923, pero no se identificó como causado por T. gondii . [42] Janků (1923) describió en detalle los resultados de la autopsia de un niño de 11 meses que se había presentado en el hospital con hidrocefalia . El niño tenía marcas clásicas de toxoplasmosis, incluida la coriorretinitis (inflamación de la coroides y la retina del ojo). [42] La histología reveló una serie de "esporocitos", aunque Janků no los identificó como T. gondii . [42]
No fue hasta 1937 que se realizó el primer análisis científico detallado de T. gondii utilizando técnicas previamente desarrolladas para analizar virus. [11] En 1937 Sabin y Olitsky analizaron T. gondii en monos y ratones de laboratorio. Sabin y Olitsky demostraron que T. gondii era un parásito intracelular obligado y que los ratones alimentados con tejido contaminado con T. gondii también contraían la infección. [11] De esta forma, Sabin y Olitsky demostraron que T. gondii era un patógeno transmisible entre animales. [ cita requerida ]
T. gondii fue descrito por primera vez como un patógeno humano en 1939 en el Babies Hospital de la ciudad de Nueva York . [11] [94] Wolf, Cowen y Paige identificaron la infección por T. gondii en una niña que nació a término por cesárea . [42] La niña desarrolló convulsiones y tuvo coriorretinitis en ambos ojos a los tres días. Luego, la niña desarrolló encefalomielitis y murió al mes de edad. Wolf, Cowen y Paige aislaron T. gondii de lesiones de tejido cerebral. La inyección intracraneal de muestras de cerebro y médula espinal en ratones, conejos y ratas produjo encefalitis en los animales. [11] Wolf, Cowen y Page revisaron casos adicionales y concluyeron que T. gondii producía síntomas reconocibles y podía transmitirse de madre a hijo. [42]
El primer caso de toxoplasmosis en adultos se informó en 1940 sin signos neurológicos. Pinkerton y Weinman informaron de la presencia de Toxoplasma en un hombre de 22 años de Perú que murió a causa de una infección bacteriana posterior y fiebre. [42]
En 1948, Sabin y Feldman crearon una prueba de coloración serológica basada en la capacidad de los anticuerpos del paciente para alterar la tinción de Toxoplasma . [11] [95] La prueba de coloración Sabin Feldman es ahora el estándar de oro para identificar la infección por Toxoplasma . [11]
La transmisión de Toxoplasma a través del consumo de carne cruda o poco cocida fue demostrada por Desmonts et al. en 1965, en París. [11] Desmonts observó que el consumo terapéutico de carne cruda de res o de caballo en un hospital para tuberculosos se asociaba con un aumento del 50% anual en los anticuerpos de Toxoplasma . [11] Esto significa que se transmitía más T. gondii a través de la carne cruda.
En 1974, Desmonts y Couvreur demostraron que la infección durante los dos primeros trimestres produce el mayor daño al feto, que la transmisión dependía de cuándo se infectaban las madres durante el embarazo, que las madres con anticuerpos antes del embarazo no transmitían la infección al feto y que la espiramicina reducía la transmisión al feto. [42]
El toxoplasma ganó más atención en la década de 1970 con el aumento del tratamiento inmunosupresor administrado después de los trasplantes de órganos o médula ósea y la epidemia de SIDA de la década de 1980. [11] Los pacientes con una función reducida del sistema inmunológico son mucho más susceptibles a la enfermedad.
El término "síndrome de la loca de los gatos" fue acuñado por las organizaciones de noticias para describir los hallazgos científicos que vinculan al parásito Toxoplasma gondii con varios trastornos mentales y problemas de conducta. [96] [97] La sospecha de correlación entre la posesión de un gato en la infancia y el desarrollo posterior de esquizofrenia sugirió que se necesitaban más estudios para determinar un factor de riesgo para los niños; [98] sin embargo, un estudio posterior descubrió que la posesión de un gato en la infancia no predecía experiencias psicóticas a los 13 o 18 años. [99] Los investigadores también descubrieron que la posesión de un gato no aumenta considerablemente el riesgo de una infección por T. gondii en mujeres embarazadas. [61] [100]
El término síndrome de la loca de los gatos se basa tanto en estereotipos como en referencias culturales populares. Se originó cuando se observaron casos de las afecciones mencionadas anteriormente entre la población. Una loca de los gatos es un estereotipo cultural de una mujer que acumula y adora compulsivamente gatos. El biólogo Jaroslav Flegr es un defensor de la teoría de que la toxoplasmosis afecta el comportamiento humano. [101] [102]


Aunque T. gondii tiene la capacidad de infectar prácticamente a todos los animales de sangre caliente, la susceptibilidad y las tasas de infección varían ampliamente entre diferentes géneros y especies . [112] [113] Las tasas de infección en poblaciones de la misma especie también pueden variar ampliamente debido a diferencias en la ubicación, la dieta y otros factores. [ cita requerida ]
Aunque se ha observado infección por T. gondii en varias especies de primates asiáticos, se encontró por primera vez seroprevalencia de anticuerpos contra T. gondii en macacos de toque ( Macaca sinica ), que son endémicos de la isla de Sri Lanka. [114]
Los marsupiales australianos son particularmente susceptibles a la toxoplasmosis. [115] Los ualabíes , koalas , wombats , pademelones y pequeños daşyuridos pueden morir a causa de ella, y los bandicuts barrados del este suelen morir en unas 3 semanas después de la infección. [116]
Se estima que el 23% de los cerdos salvajes en todo el mundo son seropositivos para T. gondii . [117] La seroprevalencia varía en todo el mundo, con la seroprevalencia más alta en América del Norte (32%) y Europa (26%) y la más baja en Asia (13%) y América del Sur (5%). [117] Las regiones geográficas ubicadas en latitudes más altas y las regiones que experimentan climas más cálidos y húmedos están asociadas con una mayor seroprevalencia de T. gondii entre los jabalíes. [117] Los jabalíes infectados con T. gondii plantean un riesgo potencial para la salud de los humanos que consumen su carne. [117]
Entre el ganado , los cerdos, [118] [119] [120] las ovejas [121] y las cabras tienen las tasas más altas de infección crónica por T. gondii . [122] La prevalencia de T. gondii en animales productores de carne varía ampliamente tanto dentro como entre países, [122] y se ha demostrado que las tasas de infección están influenciadas dramáticamente por las diferentes prácticas agrícolas y de manejo. [14] Por ejemplo, los animales mantenidos al aire libre o en entornos de libre pastoreo tienen mayor riesgo de infección que los animales criados en interiores o en operaciones de confinamiento comercial . [14] [47]
A nivel mundial, se ha medido que el porcentaje de cerdos que albergan parásitos viables es de 3 a 71,43% [120] y en los Estados Unidos (a través de bioensayos en ratones o gatos) es tan alto como 92,7% y tan bajo como 0%, dependiendo de la granja o el rebaño. [47] Las encuestas de seroprevalencia ( anticuerpos de T. gondii en sangre) son más comunes, y tales mediciones son indicativas de la alta seroprevalencia relativa en cerdos en todo el mundo. [123] Se ha encontrado que los lechones neonatales experimentan todo el rango de gravedad, incluida la progresión a muerte fetal . [124] [118] : 95 Esto se demostró especialmente en el fundacional Thiptara et al. 2006, informando sobre el nacimiento de una camada de tres mortinatos y seis vivos en Tailandia. Esta observación ha sido relevante no solo para ese país sino para el control de la toxoplasmosis en la porcicultura en todo el mundo. [125] [118] : 95 [120]
Junto con los cerdos, las ovejas y las cabras se encuentran entre los animales de ganado más comúnmente infectados de importancia epidemiológica para la infección humana. [122] Se ha medido (mediante bioensayo) que la prevalencia de T. gondii viable en tejido de ovejas es tan alta como el 78% en los Estados Unidos, [126] y una encuesta de 2011 de cabras destinadas al consumo en los Estados Unidos encontró una seroprevalencia del 53,4%. [127] Actualmente, hay disponible una única vacuna viva atenuada, Toxovax, para mitigar los impactos negativos de la toxoplasmosis congénita en la industria ovina. [128] [129]
Debido a la falta de exposición al aire libre, los pollos criados en operaciones de confinamiento en interiores a gran escala no suelen infectarse con T. gondii . [14] Los pollos criados en libertad o en el patio trasero se infectan con mucha más frecuencia. [14] Una encuesta de pollos criados en libertad en los Estados Unidos encontró que su prevalencia era del 17 al 100 %, según la granja. [130] Debido a que la carne de pollo generalmente se cocina completamente antes del consumo, las aves de corral generalmente no se consideran un factor de riesgo significativo para la infección humana por T. gondii . [131]
Aunque el ganado vacuno y los búfalos pueden infectarse con T. gondii , el parásito generalmente se elimina o se reduce a niveles indetectables unas pocas semanas después de la exposición. [14] Los quistes tisulares rara vez están presentes en la carne de búfalo o de res, y la carne de estos animales se considera de bajo riesgo de albergar parásitos viables. [47] [122] [132]
Se considera que los caballos son resistentes a la infección crónica por T. gondii . [14] Sin embargo, se han aislado células viables de caballos estadounidenses sacrificados para la exportación, y la toxoplasmosis humana grave en Francia se ha vinculado epidemiológicamente con el consumo de carne de caballo . [47] [133]
En 1942, se diagnosticó y notificó el primer caso de toxoplasmosis felina en un gato doméstico en Middletown, Nueva York. [134] Los investigadores aislaron ooquistes de heces felinas y descubrieron que podían ser infecciosos hasta 12 meses en el medio ambiente. [135]
La seroprevalencia de T. gondii en gatos domésticos a nivel mundial se ha estimado en alrededor del 30-40% [136] y exhibe una variación geográfica significativa. En los Estados Unidos, no se ha realizado una estimación nacional oficial, pero las encuestas locales han mostrado niveles que varían entre el 16% y el 80%. [136] Una encuesta de 2012 de 445 gatos domésticos de raza pura y 45 gatos de refugio en Finlandia encontró una seroprevalencia general del 48,4%, [137] mientras que una encuesta de 2010 de gatos salvajes de Giza, Egipto, encontró una tasa de seroprevalencia del 97,4%. [138] Otra encuesta de Colombia registró una seroprevalencia del 89,3%, [139] mientras que un estudio chino ( Guangdong ) encontró solo una prevalencia del 2,1%. [140]
Las tasas de infección por T. gondii en gatos domésticos varían ampliamente dependiendo de la dieta y el estilo de vida de los gatos. [141] Los gatos salvajes que cazan para alimentarse tienen más probabilidades de infectarse que los gatos domésticos y, naturalmente, también depende de la prevalencia de presas infectadas por T. gondii, como pájaros y pequeños mamíferos . [142]
La mayoría de los gatos infectados expulsan ooquistes en sus heces solo una vez en su vida, generalmente durante 3 a 10 días después de la infección. Esta excreción puede liberar millones de ooquistes, cada uno capaz de propagarse y sobrevivir durante meses. Después de la infección, la mayoría de los gatos desarrollarán anticuerpos contra T. gondii y ya no expulsarán ooquistes. [143] [136] Se estima que el 1% de los gatos en un momento dado expulsan ooquistes de forma activa. [14]
Es difícil controlar la población de gatos con ooquistes infectados debido a la falta de una vacuna aprobada. Esto sigue siendo un desafío en la mayoría de los casos, y los programas que están disponibles son de eficacia cuestionable. [129] [144] [145] La investigación sobre vacunas felinas contra la toxoplasmosis está en curso, y varias candidatas han mostrado resultados positivos en ensayos clínicos. [129] [145]
Los métodos actuales de control de T. gondii en gatos generalmente se basan en evitar que cacen (donde podrían adquirir el parásito), no permitir que el gato consuma carne cruda y mantener una buena higiene alrededor de las cajas de arena para minimizar la contaminación ambiental por ooquistes. [146] [143]
Se ha demostrado que la infección con T. gondii altera el comportamiento de ratones y ratas de maneras que se cree que aumentan las posibilidades de que los roedores sean presa de los gatos. [147] [148] [149] Los roedores infectados muestran una reducción en su aversión innata a los olores de gato; mientras que los ratones y ratas no infectados generalmente evitarán las áreas marcadas con orina de gato o con olor corporal de gato, esta evitación se reduce o elimina en los animales infectados. [147] [149] [150] Además, algunas evidencias sugieren que esta pérdida de aversión puede ser específica de los olores felinos: cuando se les da la opción entre dos olores de depredadores (gato o visón ), los roedores infectados muestran una preferencia significativamente más fuerte por los olores de gato que los controles no infectados . [151] [152]
En roedores, los cambios de comportamiento inducidos por T. gondii ocurren a través de la remodelación epigenética en neuronas asociadas con los comportamientos observados; [153] [154] por ejemplo, modifica la metilación epigenética para inducir la hipometilación de genes relacionados con la vasopresina arginina en la amígdala medial para disminuir en gran medida la aversión a los depredadores. [153] [154] También se han observado cambios de comportamiento inducidos epigenéticamente similares en modelos de adicción en ratones, donde los cambios en la expresión de enzimas modificadoras de histonas a través de la eliminación de genes o la inhibición enzimática en neuronas específicas produjeron alteraciones en los comportamientos relacionados con las drogas. [155] [156] [157] La acetilación generalizada de histonas-lisinas en astrocitos corticales parece ser otro mecanismo epigenético empleado por T. gondii . [158] [159]
Los roedores infectados con T. gondii muestran una serie de cambios de comportamiento más allá de las respuestas alteradas a los olores de gato. Las ratas infectadas con el parásito muestran mayores niveles de actividad y una disminución del comportamiento neofóbico . [160] De manera similar, los ratones infectados muestran alteraciones en los patrones de locomoción y comportamiento exploratorio durante las pruebas experimentales. Estos patrones incluyen viajar mayores distancias, moverse a mayor velocidad, acelerar durante períodos de tiempo más largos y mostrar un tiempo de pausa reducido cuando se los coloca en nuevas arenas. [161] También se ha demostrado que los roedores infectados tienen menor ansiedad , utilizando modelos tradicionales como laberintos elevados en cruz , arenas de campo abierto y pruebas de interacción social. [161] [162]
Un estudio de la Universidad de California, Davis, sobre nutrias marinas muertas recolectadas entre 1998 y 2004 descubrió que la toxoplasmosis era la causa de muerte del 13% de los animales. [163] La proximidad a los desagües de agua dulce que dan al océano era un factor de riesgo importante. La ingestión de ooquistes de las heces de gato se considera la fuente última más probable. [164] La escorrentía superficial que contiene heces de gatos salvajes y la basura de gatos domésticos tirada por los inodoros son posibles fuentes de ooquistes. [165] [166] Estas mismas fuentes también pueden haber introducido la infección por toxoplasmosis en la foca monje hawaiana en peligro de extinción . [167] La infección con el parásito ha contribuido a la muerte de al menos cuatro focas monje hawaianas. [167] La infección de una foca monje hawaiana con T. gondii se observó por primera vez en 2004. [168] La propagación del parásito amenaza la recuperación de este pinnípedo en gran peligro de extinción. Se han encontrado parásitos en delfines y ballenas. [169] [170] Los investigadores Black y Massie creen que las anchoas, que viajan desde los estuarios hasta el océano abierto, pueden estar ayudando a propagar la enfermedad. [171]
Se ha informado que Toxoplasma gondii fue la causa de la muerte de un panda gigante mantenido en un zoológico en China, que murió en 2014 de gastroenteritis aguda y enfermedad respiratoria . [111] Aunque aparentemente es anecdótico , este informe enfatiza que es probable que todas las especies de sangre caliente sean infectadas por T. gondii , incluidas las especies en peligro de extinción como el panda gigante. [ cita requerida ]

Tradicionalmente, la infección crónica por T. gondii se ha considerado asintomática en personas con una función inmunitaria normal. [172] Algunas evidencias sugieren que la infección latente puede influir sutilmente en una variedad de comportamientos y tendencias humanas, y la infección puede alterar la susceptibilidad o la intensidad de una serie de trastornos psiquiátricos o neurológicos. [173] [172]
En la mayoría de los estudios actuales en los que se han encontrado correlaciones positivas entre los títulos de anticuerpos de T. gondii y ciertos rasgos de comportamiento o trastornos neurológicos, las pruebas de seropositividad de T. gondii se realizan después de la aparición de la enfermedad o el rasgo de comportamiento examinado; es decir, a menudo no está claro si la infección con el parásito aumenta las probabilidades de tener un determinado rasgo o trastorno, o si tener un determinado rasgo o trastorno aumenta las probabilidades de infectarse con el parásito. [174] Los grupos de individuos con ciertos rasgos de comportamiento o trastornos neurológicos pueden compartir ciertas tendencias de comportamiento que aumentan la probabilidad de exposición e infección con T. gondii ; como resultado, es difícil confirmar las relaciones causales entre las infecciones por T. gondii y los trastornos neurológicos o rasgos de comportamiento asociados. [174]
Algunas evidencias vinculan a T. gondii con la esquizofrenia . [172] Dos metaanálisis de 2012 encontraron que las tasas de anticuerpos contra T. gondii en personas con esquizofrenia eran 2,7 veces más altas que en los controles. [175] [176] Por lo tanto, la positividad de anticuerpos contra T. gondii se consideró un factor de riesgo intermedio en relación con otros factores de riesgo conocidos. [175] Las precauciones señaladas incluyen que las pruebas de anticuerpos no detectan la toxoplasmosis directamente, la mayoría de las personas con esquizofrenia no tienen anticuerpos para la toxoplasmosis y podría existir un sesgo de publicación . [176] Si bien la mayoría de estos estudios analizaron a personas ya diagnosticadas con esquizofrenia en busca de anticuerpos contra T. gondii , se han encontrado asociaciones entre T. gondii y esquizofrenia antes del inicio de los síntomas de esquizofrenia. [147] Las diferencias de sexo en la edad de aparición de la esquizofrenia pueden explicarse en parte por un segundo pico de incidencia de la infección por T. gondii durante las edades de 25 a 30 años solo en mujeres. [177] Aunque no está claro un mecanismo que respalde la asociación entre la esquizofrenia y la infección por T. gondii , los estudios han investigado una base molecular de esta correlación. [177] Los fármacos antipsicóticos utilizados en la esquizofrenia parecen inhibir la replicación de los taquizoítos de T. gondii en cultivos celulares. [147] Suponiendo que exista un vínculo causal entre T. gondii y la esquizofrenia, los estudios aún tienen que determinar por qué solo algunos individuos con toxoplasmosis latente desarrollan esquizofrenia; algunas explicaciones plausibles incluyen diferentes susceptibilidad genética, diferencias en la cepa del parásito y diferencias en la ruta de la infección adquirida por T. gondii . [178]
También se han encontrado correlaciones entre los títulos de anticuerpos contra T. gondii y el TOC , así como el suicidio entre personas con trastornos del estado de ánimo, incluido el trastorno bipolar . [173] [179] Los títulos de anticuerpos positivos contra T. gondii parecen no estar correlacionados con la depresión mayor o la distimia . [180] Aunque existe una correlación entre T. gondii y muchos trastornos psicológicos, el mecanismo subyacente no está claro. Un estudio de 2016 de 236 personas con altos niveles de anticuerpos contra la toxoplasmosis encontró que "había poca evidencia de que T. gondii estuviera relacionado con un mayor riesgo de trastorno psiquiátrico, control deficiente de los impulsos, aberraciones de la personalidad o deterioro neurocognitivo". [181]
La infección latente se ha relacionado con la enfermedad de Parkinson y la enfermedad de Alzheimer . [173]
Las personas con esclerosis múltiple muestran tasas de infección alrededor de un 15% más bajas que la población general. [182]
La infección latente por T. gondii en humanos se ha asociado con un mayor riesgo de accidentes automovilísticos , [183] posiblemente debido a un rendimiento psicomotor deteriorado o a perfiles de personalidad con mayor propensión a la toma de riesgos. [173]
Se ha informado que el cambio climático afecta la aparición, supervivencia, distribución y transmisión de T. gondii . [184] T. gondii ha sido identificado en el ártico canadiense, un lugar que alguna vez fue demasiado frío para su supervivencia. [185] Las temperaturas más altas aumentan el tiempo de supervivencia de T. gondii . [184] Más deshielo y precipitación pueden aumentar la cantidad de ooquistes de T. gondii que se transportan a través del flujo del río. [184] Los cambios en las poblaciones de aves, roedores e insectos y los patrones de migración pueden afectar la distribución de T. gondii debido a su papel como reservorio y vector. [184] También se sugiere que la urbanización y la degradación ambiental natural afectan la transmisión de T. gondii y aumentan el riesgo de infección. [184]
La toxoplasmosis se está convirtiendo en un peligro para la salud mundial, ya que infecta entre el 30 y el 50 % de la población humana mundial.
La evidencia acumulada sugiere que la infección latente de Toxoplasma gondii está asociada con una variedad de afecciones neuropsiquiátricas y conductuales.
más prominentemente en los músculos, incluido el corazón, y en el hígado, el bazo, los ganglios linfáticos y el SNC.
La seroprevalencia de T. gondii en humanos varía entre el 10 y el 70% en todo el mundo, dependiendo de la región y aumenta significativamente con la edad. Tras la infección, los parásitos persisten como quistes intraneuronales en el sistema nervioso central (SNC) durante la vida del huésped (1, Figura 1). Hasta hace poco, la persistencia de los parásitos en individuos sanos se consideraba clínicamente asintomática. Sin embargo, en la última década, varios informes han indicado que la toxoplasmosis cerebral crónica puede afectar el comportamiento de su huésped (2).
El patógeno zoonótico
Toxoplasma gondii
infecta a más del 30% de la población humana. El parásito intracelular puede persistir de por vida en el SNC dentro de las neuronas modificando su función y estructura, lo que conduce a cambios específicos en el comportamiento del huésped. ... Además, las investigaciones de la población humana han correlacionado la seropositividad
de Toxoplasma
con cambios en las funciones neurológicas; sin embargo, los complejos mecanismos subyacentes de la alteración sutil del comportamiento aún no se comprenden por completo. Los parásitos son capaces de inducir modificaciones directas en las células infectadas, por ejemplo alterando el metabolismo de la dopamina, silenciando funcionalmente las neuronas y obstaculizando la apoptosis.
Nueve de once estudios que utilizaron el cuestionario de autoinforme de los 16 factores de personalidad de Cattell encontraron resultados significativos y consistentes para ambos géneros. Los hombres seropositivos en general tenían un menor respeto por las reglas y una mayor vigilancia (sospechosos, celosos, rígidos/inflexibles) que los hombres seronegativos. Por el contrario, las mujeres seropositivas tenían un mayor respeto por las reglas y una mayor calidez que las mujeres seronegativas. Ambos géneros seropositivos eran más ansiosos que los sujetos de comparación sanos emparejados. ... Se realizaron observaciones y entrevistas de comportamiento para determinar si las diferencias de género encontradas en las medidas de autoinforme se replicaban en las medidas objetivas. Los hombres seropositivos obtuvieron puntuaciones significativamente más bajas que los hombres seronegativos en Autocontrol, Orden en la ropa y Relaciones. Las diferencias fueron menos impresionantes para las mujeres seropositivas, con solo tendencias hacia puntuaciones más altas en Autocontrol y Orden en la ropa en comparación con las mujeres seronegativas. Los autores consideran que los resultados del estudio son una confirmación objetiva de que la presencia de
T. gondii
puede cambiar las conductas de un huésped humano.
{{cite journal}}: CS1 maint: DOI inactive as of October 2024 (link)Las modificaciones epigenéticas causadas por las drogas adictivas desempeñan un papel importante en la plasticidad neuronal y en las respuestas conductuales inducidas por las drogas. Aunque pocos estudios han investigado los efectos de la AMPH en la regulación genética (Tabla 1), los datos actuales sugieren que la AMPH actúa en múltiples niveles para alterar la interacción histona/ADN y para reclutar factores de transcripción que en última instancia causan la represión de algunos genes y la activación de otros genes. Es importante destacar que algunos estudios también han correlacionado la regulación epigenética inducida por la AMPH con los resultados conductuales causados por esta droga, lo que sugiere, por lo tanto, que la remodelación epigenética subyace a los cambios conductuales inducidos por la AMPH. Si esto resulta ser cierto, el uso de fármacos específicos que inhiban la acetilación de histonas, la metilación o la metilación del ADN podría ser una alternativa terapéutica importante para prevenir y/o revertir la adicción a AMPH y mitigar los efectos secundarios que genera el AMPH cuando se usa para tratar el TDAH.
Los aumentos a corto plazo en la acetilación de histonas generalmente promueven respuestas conductuales a las drogas, mientras que los aumentos sostenidos se oponen a los efectos de la cocaína, según las acciones de la administración sistémica o intra-NAc de inhibidores de HDAC. ... El bloqueo genético o farmacológico de G9a en el NAc potencia las respuestas conductuales a la cocaína y los opiáceos, mientras que el aumento de la función de G9a ejerce el efecto opuesto (Maze et al., 2010; Sun et al., 2012a). Esta regulación negativa inducida por fármacos de G9a y H3K9me2 también sensibiliza a los animales a los efectos nocivos del estrés crónico posterior (Covington et al., 2011). La regulación negativa de G9a aumenta la arborización dendrítica de las neuronas NAc y se asocia con una mayor expresión de numerosas proteínas implicadas en la función sináptica, lo que conecta directamente la alteración de G9a/H3K9me2 con la plasticidad sináptica asociada con la adicción (Maze et al., 2010).
"G9a parece ser un punto de control crítico para la regulación epigenética en NAc, ya que sabemos que funciona en dos bucles de retroalimentación negativa. Se opone a la inducción de ΔFosB, un factor de transcripción de larga duración importante para la adicción a las drogas (Robison y Nestler, 2011), mientras que ΔFosB a su vez suprime la expresión de G9a (Maze et al., 2010; Sun et al., 2012a). ... Además, G9a se induce en NAc tras la inhibición prolongada de HDAC, lo que explica la atenuación paradójica de los efectos conductuales de la cocaína observados en estas condiciones, como se señaló anteriormente (Kennedy et al., 2013). Los genes de la subunidad del receptor GABAA se encuentran entre los que están controlados por este bucle de retroalimentación. Por lo tanto, la cocaína crónica, o la inhibición prolongada de HDAC, induce varias subunidades del receptor GABAA en NAc, lo que se asocia con una mayor frecuencia de corrientes postsinápticas inhibidoras (IPSC). En marcado contraste, la exposición combinada La inhibición de la cocaína y la HDAC, que desencadena la inducción de G9a y aumenta los niveles globales de H3K9me2, conduce al bloqueo del receptor GABAA y a la regulación de las IPSC.