

La estructura terciaria del ácido nucleico es la forma tridimensional de un polímero de ácido nucleico . [1] Las moléculas de ARN y ADN son capaces de realizar diversas funciones que van desde el reconocimiento molecular hasta la catálisis . Estas funciones requieren una estructura tridimensional precisa. Si bien estas estructuras son diversas y aparentemente complejas, están compuestas de motivos estructurales terciarios recurrentes y fácilmente reconocibles que sirven como componentes básicos moleculares. Algunos de los motivos más comunes para la estructura terciaria del ARN y el ADN se describen a continuación, pero esta información se basa en un número limitado de estructuras resueltas. Se revelarán muchos más motivos estructurales terciarios a medida que se caractericen estructuralmente nuevas moléculas de ARN y ADN.

La doble hélice es la estructura terciaria dominante del ADN biológico y también es una posible estructura del ARN. Se cree que en la naturaleza se encuentran tres conformaciones de ADN: ADN-A , ADN-B y ADN-Z . Se cree que la forma "B" descrita por James D. Watson y Francis Crick predomina en las células. [2] James D. Watson y Francis Crick describieron esta estructura como una doble hélice con un radio de 10 Å y un paso de 34 Å , que realiza una vuelta completa sobre su eje cada 10 pb de secuencia. [3] La doble hélice da una vuelta completa alrededor de su eje cada 10,4 a 10,5 pares de bases en solución. Esta frecuencia de torsión (conocida como paso helicoidal ) depende en gran medida de las fuerzas de apilamiento que cada base ejerce sobre sus vecinas en la cadena. El ARN de doble hélice adopta una conformación similar a la estructura en forma A.
Son posibles otras conformaciones; de hecho, ahora sólo están disponibles las letras F, Q, U, V e Y para describir cualquier nueva estructura de ADN que pueda aparecer en el futuro. [4] [5] Sin embargo, la mayoría de estas formas se han creado sintéticamente y no se han observado en sistemas biológicos naturales.
El triplete del surco menor es un motivo estructural de ARN ubicuo . Debido a que las interacciones con el surco menor a menudo están mediadas por el 2'-OH del azúcar ribosa , este motivo de ARN tiene un aspecto muy diferente de su equivalente de ADN . El ejemplo más común de un triple de surco menor es el motivo de La menor, o la inserción de bases de adenosina en el surco menor (ver arriba). Sin embargo, este motivo no se limita a las adenosinas, ya que también se ha observado que otras nucleobases interactúan con el surco menor del ARN.
El surco menor presenta un complemento casi perfecto para una base insertada. Esto permite contactos óptimos de van der Waals , extensos enlaces de hidrógeno y enterramiento superficial hidrofóbico , y crea una interacción altamente favorable desde el punto de vista energético. [8] [9] Debido a que los triples de surcos menores son capaces de empaquetar de manera estable un bucle y una hélice libres, son elementos clave en la estructura de los ribonucleótidos grandes , incluido el intrón del grupo I, [10] el intrón del grupo II, [11] y el ribosoma .
Aunque el surco principal del ARN de forma A estándar es bastante estrecho y, por lo tanto, está menos disponible para la interacción triple que el surco menor, se pueden observar interacciones triples del surco mayor en varias estructuras de ARN. Estas estructuras constan de varias combinaciones de pares de bases e interacciones de Hoogsteen. Por ejemplo, el triplete GGC (GGC amino(N-2)-N-7, imino-carbonilo, carbonil-amino(N-4); Watson-Crick) observado en el ribosoma 50S , compuesto por un GC tipo Watson-Crick par y una G entrante que forma una red pseudo-Hoogsteen de interacciones de enlaces de hidrógeno entre ambas bases involucradas en el emparejamiento canónico. [12] Otros ejemplos notables de tripletes de surcos principales incluyen (i) el núcleo catalítico del intrón del grupo II que se muestra en la figura de la izquierda [6] (ii) una triple hélice catalíticamente esencial observada en el ARN de la telomerasa humana [7] (iii) el riboswitch SAM-II [14] y (iv) el elemento de expresión nuclear (ENE), que actúa como elemento de estabilización del ARN mediante la formación de triple hélice con la cola poli(A). [15] [16]
El ADN de triple hebra también es posible a partir de enlaces de hidrógeno de Hoogsteen o de Hoogsteen invertidos en el surco principal del ADN en forma B.
Además de las dobles hélices y las triples antes mencionadas, el ARN y el ADN también pueden formar cuádruples hélices. Existen diversas estructuras de cuádruples de bases de ARN. Cuatro residuos de guanina consecutivos pueden formar un cuádruplex en el ARN mediante enlaces de hidrógeno de Hoogsteen para formar un "anillo de Hoogsteen" (ver figura). [12] Los pares GC y AU también pueden formar cuádruplex de bases con una combinación de emparejamiento Watson-Crick y emparejamiento no canónico en el surco menor . [17]
El núcleo del aptámero verde de malaquita es también una especie de base cuádruple con un patrón de enlaces de hidrógeno diferente (ver figura). [13] El cuádruplex puede repetirse varias veces consecutivas, produciendo una estructura inmensamente estable.
La estructura única de las regiones cuádruplex del ARN puede cumplir diferentes funciones en un sistema biológico. Dos funciones importantes son el potencial de unión con ligandos o proteínas y su capacidad para estabilizar toda la estructura terciaria del ADN o ARN. La estructura fuerte puede inhibir o modular la transcripción y replicación , como en los telómeros de los cromosomas y la UTR del ARNm. [18] La identidad de la base es importante para la unión del ligando. El cuarteto G normalmente se une a cationes monovalentes como el potasio, mientras que otras bases pueden unirse a muchos otros ligandos como la hipoxantina en un cuádruplex UUCU. [17]
Junto con estas funciones, el cuádruplex G en el ARNm alrededor de las regiones de unión a ribosomas podría servir como regulador de la expresión genética en bacterias . [19] Es posible que aún queden estructuras y funciones más interesantes por descubrir in vivo .

El apilamiento coaxial, también conocido como apilamiento helicoidal, es un determinante importante de la estructura terciaria del ARN de orden superior. El apilamiento coaxial ocurre cuando dos dúplex de ARN forman una hélice contigua, que se estabiliza mediante apilamiento de bases en la interfaz de las dos hélices. Se observó apilamiento coaxial en la estructura cristalina de tRNAPhe. [21] Más recientemente, se ha observado apilamiento coaxial en estructuras de orden superior de muchas ribozimas , incluidas muchas formas de intrones autoempalmables del grupo I y del grupo II . Los motivos de apilamiento coaxial comunes incluyen la interacción del bucle de besos y el pseudonudo . La estabilidad de estas interacciones puede predecirse mediante una adaptación de las “reglas de Turner”. [22]
En 1994, Walter y Turner determinaron las contribuciones de energía libre de las interacciones de apilamiento del vecino más cercano dentro de una interfaz hélice-hélice mediante el uso de un sistema modelo que creó una interfaz hélice-hélice entre un oligómero corto y un saliente de cuatro nucleótidos al final de una horquilla. provenir . Sus experimentos confirmaron que la contribución termodinámica del apilamiento de bases entre dos estructuras secundarias helicoidales imita estrechamente la termodinámica de la formación dúplex estándar (las interacciones entre vecinos más cercanos predicen la estabilidad termodinámica de la hélice resultante). La estabilidad relativa de las interacciones con los vecinos más cercanos se puede utilizar para predecir un apilamiento coaxial favorable basándose en una estructura secundaria conocida. Walter y Turner descubrieron que, en promedio, la predicción de la estructura del ARN mejoraba del 67 % al 74 % de precisión cuando se incluían las contribuciones del apilamiento coaxial. [23]
La mayoría de las estructuras terciarias de ARN mejor estudiadas contienen ejemplos de apilamiento coaxial. Algunos ejemplos destacados son el ARNt-Phe, los intrones del grupo I, los intrones del grupo II y los ARN ribosómicos. Las estructuras cristalinas del ARNt revelaron la presencia de dos hélices extendidas que resultan del apilamiento coaxial del tallo aceptor de aminoácidos con el brazo en T y del apilamiento de los brazos D y anticodón. Estas interacciones dentro del ARNt orientan el tallo del anticodón perpendicularmente al tallo del aminoácido, lo que conduce a la estructura terciaria funcional en forma de L. [21] En los intrones del grupo I, se demostró que las hélices P4 y P6 se apilan coaxialmente utilizando una combinación de métodos bioquímicos [24] y cristalográficos. La estructura cristalina de P456 proporcionó una vista detallada de cómo el apilamiento coaxial estabiliza el empaquetamiento de hélices de ARN en estructuras terciarias. [25] En el intrón del grupo II de autoempalme de Oceanobacillus iheyensis, los tallos IA e IB se apilan coaxialmente y contribuyen a la orientación relativa de las hélices constituyentes de una unión de cinco vías. [6] Esta orientación facilita el plegamiento adecuado del sitio activo de la ribozima funcional. El ribosoma contiene numerosos ejemplos de apilamiento coaxial, incluidos segmentos apilados de hasta 70 pb. [26]

Dos motivos comunes que involucran el apilamiento coaxial son los bucles de besos y los pseudonudos. En las interacciones de bucles de besos, las regiones de bucles monocatenarios de dos horquillas interactúan mediante el emparejamiento de bases, formando una hélice compuesta apilada coaxialmente. En particular, esta estructura permite que todos los nucleótidos de cada bucle participen en interacciones de apilamiento y apareamiento de bases. Este motivo fue visualizado y estudiado mediante análisis de RMN por Lee y Crothers. [27] El motivo de pseudonudo ocurre cuando una región monocatenaria de un bucle de horquilla se empareja con una secuencia ascendente o descendente dentro de la misma cadena de ARN. Las dos regiones dúplex resultantes a menudo se apilan una sobre otra, formando una hélice compuesta apilada coaxialmente estable. Un ejemplo de motivo de pseudonudo es la ribozima altamente estable del virus de la hepatitis Delta, en la que la columna vertebral muestra una topología general de pseudonudo doble. [28]
Se ha observado un efecto similar al apilamiento coaxial en estructuras de ADN diseñadas racionalmente . Las estructuras de origami de ADN contienen una gran cantidad de dobles hélices con extremos romos expuestos. Se observó que estas estructuras se pegaban a lo largo de los bordes que contenían estos extremos romos expuestos, debido a las interacciones de apilamiento hidrófobas. [29] Al combinar estas nanoestructuras de ADN diseñadas racionalmente y las imágenes de súper resolución DNA-PAINT, los investigadores discernieron la fuerza individual de apilamiento de energías entre todos los dinucleótidos posibles. [30]

Las interacciones tetrabucle-receptor combinan interacciones de emparejamiento y apilamiento de bases entre los nucleótidos del bucle de un motivo tetrabucle y un motivo receptor ubicado dentro de un dúplex de ARN, creando un contacto terciario que estabiliza el pliegue terciario global de una molécula de ARN . Los tetraloops también son posibles estructuras en dúplex de ADN. [32]
Los bucles de tallo pueden variar mucho en tamaño y secuencia, pero los tetrabucles de cuatro nucleótidos son muy comunes y generalmente pertenecen a una de tres categorías, según la secuencia. [33] Estas tres familias son los tetraloops CUYG, UNCG y GNRA (ver figura a la derecha) . [34] En cada una de estas familias de tetraloop, el segundo y tercer nucleótidos forman una vuelta en la cadena de ARN y un par de bases entre el primer y cuarto nucleótidos estabiliza la estructura del tallo. Se ha determinado, en general, que la estabilidad del tetrabucle depende de la composición de bases dentro del bucle y de la composición de este "par de bases de cierre". [35] La familia de tetraloops GNRA es la que se observa más comúnmente dentro de las interacciones Tetraloop-receptor. Además, se sabe que los tetraloops UMAC son versiones alternativas de los bucles GNRA, y ambos comparten estructuras principales similares; A pesar de las similitudes, difieren en las posibles interacciones de largo alcance de las que son capaces. [36]

Los “motivos del receptor tetraloop” son interacciones terciarias de largo alcance [37] que consisten en enlaces de hidrógeno entre las bases en las secuencias tetraloop a stemloop en secciones distales de la estructura secundaria del ARN. [38] Además de los enlaces de hidrógeno, las interacciones de apilamiento son un componente importante de estas interacciones terciarias. Por ejemplo, en las interacciones GNRA-tetraloop, el segundo nucleótido del tetraloop se apila directamente en un motivo de plataforma A (ver arriba) dentro del receptor. [25] La secuencia del tetraloop y su receptor a menudo covarían, de modo que se puede realizar el mismo tipo de contacto terciario con diferentes isoformas del tetraloop y su receptor afín. [39]
Por ejemplo, el intrón del grupo I de autoempalme se basa en motivos del receptor de tetrabucle para su estructura y función. [25] [38] Específicamente, los tres residuos de adenina del motivo canónico GAAA se apilan en la parte superior de la hélice del receptor y forman múltiples enlaces de hidrógeno estabilizadores con el receptor. La primera adenina de la secuencia GAAA forma un triple par de bases con las bases del receptor AU. La segunda adenina se estabiliza mediante enlaces de hidrógeno con la misma uridina, así como mediante su 2'-OH con el receptor y mediante interacciones con la guanina del tetraloop GAAA. La tercera adenina forma un triple par de bases.
El motivo La menor es un motivo estructural terciario de ARN ubicuo . Se forma mediante la inserción de un nucleósido desapareado en el surco menor de un dúplex de ARN. Como tal, es un ejemplo de triple de surco menor. Aunque la guanosina, la citosina y la uridina también pueden formar interacciones triples de surcos menores, las interacciones de surcos menores por adenina son muy comunes. En el caso de la adenina, el borde N1-C2-N3 de la base de inserción forma enlaces de hidrógeno con uno o ambos de los 2'-OH del dúplex, así como con las bases del dúplex (ver figura: A-interacciones menores ). El dúplex del host suele ser un par de bases de GC.
Los motivos de La menor se han separado en cuatro clases, [8] [9] tipos 0 a III, según la posición de la base de inserción en relación con los dos 2'-OH del par de bases de Watson-Crick . En los motivos A menor de tipo I y II, N3 de adenina se inserta profundamente dentro del surco menor del dúplex (ver figura: Interacciones A menor - interacción tipo II), y hay una buena complementariedad de forma con el par de bases. A diferencia de los tipos 0 y III, las interacciones de tipo I y II son específicas de la adenina debido a las interacciones de enlaces de hidrógeno. En la interacción tipo III, tanto el O2' como el N3 de la base de inserción están menos asociados con el surco menor del dúplex. Los motivos de tipo 0 y III son más débiles y no específicos porque están mediados por interacciones con un solo 2'-OH (ver figura: Interacciones en A menor: interacciones de tipo 0 y tipo III).
El motivo A menor se encuentra entre los motivos estructurales de ARN más comunes en el ribosoma, donde contribuye a la unión del ARNt a la subunidad 23S. [41] Con mayor frecuencia estabilizan las interacciones dúplex de ARN en bucles y hélices, como en el núcleo de los intrones del grupo II. [6]
Un ejemplo interesante de La menor es su papel en el reconocimiento de anticodones . El ribosoma debe discriminar entre pares codón-anticodón correctos e incorrectos. Lo hace, en parte, mediante la inserción de bases de adenina en el surco menor. Los pares codón-anticodón incorrectos presentarán una geometría helicoidal distorsionada, lo que impedirá que la interacción A menor estabilice la unión y aumentará la tasa de disociación del ARNt incorrecto. [42]
Un análisis de los motivos A menor en el ARN ribosomal 23S ha revelado una red jerárquica de dependencias estructurales, que se sugiere que están relacionadas con la evolución ribosomal y con el orden de los eventos que llevaron al desarrollo de la subunidad grande bacteriana moderna. [43]
Se informa que el motivo A menor y su nueva subclase, las interacciones WC/H A menor, fortalecen otras estructuras terciarias de ARN, como las triples hélices del surco principal identificadas en los elementos de estabilización de ARN. [16] [15]
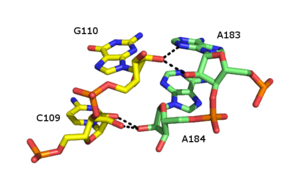
La cremallera de ribosa es un elemento estructural terciario del ARN en el que dos cadenas de ARN se mantienen unidas mediante interacciones de enlaces de hidrógeno que involucran el 2'OH de los azúcares ribosa en diferentes hebras. El 2'OH puede comportarse como donante y aceptor de enlaces de hidrógeno, lo que permite la formación de enlaces de hidrógeno bifurcados con otro 2'OH. [44] [45]
Se han descrito numerosas formas de cremallera de ribosa, pero un tipo común implica cuatro enlaces de hidrógeno entre grupos 2'-OH de dos azúcares adyacentes. Las cremalleras de ribosa suelen aparecer en conjuntos que estabilizan las interacciones entre cadenas de ARN separadas. [46] Las cremalleras de ribosa se observan a menudo como interacciones vástago-bucle con una especificidad de secuencia muy baja. Sin embargo, en las subunidades ribosómicas pequeñas y grandes , existe una propensión a las cremalleras de ribosa de la secuencia CC/AA: dos citosinas en la primera cadena emparejadas con dos adeninas en la segunda cadena.
Los ARN funcionales suelen ser moléculas estables y plegadas con formas tridimensionales en lugar de hebras lineales y flexibles. [48] Los cationes son esenciales para la estabilización termodinámica de las estructuras terciarias del ARN. Los cationes metálicos que se unen al ARN pueden ser monovalentes, divalentes o trivalentes. El potasio (K + ) es un ion monovalente común que se une al ARN. Un ion divalente común que se une al ARN es el magnesio (Mg 2+ ). Se ha descubierto que otros iones, incluidos el sodio (Na + ), el calcio (Ca 2+ ) y el manganeso (Mn 2+ ), se unen al ARN in vivo e in vitro . Los cationes orgánicos multivalentes como la espermidina o la espermina también se encuentran en las células y contribuyen de manera importante al plegamiento del ARN. Los iones trivalentes como la hexamina de cobalto o los iones de lantánido como el terbio (Tb 3+ ) son herramientas experimentales útiles para estudiar la unión de metales al ARN. [49] [50]
Un ion metálico puede interactuar con el ARN de múltiples formas. Un ion puede asociarse de forma difusa con la columna vertebral del ARN, protegiendo interacciones electrostáticas que de otro modo serían desfavorables . Esta detección de carga la realizan a menudo iones monovalentes. Los iones unidos al sitio estabilizan elementos específicos de la estructura terciaria del ARN. Las interacciones ligadas a un sitio se pueden subdividir en dos categorías dependiendo de si el agua media la unión del metal. Las interacciones de la “esfera exterior” están mediadas por moléculas de agua que rodean el ion metálico. Por ejemplo, el hexahidrato de magnesio interactúa y estabiliza motivos específicos de la estructura terciaria del ARN mediante interacciones con guanosina en el surco principal. Por el contrario, las interacciones de la "esfera interior" están mediadas directamente por el ion metálico. El ARN a menudo se pliega en múltiples etapas y estos pasos pueden estabilizarse mediante diferentes tipos de cationes. En las primeras etapas, el ARN forma estructuras secundarias estabilizadas mediante la unión de cationes monovalentes, cationes divalentes y aminas polianiónicas para neutralizar la cadena principal polianiónica. Las últimas etapas de este proceso implican la formación de una estructura terciaria de ARN, que se estabiliza casi en gran medida mediante la unión de iones divalentes como el magnesio con posibles contribuciones de la unión de potasio.
Los sitios de unión de metales a menudo se localizan en el surco principal profundo y estrecho del dúplex de ARN, coordinándose con los bordes de Hoogsteen de las purinas . En particular, los cationes metálicos estabilizan los sitios de torsión de la columna vertebral donde el empaquetamiento apretado de fosfatos da como resultado una región de carga negativa densa. Hay varios motivos de unión a iones metálicos en dúplex de ARN que se han identificado en estructuras cristalinas. Por ejemplo, en el dominio P4-P6 del intrón del grupo I de Tetrahymena thermophila , varios sitios de unión de iones consisten en pares oscilantes GU en tándem y desajustes GA en tándem , en los que cationes divalentes interactúan con el borde Hoogsteen de guanosina a través de O6 y N7. [51] [52] [53] Otro motivo de unión de iones en el intrón del grupo I de Tetrahymena es el motivo de plataforma AA, en el que adenosinas consecutivas en la misma cadena de ARN forman un par de pseudobases no canónicos. [54] A diferencia del motivo GU en tándem, el motivo de plataforma AA se une preferentemente a cationes monovalentes. En muchos de estos motivos, la ausencia de cationes monovalentes o divalentes da como resultado una mayor flexibilidad o una pérdida de la estructura terciaria.
Se ha descubierto que los iones metálicos divalentes, especialmente el magnesio , son importantes para la estructura de las uniones del ADN, como la unión Holliday intermedia en la recombinación genética . El ion magnesio protege los grupos fosfato cargados negativamente en la unión y permite que se coloquen más juntos, lo que permite una conformación apilada en lugar de una conformación no apilada. [55] El magnesio es vital para estabilizar este tipo de uniones en estructuras diseñadas artificialmente utilizadas en la nanotecnología del ADN , como el motivo de doble cruce. [56]
Los primeros trabajos en biología estructural del ARN coincidieron, más o menos, con los trabajos realizados sobre el ADN a principios de los años cincuenta. En su artículo fundamental de 1953, Watson y Crick sugirieron que el hacinamiento de Van der Waals por el grupo 2`OH de la ribosa impediría que el ARN adoptara una estructura de doble hélice idéntica al modelo que propusieron: lo que ahora conocemos como ADN en forma B. [57] Esto provocó preguntas sobre la estructura tridimensional del ARN: ¿podría esta molécula formar algún tipo de estructura helicoidal y, de ser así, cómo?
A mediados de la década de 1960, se estudiaba intensamente el papel del ARNt en la síntesis de proteínas. En 1965, Holley et al. purificó y secuenció la primera molécula de ARNt, proponiendo inicialmente que adoptara una estructura de hoja de trébol, basada en gran medida en la capacidad de ciertas regiones de la molécula para formar estructuras de bucle de tallo. [58] El aislamiento del ARNt resultó ser el primer gran éxito inesperado en la biología estructural del ARN. En 1971, Kim et al. logró otro avance, produciendo cristales de ARNt PHE de levadura que se difractaban a resoluciones de 2-3 Ångström utilizando espermina, una poliamina natural , que se unía al ARNt y lo estabilizaba. [59]
Durante un tiempo considerable después de las primeras estructuras de ARNt, el campo de la estructura del ARN no avanzó dramáticamente. La capacidad de estudiar una estructura de ARN dependía de la posibilidad de aislar el objetivo de ARN. Esto resultó ser una limitación para este campo durante muchos años, en parte porque otros objetivos conocidos (es decir, el ribosoma ) eran significativamente más difíciles de aislar y cristalizar. Como tal, durante unos veinte años después de la publicación original de la estructura del ARNt PHE , solo se resolvieron las estructuras de un puñado de otros objetivos de ARN, y casi todos pertenecían a la familia de ARN de transferencia. [60]
Esta desafortunada falta de alcance eventualmente se superaría en gran medida gracias a dos avances importantes en la investigación de ácidos nucleicos: la identificación de ribozimas y la capacidad de producirlas mediante transcripción in vitro . Después de la publicación de Tom Cech que implicaba al intrón del grupo I de Tetrahymena como una ribozima autocatalítica, [61] y el informe de Sidney Altman sobre la catálisis por ARN de ribonucleasa P, [62] se identificaron varios otros ARN catalíticos a finales de la década de 1980, [63] incluido el tiburón martillo. ribozima. En 1994, McKay et al. publicaron la estructura de un 'complejo inhibidor de ribozima ARN-ADN de cabeza de martillo' con una resolución de 2,6 Ångström, en el que la actividad autocatalítica de la ribozima se interrumpía mediante la unión a un sustrato de ADN. [64] Además de los avances que se están realizando en la determinación de la estructura global mediante cristalografía, a principios de la década de 1990 también se vio la implementación de la RMN como una técnica poderosa en la biología estructural del ARN. Investigaciones como esta permitieron una caracterización más precisa de las interacciones de emparejamiento y apilamiento de bases que estabilizaron los pliegues globales de grandes moléculas de ARN.
El resurgimiento de la biología estructural del ARN a mediados de la década de 1990 ha provocado una verdadera explosión en el campo de la investigación estructural de los ácidos nucleicos. Desde la publicación de las estructuras del tiburón martillo y del P 4-6 , se han realizado numerosas contribuciones importantes al campo. Algunos de los ejemplos más notables incluyen las estructuras de los intrones del Grupo I y del Grupo II , [6] y el Ribosoma . [40] Las primeras tres estructuras se produjeron mediante transcripción in vitro , y la RMN ha desempeñado un papel en la investigación de componentes parciales de las cuatro estructuras, testimonio de lo indispensable de ambas técnicas para la investigación del ARN. El Premio Nobel de Química de 2009 fue otorgado a Ada Yonath , Venkatraman Ramakrishnan y Thomas Steitz por su trabajo estructural sobre el ribosoma , lo que demuestra el papel destacado que ha desempeñado la biología estructural del ARN en la biología molecular moderna.
{{cite journal}}: Más de uno de |pages=y |page=especificado ( ayuda ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )