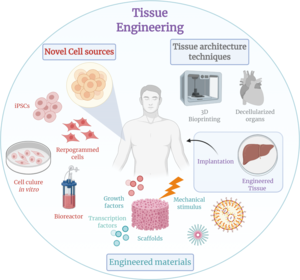
La ingeniería de tejidos es una disciplina de ingeniería biomédica que utiliza una combinación de células , ingeniería , métodos de materiales y factores bioquímicos y fisicoquímicos adecuados para restaurar, mantener, mejorar o reemplazar diferentes tipos de tejidos biológicos . La ingeniería de tejidos a menudo implica el uso de células colocadas en armazones de tejido en la formación de nuevo tejido viable para fines médicos, pero no se limita a aplicaciones que involucran células y armazones de tejido. Si bien alguna vez estuvo categorizado como un subcampo de los biomateriales , habiendo crecido en alcance e importancia, puede considerarse como un campo en sí mismo. [1]
Si bien la mayoría de las definiciones de ingeniería de tejidos cubren una amplia gama de aplicaciones, en la práctica, el término está estrechamente asociado con aplicaciones que reparan o reemplazan partes o tejidos completos (es decir, órganos , huesos , cartílagos , [2] vasos sanguíneos , vejiga , piel , músculo , etc.). A menudo, los tejidos involucrados requieren ciertas propiedades mecánicas y estructurales para su correcto funcionamiento. El término también se ha aplicado a los esfuerzos por realizar funciones bioquímicas específicas utilizando células dentro de un sistema de soporte creado artificialmente (por ejemplo, un páncreas artificial o un hígado bioartificial ). El término medicina regenerativa se utiliza a menudo como sinónimo de ingeniería de tejidos, aunque quienes se dedican a la medicina regenerativa ponen más énfasis en el uso de células madre o células progenitoras para producir tejidos.

Una definición comúnmente aplicada de ingeniería de tejidos, como lo afirman Langer [3] y Vacanti, [4] es "un campo interdisciplinario que aplica los principios de la ingeniería y las ciencias de la vida hacia el desarrollo de sustitutos biológicos que restablezcan, mantengan o mejoren [los sistemas biológicos]. tejido] función o un órgano completo". [5] Además, Langer y Vacanti también afirman que existen tres tipos principales de ingeniería de tejidos: células, sustancias inductoras de tejido y un enfoque de células + matriz (a menudo denominado andamio). La ingeniería de tejidos también se ha definido como "comprender los principios del crecimiento de tejidos y aplicarlos para producir tejido de reemplazo funcional para uso clínico". [6] Una descripción adicional continúa diciendo que una "suposición subyacente de la ingeniería de tejidos es que el empleo de la biología natural del sistema permitirá un mayor éxito en el desarrollo de estrategias terapéuticas dirigidas al reemplazo, reparación, mantenimiento o mejora del tejido". función". [6]
Los avances en el campo multidisciplinario de la ingeniería de tejidos han generado un nuevo conjunto de piezas de reemplazo de tejidos y estrategias de implementación. Los avances científicos en biomateriales , células madre, factores de crecimiento y diferenciación y entornos biomiméticos han creado oportunidades únicas para fabricar o mejorar tejidos existentes en el laboratorio a partir de combinaciones de matrices extracelulares diseñadas ("andamios"), células y moléculas biológicamente activas. Entre los principales desafíos que enfrenta ahora la ingeniería de tejidos se encuentra la necesidad de una funcionalidad, estabilidad biomecánica y vascularización más complejas en tejidos cultivados en laboratorio destinados a trasplantes. [7]
El origen histórico del término no está claro ya que la definición de la palabra ha cambiado a lo largo de las últimas décadas. El término apareció por primera vez en una publicación de 1984 que describía la organización de una membrana similar a un endotelio en la superficie de una prótesis oftálmica sintética implantada durante mucho tiempo . [8]
El primer uso moderno del término tal como se reconoce hoy en día fue en 1985 por el investigador, fisiólogo y bioingeniero Yuan-Cheng Fung del Centro de Investigación de Ingeniería. Propuso la unión de los términos tejido (en referencia a la relación fundamental entre células y órganos) e ingeniería (en referencia al campo de modificación de dichos tejidos). El término fue adoptado oficialmente en 1987. [8]
Una comprensión rudimentaria del funcionamiento interno de los tejidos humanos puede remontarse a más tiempo de lo que la mayoría esperaría. Ya en el Neolítico, las suturas se utilizaban para cerrar heridas y ayudar en la curación. Posteriormente, sociedades como la del antiguo Egipto desarrollaron mejores materiales para coser heridas, como las suturas de lino. Alrededor del 2500 a. C. en la antigua India, los injertos de piel se desarrollaron cortando piel de las nalgas y suturándola en los lugares de las heridas en la oreja, la nariz o los labios. Los antiguos egipcios a menudo injertaban piel de cadáveres en humanos vivos e incluso intentaban utilizar miel como tipo de antibiótico y grasa como barrera protectora para prevenir infecciones. En los siglos I y II d.C., los galorromanos desarrollaron implantes de hierro forjado y se podían encontrar implantes dentales en los antiguos mayas.
Si bien estas sociedades antiguas habían desarrollado técnicas muy adelantadas a su tiempo, todavía carecían de una comprensión mecanicista de cómo reaccionaba el cuerpo a estos procedimientos. Este enfoque mecanicista llegó junto con el desarrollo del método empírico de la ciencia iniciado por René Descartes. Sir Isaac Newton comenzó a describir el cuerpo como una "máquina fisicoquímica" y planteó que la enfermedad era una falla en la máquina.
En el siglo XVII, Robert Hooke descubrió la célula y una carta de Benedicto de Spinoza planteó la idea de la homeostasis entre los procesos dinámicos del cuerpo. Los experimentos con la hidra realizados por Abraham Trembley en el siglo XVIII comenzaron a profundizar en las capacidades regenerativas de las células. Durante el siglo XIX, una mejor comprensión de cómo reaccionaban los diferentes metales con el cuerpo condujo al desarrollo de mejores suturas y a un cambio hacia los implantes de tornillos y placas en la fijación ósea. Además, a mediados del siglo XIX se planteó por primera vez la hipótesis de que las interacciones entre las células y el entorno y la proliferación celular eran vitales para la regeneración de los tejidos.
A medida que pasa el tiempo y avanza la tecnología, existe una necesidad constante de cambiar el enfoque que adoptan los investigadores en sus estudios. La ingeniería de tejidos ha seguido evolucionando a lo largo de los siglos. Al principio la gente solía observar y utilizar muestras directamente de cadáveres humanos o animales. Ahora, los ingenieros de tejidos tienen la capacidad de rehacer muchos de los tejidos del cuerpo mediante el uso de técnicas modernas como la microfabricación y la bioimpresión tridimensional junto con células de tejido nativo/células madre. Estos avances han permitido a los investigadores generar nuevos tejidos de una manera mucho más eficiente. Por ejemplo, estas técnicas permiten una mayor personalización, lo que permite una mejor biocompatibilidad, una menor respuesta inmune, integración celular y longevidad. No hay duda de que estas técnicas seguirán evolucionando, como hemos seguido viendo evolucionar la microfabricación y la bioimpresión durante la última década.
En 1960, Wichterle y Lim fueron los primeros en publicar experimentos con hidrogeles para aplicaciones biomédicas utilizándolos en la construcción de lentes de contacto. El trabajo en este campo se desarrolló lentamente durante las siguientes dos décadas, pero luego encontró fuerza cuando los hidrogeles fueron reutilizados para la administración de fármacos. En 1984, Charles Hull desarrolló la bioimpresión convirtiendo una impresora de inyección de tinta Hewlett-Packard en un dispositivo capaz de depositar células en 2-D. La impresión tridimensional (3-D) es un tipo de fabricación aditiva que desde entonces ha encontrado diversas aplicaciones en la ingeniería médica, debido a su alta precisión y eficiencia. Con el desarrollo por parte del biólogo James Thompson de las primeras líneas de células madre humanas en 1998, seguido del trasplante de los primeros órganos internos cultivados en laboratorio en 1999 y la creación de la primera bioimpresora en 2003 por parte de la Universidad de Missouri cuando imprimieron esferoides sin necesidad de andamios, 3- La bioimpresión D se utilizó más convencionalmente que nunca en el campo médico. Hasta ahora, los científicos han podido imprimir mini organoides y órganos en chips que han aportado conocimientos prácticos sobre las funciones del cuerpo humano. Las compañías farmacéuticas están utilizando estos modelos para probar medicamentos antes de pasar a estudios con animales. Sin embargo, todavía no se ha impreso un órgano completamente funcional y estructuralmente similar. Según se informa, un equipo de la Universidad de Utah imprimió orejas y las trasplantó con éxito a niños que nacieron con defectos que dejaron sus orejas parcialmente desarrolladas.
Hoy en día, los hidrogeles se consideran la opción preferida de biotintas para la bioimpresión tridimensional, ya que imitan la ECM natural de las células y al mismo tiempo contienen fuertes propiedades mecánicas capaces de sostener estructuras tridimensionales. Además, los hidrogeles junto con la bioimpresión tridimensional permiten a los investigadores producir diferentes estructuras que pueden usarse para formar nuevos tejidos u órganos. Los tejidos impresos en 3D todavía enfrentan muchos desafíos, como agregar vasculatura. Mientras tanto, la impresión 3D de partes de tejidos definitivamente mejorará nuestra comprensión del cuerpo humano, acelerando así la investigación tanto básica como clínica.
.jpg/440px-Earproject_-_2x3_(6127848729).jpg)
Según lo definido por Langer y Vacanti, [5] los ejemplos de ingeniería de tejidos se clasifican en una o más de tres categorías: "sólo células", "células y andamiaje" o "factores inductores de tejido".
Las células son uno de los componentes principales para el éxito de los enfoques de ingeniería de tejidos. La ingeniería de tejidos utiliza células como estrategias para la creación/reemplazo de tejido nuevo. Los ejemplos incluyen fibroblastos utilizados para la reparación o renovación de la piel, [23] condrocitos utilizados para la reparación del cartílago (producto aprobado por MACI-FDA) y hepatocitos utilizados en los sistemas de soporte del hígado.
Las células se pueden utilizar solas o con matrices de soporte para aplicaciones de ingeniería de tejidos. Un entorno adecuado para promover el crecimiento, la diferenciación y la integración celular con el tejido existente es un factor crítico para los componentes básicos basados en células. [24] La manipulación de cualquiera de estos procesos celulares crea vías alternativas para el desarrollo de tejido nuevo (por ejemplo, reprogramación celular: células somáticas, vascularización).
Las técnicas para el aislamiento celular dependen de la fuente celular. La centrifugación y la aféresis son técnicas utilizadas para extraer células de biofluidos (p. ej., sangre). Mientras que los procesos de digestión, que normalmente utilizan enzimas para eliminar la matriz extracelular (MEC), se requieren antes de las técnicas de centrifugación o aféresis para extraer células de tejidos/órganos. La tripsina y la colagenasa son las enzimas más comunes utilizadas para la digestión de tejidos. Mientras que la tripsina depende de la temperatura, la colagenasa es menos sensible a los cambios de temperatura.
Las células primarias son aquellas que se aíslan directamente del tejido del huésped. Estas células proporcionan un modelo ex vivo de comportamiento celular sin ningún cambio genético, epigenético o de desarrollo; lo que las convierte en una replicación más cercana de las condiciones in vivo que las células derivadas de otros métodos. [25] Sin embargo, esta limitación también puede dificultar su estudio. Se trata de células maduras, a menudo diferenciadas terminalmente, lo que significa que para muchos tipos de células la proliferación es difícil o imposible. Además, los microambientes en los que existen estas células son altamente especializados, lo que a menudo dificulta la replicación de estas condiciones. [26]
Células secundarias Una porción de células de un cultivo primario se traslada a un nuevo depósito/recipiente para continuar con el cultivo. Se retira el medio del cultivo primario, se obtienen las células que se desea transferir y luego se cultivan en un recipiente nuevo con medio de crecimiento nuevo. [ cita necesaria ] Un cultivo celular secundario es útil para garantizar que las células tengan el espacio y los nutrientes que necesitan para crecer. Los cultivos secundarios se utilizan sobre todo en cualquier escenario en el que se desee una cantidad mayor de células que la que se puede encontrar en el cultivo primario. Las células secundarias comparten las limitaciones de las células primarias (ver arriba), pero tienen un riesgo adicional de contaminación cuando se transfieren a un nuevo recipiente.
Autólogo: El donante y el receptor de las células son el mismo individuo. Las células se recolectan, cultivan o almacenan y luego se reintroducen en el huésped. Como resultado de la reintroducción de las propias células del huésped, no se provoca una respuesta antigénica. El sistema inmunológico del cuerpo reconoce estas células reimplantadas como propias y no las ataca. La dependencia de las células autólogas de la salud de la célula huésped y la morbilidad del sitio donante pueden ser factores disuasorios para su uso. Las células madre mesenquimales derivadas del tejido adiposo y de la médula ósea suelen ser de naturaleza autóloga y pueden usarse de innumerables maneras, desde ayudar a reparar el tejido esquelético hasta reponer las células beta en pacientes diabéticos. [27] [28] [29] [30]
Alógeno: Las células se obtienen del cuerpo de un donante de la misma especie que el receptor. Si bien existen algunas limitaciones éticas para el uso de células humanas para estudios in vitro (es decir, desarrollo de quimeras de tejido cerebral humano [31] ), el empleo de fibroblastos dérmicos del prepucio humano demuestra una opción inmunológicamente segura y, por lo tanto, viable para la ingeniería de tejidos alogénicos de la piel.
Xenógenas: Estas células se derivan de células aisladas de especies alternativas del receptor. Un ejemplo notable de utilización de tejido xenogénico es la construcción de implantes cardiovasculares mediante células animales. La cría quimérica de animales y humanos plantea preocupaciones éticas en torno al potencial de mejorar la conciencia mediante la implantación de órganos humanos en animales. [32]
Singénicas o isogénicas: estas células describen aquellas que nacen de un código genético idéntico. Esto imparte un beneficio inmunológico similar al de las líneas celulares autólogas (ver arriba). [33] Las células autólogas pueden considerarse singénicas, pero la clasificación también se extiende a células derivadas no autólogas, como las de un gemelo idéntico, de modelos de investigación genéticamente idénticos (clonados) o células madre inducidas (iSC) [34] relacionadas al donante.
Las células madre son células indiferenciadas con la capacidad de dividirse en cultivo y dar lugar a diferentes formas de células especializadas. Las células madre se dividen en células madre "adultas" y "embrionarias" según su origen. Si bien todavía existe un gran debate ético relacionado con el uso de células madre embrionarias, se cree que otra fuente alternativa (las células madre pluripotentes inducidas ) puede ser útil para la reparación de tejidos enfermos o dañados, o puede usarse para desarrollar nuevos órganos. .
Las células totipotentes son células madre que pueden dividirse en otras células madre o diferenciarse en cualquier tipo de célula del cuerpo, incluido el tejido extraembrionario.
Las células pluripotentes son células madre que pueden diferenciarse en cualquier tipo de célula del cuerpo excepto en tejido extraembrionario. Las células madre pluripotentes inducidas (iPSC) son una subclase de células madre pluripotentes que se asemejan a las células madre embrionarias (ESC) que se han derivado de células adultas diferenciadas. Las iPSC se crean alterando la expresión de factores transcripcionales en células adultas hasta que se vuelven como células madre embrionarias. [ cita necesaria ]
Las células madre multipotentes se pueden diferenciar en cualquier célula de la misma clase, como la sanguínea o la ósea . Un ejemplo común de células multipotentes son las células madre mesenquimales (MSC).
Los andamios son materiales que han sido diseñados para provocar interacciones celulares deseables para contribuir a la formación de nuevos tejidos funcionales con fines médicos. A menudo se "sembran" células en estas estructuras capaces de soportar la formación de tejido tridimensional . Los andamios imitan la matriz extracelular del tejido nativo, recapitulando el entorno in vivo y permitiendo que las células influyan en sus propios microambientes. Por lo general, sirven al menos para uno de los siguientes propósitos: permitir la unión y migración celular, entregar y retener células y factores bioquímicos, permitir la difusión de nutrientes celulares vitales y productos expresados, y ejercer ciertas influencias mecánicas y biológicas para modificar el comportamiento de la fase celular. .
En 2009, un equipo interdisciplinario dirigido por el cirujano torácico Thorsten Walles implantó con éxito el primer trasplante bioartificial que proporciona una red vascular innata para el suministro de injerto postrasplante en un paciente en espera de reconstrucción traqueal. [35]

Para lograr el objetivo de la reconstrucción de tejidos, los andamios deben cumplir algunos requisitos específicos. Son necesarios una alta porosidad y un tamaño de poro adecuado para facilitar la siembra y difusión celular por toda la estructura tanto de las células como de los nutrientes. La biodegradabilidad es a menudo un factor esencial ya que los soportes deben ser absorbidos preferiblemente por los tejidos circundantes sin necesidad de extracción quirúrgica. La velocidad a la que se produce la degradación tiene que coincidir lo más posible con la velocidad de formación de tejido: esto significa que mientras las células fabrican su propia estructura matricial natural a su alrededor, el andamio es capaz de proporcionar integridad estructural dentro del cuerpo y eventualmente lo hará. descomponerse dejando el tejido recién formado que se hará cargo de la carga mecánica. La inyectabilidad también es importante para usos clínicos. Investigaciones recientes sobre la impresión de órganos están demostrando lo crucial que es un buen control del entorno 3D para garantizar la reproducibilidad de los experimentos y ofrecer mejores resultados.
La selección del material es un aspecto esencial en la producción de un andamio. Los materiales utilizados pueden ser naturales o sintéticos y pueden ser biodegradables o no biodegradables. Además, deben ser biocompatibles, es decir, que no provoquen ningún efecto adverso en las células. [37] La silicona, por ejemplo, es un material sintético no biodegradable comúnmente utilizado como material de administración de medicamentos, [38] [39] mientras que la gelatina es un material natural biodegradable comúnmente utilizado en estructuras de cultivo celular [40] [41 ] [42]
El material necesario para cada aplicación es diferente y depende de las propiedades mecánicas deseadas del material. La ingeniería tisular de defectos de huesos largos, por ejemplo, requerirá un armazón rígido con una resistencia a la compresión similar a la del hueso cortical (100-150 MPa), que es mucho mayor en comparación con un armazón para la regeneración de la piel. [43] [44]
Existen algunos materiales sintéticos versátiles que se utilizan para muchas aplicaciones diferentes de andamios. Uno de estos materiales comúnmente utilizados es el ácido poliláctico (PLA), un polímero sintético. PLA – ácido poliláctico. Se trata de un poliéster que se degrada dentro del cuerpo humano para formar ácido láctico , una sustancia química natural que se elimina fácilmente del cuerpo. Materiales similares son el ácido poliglicólico (PGA) y la policaprolactona (PCL): su mecanismo de degradación es similar al del PLA, pero el PCL se degrada más lentamente y el PGA se degrada más rápido. [ cita necesaria ] El PLA se combina comúnmente con PGA para crear ácido poliláctico-co-glicólico (PLGA). Esto es especialmente útil porque la degradación de PLGA se puede adaptar alterando los porcentajes en peso de PLA y PGA: más PLA – degradación más lenta, más PGA – degradación más rápida. Esta capacidad de sintonización, junto con su biocompatibilidad, lo convierte en un material extremadamente útil para la creación de andamios. [45]
También se pueden construir andamios a partir de materiales naturales: en particular, se han estudiado diferentes derivados de la matriz extracelular para evaluar su capacidad para favorecer el crecimiento celular. Los materiales a base de proteínas, como el colágeno o la fibrina , y los materiales polisacáridos, como el quitosano [46] o los glucosaminoglicanos (GAG), han demostrado ser adecuados en términos de compatibilidad celular. Entre los GAG, el ácido hialurónico , posiblemente en combinación con agentes reticulantes (por ejemplo, glutaraldehído , carbodiimida soluble en agua , etc.), es una de las posibles opciones como material de soporte. Debido a la unión covalente de los grupos tiol a estos polímeros, pueden reticularse mediante la formación de enlaces disulfuro. [47] El uso de polímeros tiolados ( tiomeros ) como material de soporte para la ingeniería de tejidos se introdujo inicialmente en el 4º Simposio Centroeuropeo sobre Tecnología Farmacéutica en Viena en 2001. [48] Como los tiómeros son biocompatibles, exhiben propiedades de imitación celular y apoyan eficientemente la proliferación y diferenciación de varios tipos de células, se utilizan ampliamente como andamios para la ingeniería de tejidos. [49] [50] [51] Además, se demostró que los tiómeros como el ácido hialurónico tiolado [52] y el quitosano tiolado [53] exhiben propiedades de curación de heridas y son objeto de numerosos ensayos clínicos . [54] Además, un fragmento de una proteína de la matriz extracelular, como el péptido RGD , se puede acoplar a un material no bioactivo para promover la unión celular. [55] Otra forma de andamio es el tejido descelularizado. Este es un proceso en el que se utilizan productos químicos para extraer células de los tejidos, dejando solo la matriz extracelular. Esto tiene la ventaja de contar con una matriz completamente formada y específica para el tipo de tejido deseado. Sin embargo, el andamio descelurizado puede presentar problemas inmunológicos con futuras células introducidas.


En la literatura se han descrito varios métodos diferentes para preparar estructuras porosas que se emplearán como armazones de ingeniería de tejidos. Cada una de estas técnicas presenta sus propias ventajas, pero ninguna está exenta de inconvenientes.
El autoensamblaje molecular es uno de los pocos métodos para crear biomateriales con propiedades similares en escala y química a las de la matriz extracelular (MEC) natural in vivo , un paso crucial hacia la ingeniería tisular de tejidos complejos. [56] Además, estos andamios de hidrogel han demostrado superioridad en toxicología y biocompatibilidad in vivo en comparación con los macroandamios tradicionales y los materiales de origen animal.
Estas técnicas incluyen todos los enfoques que se han empleado con éxito para la preparación de mallas no tejidas de diferentes polímeros . En particular, se han probado estructuras de poliglicólidos no tejidos para aplicaciones de ingeniería de tejidos: se ha descubierto que dichas estructuras fibrosas son útiles para cultivar diferentes tipos de células. Los principales inconvenientes están relacionados con las dificultades para obtener una alta porosidad y un tamaño de poro regular.
La fundición con solventes y la lixiviación de partículas (SCPL) permiten la preparación de estructuras con porosidad regular, pero con espesor limitado. Primero, el polímero se disuelve en un disolvente orgánico adecuado (por ejemplo, el ácido poliláctico podría disolverse en diclorometano ), luego la solución se vierte en un molde lleno de partículas porógenas. Dicho porógeno puede ser una sal inorgánica como cloruro de sodio , cristales de sacarosa , esferas de gelatina o esferas de parafina . El tamaño de las partículas de porógeno afectará el tamaño de los poros del andamio, mientras que la proporción de polímero a porógeno está directamente correlacionada con la cantidad de porosidad de la estructura final. Una vez colada la solución polimérica, se deja que el disolvente se evapore completamente, luego se sumerge la estructura compuesta en el molde en un baño de un líquido adecuado para disolver el porógeno: agua en el caso de cloruro de sodio, sacarosa y gelatina o un alifático. Solvente como hexano para uso con parafina. Una vez que el porógeno se ha disuelto completamente, se obtiene una estructura porosa. Aparte del pequeño rango de espesor que se puede obtener, otro inconveniente del SCPL radica en el uso de disolventes orgánicos que deben eliminarse por completo para evitar cualquier posible daño a las células sembradas en el andamio.
Para superar la necesidad de utilizar disolventes orgánicos y porógenos sólidos, se ha desarrollado una técnica que utiliza gas como porógeno. En primer lugar, se preparan estructuras en forma de disco hechas del polímero deseado mediante moldeo por compresión utilizando un molde calentado. Luego, los discos se colocan en una cámara donde se exponen a CO 2 a alta presión durante varios días. La presión dentro de la cámara se restablece gradualmente a los niveles atmosféricos. Durante este procedimiento los poros se forman por las moléculas de dióxido de carbono que abandonan el polímero, dando como resultado una estructura similar a una esponja. Los principales problemas resultantes de dicha técnica son causados por el calor excesivo utilizado durante el moldeo por compresión (que prohíbe la incorporación de cualquier material termolábil en la matriz polimérica) y por el hecho de que los poros no forman una estructura interconectada.
Esta técnica no requiere el uso de un porógeno sólido como SCPL. Primero, se disuelve un polímero sintético en un disolvente adecuado (por ejemplo, ácido poliláctico en diclorometano), luego se añade agua a la solución polimérica y los dos líquidos se mezclan para obtener una emulsión . Antes de que las dos fases puedan separarse, la emulsión se vierte en un molde y se congela rápidamente mediante inmersión en nitrógeno líquido . La emulsión congelada se liofiliza posteriormente para eliminar el agua dispersada y el disolvente, dejando así una estructura polimérica porosa solidificada. Si bien la emulsificación y la liofilización permiten una preparación más rápida en comparación con el SCPL (ya que no requiere un paso de lixiviación que requiere mucho tiempo), aún requiere el uso de solventes. Además, el tamaño de los poros es relativamente pequeño y la porosidad suele ser irregular. La liofilización por sí sola también es una técnica comúnmente empleada para la fabricación de andamios. En particular, se utiliza para preparar esponjas de colágeno: el colágeno se disuelve en soluciones ácidas de ácido acético o ácido clorhídrico que se vierten en un molde, se congelan con nitrógeno líquido y luego se liofilizan .
De manera similar a la técnica anterior, el procedimiento de separación de fases TIPS requiere el uso de un disolvente con un punto de fusión bajo que sea fácil de sublimar. Por ejemplo, se podría utilizar dioxano para disolver ácido poliláctico, luego se induce la separación de fases mediante la adición de una pequeña cantidad de agua: se forman una fase rica en polímeros y una fase pobre en polímeros. Después de enfriar por debajo del punto de fusión del disolvente y algunos días de secado al vacío para sublimar el disolvente, se obtiene un armazón poroso. La separación de fases líquido-líquido presenta los mismos inconvenientes que la emulsificación/liofilización. [57]
El electrohilado es una técnica muy versátil que se puede utilizar para producir fibras continuas con diámetros que van desde unas pocas micras hasta unos pocos nanómetros. En una configuración típica de electrohilado, el material de soporte deseado se disuelve en un disolvente y se coloca dentro de una jeringa. Esta solución se alimenta a través de una aguja y se aplica un alto voltaje a la punta y a una superficie conductora de recolección. La acumulación de fuerzas electrostáticas dentro de la solución hace que ésta expulse una fina corriente fibrosa hacia la superficie colectora con carga opuesta o conectada a tierra. Durante este proceso el solvente se evapora, dejando fibras sólidas dejando una red altamente porosa. Esta técnica es altamente ajustable, con variación del solvente, voltaje, distancia de trabajo (distancia desde la aguja a la superficie de recolección), caudal de solución, concentración de soluto y superficie de recolección. Esto permite un control preciso de la morfología de la fibra.
Sin embargo, a nivel comercial , por motivos de escalabilidad, hay 40 o, a veces, 96 agujas funcionando a la vez. Los cuellos de botella en tales configuraciones son: 1) Mantener las variables antes mencionadas uniformemente para todas las agujas y 2) formación de "perlas" en fibras individuales que nosotros, como ingenieros, queremos que tengan un diámetro uniforme. Al modificar variables como la distancia al colector, la magnitud del voltaje aplicado o el caudal de la solución, los investigadores pueden cambiar drásticamente la arquitectura general del andamio.
Históricamente, la investigación sobre andamios fibrosos electrohilados se remonta al menos a finales de la década de 1980, cuando Simon demostró que el electrohilado podía utilizarse para producir andamios fibrosos a escala nano y submicrónica a partir de soluciones poliméricas destinadas específicamente a su uso como sustratos de células y tejidos in vitro . Este uso temprano de redes electrohiladas para cultivo celular e ingeniería de tejidos demostró que varios tipos de células se adherirían y proliferarían sobre las fibras de policarbonato. Se observó que, a diferencia de la morfología aplanada que normalmente se observa en el cultivo 2D, las células cultivadas en fibras electrohiladas exhibieron una morfología tridimensional más redondeada que generalmente se observa en los tejidos in vivo . [58]
Debido a que la mayoría de las técnicas anteriores son limitadas en lo que respecta al control de la porosidad y el tamaño de los poros, se han introducido técnicas de fabricación y diseño asistido por ordenador en la ingeniería de tejidos. En primer lugar, se diseña una estructura tridimensional utilizando un software CAD. La porosidad se puede adaptar mediante algoritmos dentro del software. [59] El andamio se realiza luego mediante impresión por chorro de tinta de polvos de polímero o mediante modelado por deposición fundida de un polímero fundido. [60]
Un estudio de 2011 de El-Ayoubi et al. investigó la "técnica de trazado 3D para producir estructuras macroporosas de poli-L-lactida ( biocompatibles y biodegradables ) con dos tamaños de poros diferentes" mediante fabricación sólida de forma libre (SSF) con diseño asistido por computadora (CAD), para explorar el cartílago articular terapéutico reemplazo como una "alternativa a la reparación de tejidos convencional". [61] El estudio encontró que cuanto más pequeño es el tamaño de los poros junto con el estrés mecánico en un biorreactor (para inducir condiciones similares a las in vivo), mayor es la viabilidad celular en la funcionalidad terapéutica potencial a través de la disminución del tiempo de recuperación y el aumento de la efectividad del trasplante. [61]
En un estudio de 2012, [62] Koch et al. se centró en si la bioimpresión asistida por láser (LaBP) se puede utilizar para construir patrones 3D multicelulares en una matriz natural y si las construcciones generadas están funcionando y formando tejido. LaBP organiza pequeños volúmenes de suspensiones de células vivas en patrones establecidos de alta resolución. [62] La investigación tuvo éxito y los investigadores prevén que "las construcciones de tejido generadas podrían utilizarse para pruebas in vivo implantándolas en modelos animales " (14). Hasta el momento, sólo se ha sintetizado tejido de piel humana, aunque los investigadores proyectan que "al integrar otros tipos de células (por ejemplo, melanocitos , células de Schwann , células del folículo piloso) en la construcción de células impresas, el comportamiento de estas células en un experimento 3D in vitro Se puede analizar un microambiente similar al natural", lo que resulta útil para el descubrimiento de fármacos y estudios de toxicología . [62]
Gustafsson et al. [63] demostraron membranas bioactivas independientes de un área del tamaño de cm, pero de solo 250 nm de espesor, que se formaron mediante autoensamblaje de seda de araña en la interfaz de una solución acuosa. Las membranas combinan de forma única espesor a nanoescala, biodegradabilidad, tensión y resistencia ultraaltas, permeabilidad a las proteínas y promueven una rápida adherencia y proliferación celular. Demostraron el crecimiento de una capa coherente de queratinocitos. Estas nanomembranas de seda de araña también se han utilizado para crear un modelo estático in vitro de un vaso sanguíneo. [64]
La regeneración tisular in situ se define como la implantación de biomateriales (solos o en combinación con células y/o biomoléculas) en el defecto tisular, utilizando el microambiente circundante del organismo como biorreactor natural. [65] Este enfoque ha encontrado aplicación en la regeneración ósea, [66] permitiendo la formación de construcciones con semillas celulares directamente en el quirófano. [67]
Un problema persistente dentro de la ingeniería de tejidos son las limitaciones del transporte masivo. Los tejidos diseñados generalmente carecen de un suministro de sangre inicial, lo que dificulta que las células implantadas obtengan suficiente oxígeno y nutrientes para sobrevivir o funcionar correctamente.
Se ha demostrado que los métodos de autoensamblaje son métodos prometedores para la ingeniería de tejidos. Los métodos de autoensamblaje tienen la ventaja de permitir que los tejidos desarrollen su propia matriz extracelular, lo que da como resultado un tejido que recapitula mejor las propiedades bioquímicas y biomecánicas del tejido nativo. Jerry Hu y Kyriacos A. Athanasiou introdujeron el cartílago articular autoensamblado en 2006 [68] y las aplicaciones del proceso han dado como resultado un cartílago diseñado que se aproxima a la resistencia del tejido nativo. [69] El autoensamblaje es una tecnología principal para lograr que las células cultivadas en un laboratorio se ensamblen en formas tridimensionales. Para descomponer los tejidos en células, los investigadores primero tienen que disolver la matriz extracelular que normalmente los une. Una vez que las células se aíslan, deben formar las estructuras complejas que forman nuestros tejidos naturales.
La superficie aire-líquido establecida por las ondas de Faraday se explora como plantilla para ensamblar entidades biológicas para la ingeniería de tejidos ascendente. Esta plantilla de base líquida se puede reconfigurar dinámicamente en unos segundos y el ensamblaje en la plantilla se puede lograr de manera escalable y paralela. Se demostró que el ensamblaje de hidrogeles a microescala, células, microperlas portadoras sembradas de neuronas y esferoides celulares en diversas estructuras simétricas y periódicas tiene una buena viabilidad celular. La formación de una red neuronal tridimensional se logró después de un cultivo de tejido de 14 días. [70]
Podría ser posible imprimir órganos, o posiblemente organismos enteros, utilizando técnicas de fabricación aditiva . Un método de construcción innovador reciente utiliza un mecanismo de chorro de tinta para imprimir capas precisas de células en una matriz de gel termorreversible. Las células endoteliales, las células que recubren los vasos sanguíneos, se han impreso en un conjunto de anillos apilados. Cuando se incubaron, estos se fusionaron formando un tubo. [60] [71] Esta técnica se ha denominado "bioimpresión" dentro del campo, ya que implica la impresión de componentes biológicos en una estructura que se asemeja al órgano de enfoque.
El campo de los modelos tridimensionales y de alta precisión de sistemas biológicos es pionero en múltiples proyectos y tecnologías, incluido un método rápido para crear tejidos e incluso órganos completos que implica una impresora 3D que puede bioimprimir el andamiaje y las células capa por capa en una muestra de tejido u órgano funcional. El dispositivo es presentado en una charla TED por el Dr. Anthony Atala, MD, director del Instituto Wake Forest de Medicina Regenerativa , y el profesor WH Boyce y presidente del Departamento de Urología de la Universidad Wake Forest, en la que se imprime un riñón. escenario durante el seminario y luego presentado a la multitud. [72] [73] [74] Se prevé que esta tecnología permitirá la producción de hígados en el futuro para trasplantes y, en teoría, también para toxicología y otros estudios biológicos.
En 2015, se empleó el procesamiento de fotones múltiples (MPP) para experimentos in vivo mediante la ingeniería de construcciones de cartílago artificial. Un examen histológico ex vivo mostró que cierta geometría de los poros y el precrecimiento de condrocitos (Cho) antes de la implantación mejoran significativamente el rendimiento de los andamios tridimensionales creados. La biocompatibilidad alcanzada fue comparable a la de las membranas de colágeno disponibles comercialmente. El resultado exitoso de este estudio respalda la idea de que los andamios microestructurados orgánicos-inorgánicos híbridos con forma de poro hexagonal en combinación con la siembra de Cho pueden implementarse con éxito para la ingeniería de tejido de cartílago. [75]
Recientemente, la ingeniería de tejidos ha avanzado centrándose en la vascularización. Utilizando la fabricación aditiva basada en la polimerización de dos fotones, se crean redes sintéticas de microvasos 3D a partir de estructuras tubulares de hidrogel. Estas redes pueden perfundir tejidos de varios milímetros cúbicos de tamaño, lo que permite la viabilidad a largo plazo y el crecimiento celular in vitro. Esta innovación marca un importante paso adelante en la ingeniería de tejidos, ya que facilita el desarrollo de modelos complejos de tejido humano. [76]
En 2013, utilizando un andamio tridimensional de Matrigel en varias configuraciones, se produjeron in vitro importantes organoides pancreáticos. Grupos de pequeñas cantidades de células proliferaron hasta formar 40.000 células en una semana. Los grupos se transforman en células que producen enzimas digestivas u hormonas como la insulina , y se autoorganizan en organoides pancreáticos ramificados que se asemejan al páncreas. [77]
Las células son sensibles al medio ambiente, como la rigidez del gel y el contacto con otras células. Las células individuales no prosperan; Se requirió un mínimo de cuatro células próximas para el desarrollo organoide posterior. Las modificaciones a la composición del medio produjeron esferas huecas compuestas principalmente de progenitores pancreáticos u organoides complejos que experimentan espontáneamente morfogénesis y diferenciación pancreática. El mantenimiento y la expansión de los progenitores pancreáticos requieren señalización activa de Notch y FGF , recapitulando las interacciones de señalización de nicho in vivo. [77]
Se consideró que los organoides ofrecían potencialmente miniórganos para pruebas de drogas y células de repuesto productoras de insulina. [77]
Además de los andamios Matrigel 3-D, se han desarrollado otros sistemas de gel de colágeno. Se han utilizado estructuras de colágeno/ácido hialurónico para modelar la glándula mamaria in vitro mientras se cocultivan células epiteliales y adipocitos. El kit HyStem es otra plataforma tridimensional que contiene componentes de ECM y ácido hialurónico que se ha utilizado para la investigación del cáncer. Además, los componentes del hidrogel se pueden modificar químicamente para ayudar a la reticulación y mejorar sus propiedades mecánicas.
En muchos casos, la creación de tejidos funcionales y estructuras biológicas in vitro requiere un cultivo extenso para promover la supervivencia, el crecimiento y la inducción de la funcionalidad. En general, en cultivo se deben mantener los requerimientos básicos de las células, que incluyen oxígeno , pH , humedad , temperatura , nutrientes y mantenimiento de la presión osmótica .
Los cultivos modificados con tejidos también presentan problemas adicionales a la hora de mantener las condiciones de cultivo. En el cultivo celular estándar, la difusión suele ser el único medio de transporte de nutrientes y metabolitos. Sin embargo, a medida que un cultivo se vuelve más grande y complejo, como es el caso de los órganos modificados y los tejidos completos, se deben emplear otros mecanismos para mantener el cultivo, como la creación de redes capilares dentro del tejido.

Otro problema con el cultivo de tejidos es la introducción de los factores o estímulos adecuados necesarios para inducir la funcionalidad. En muchos casos, una simple cultura de mantenimiento no es suficiente. En ocasiones se requieren factores de crecimiento , hormonas , metabolitos o nutrientes específicos, estímulos químicos y físicos. Por ejemplo, ciertas células responden a cambios en la tensión de oxígeno como parte de su desarrollo normal, como los condrocitos , que deben adaptarse a condiciones de escasez de oxígeno o hipoxia durante el desarrollo esquelético. Otras, como las células endoteliales, responden al esfuerzo cortante del flujo de líquido, que se encuentra en los vasos sanguíneos . Los estímulos mecánicos, como los pulsos de presión, parecen ser beneficiosos para todo tipo de tejido cardiovascular, como las válvulas cardíacas, los vasos sanguíneos o el pericardio.
En ingeniería de tejidos, un biorreactor es un dispositivo que intenta simular un entorno fisiológico para promover el crecimiento de células o tejidos in vitro. Un entorno fisiológico puede consistir en muchos parámetros diferentes, como temperatura, presión, concentración de oxígeno o dióxido de carbono, u osmolalidad del entorno fluido, y puede extenderse a todo tipo de estímulos biológicos, químicos o mecánicos. Por tanto, existen sistemas que pueden incluir la aplicación de fuerzas tales como fuerzas electromagnéticas, presiones mecánicas o presiones de fluidos al tejido. Estos sistemas pueden ser configuraciones bidimensionales o tridimensionales. Los biorreactores se pueden utilizar tanto en aplicaciones académicas como industriales. También se encuentran disponibles comercialmente biorreactores de uso general y para aplicaciones específicas, que pueden proporcionar estimulación química estática o una combinación de estimulación química y mecánica.
La proliferación y diferenciación celular están influenciadas en gran medida por señales mecánicas [78] y bioquímicas [79] en el entorno de la matriz extracelular circundante . Los biorreactores normalmente se desarrollan para replicar el entorno fisiológico específico del tejido que se está cultivando (por ejemplo, flexión y corte de fluido para el crecimiento del tejido cardíaco). [80] Esto puede permitir que líneas celulares especializadas prosperen en cultivos que replican sus entornos nativos, pero también convierte a los biorreactores en herramientas atractivas para el cultivo de células madre . Un biorreactor exitoso basado en células madre es eficaz para expandir las células madre con propiedades uniformes y/o promover una diferenciación controlada y reproducible en tipos de células maduras seleccionadas. [81]
Existe una variedad de biorreactores diseñados para cultivos celulares en 3D. Hay pequeñas cámaras cilíndricas de plástico, así como cámaras de vidrio, con humedad interna regulada y humedad diseñada específicamente para hacer crecer células en tres dimensiones. [82] El biorreactor utiliza materiales sintéticos bioactivos , como membranas de tereftalato de polietileno, para rodear las células esferoides en un entorno que mantiene altos niveles de nutrientes. [83] [84] Son fáciles de abrir y cerrar, de modo que los esferoides celulares se pueden retirar para realizar pruebas, pero la cámara puede mantener un 100 % de humedad en todo momento. [85] Esta humedad es importante para lograr el máximo crecimiento y función celular. La cámara del biorreactor es parte de un dispositivo más grande que gira para garantizar un crecimiento celular igual en cada dirección en tres dimensiones. [85]
QuinXell Technologies, ahora bajo Quintech Life Sciences de Singapur , ha desarrollado un biorreactor conocido como biorreactor biaxial TisXell que está especialmente diseñado para fines de ingeniería de tejidos. Se trata del primer biorreactor del mundo que cuenta con una cámara esférica de vidrio con rotación biaxial ; específicamente para imitar la rotación del feto en el útero; lo que proporciona un entorno propicio para el crecimiento de los tejidos. [86]
También se han combinado múltiples formas de estimulación mecánica en un solo biorreactor. Utilizando análisis de expresión genética, un estudio académico encontró que la aplicación de una combinación de tensión cíclica y estimulación ultrasónica a células preosteoblásticas en un biorreactor aceleraba la maduración y diferenciación de la matriz. [87] La tecnología de este biorreactor de estimulación combinada podría usarse para cultivar células óseas de manera más rápida y efectiva en futuras terapias clínicas con células madre. [88]
MC2 Biotek también ha desarrollado un biorreactor conocido como ProtoTissue [82] que utiliza el intercambio de gases para mantener altos niveles de oxígeno dentro de la cámara celular; mejorando los biorreactores anteriores, ya que los niveles más altos de oxígeno ayudan a que la célula crezca y experimente una respiración celular normal . [89]
Las áreas activas de investigación sobre biorreactores incluyen aumentar la escala de producción y refinar el entorno fisiológico, lo que podría mejorar la eficiencia y eficacia de los biorreactores en investigación o uso clínico. Los biorreactores se utilizan actualmente para estudiar, entre otras cosas, terapias a nivel de células y tejidos, la respuesta de células y tejidos a cambios ambientales fisiológicos específicos y el desarrollo de enfermedades y lesiones.
En 2013, un grupo de la Universidad de Tokio desarrolló fibras cargadas de células de hasta un metro de longitud y del orden de 100 µm de tamaño. [90] Estas fibras se crearon utilizando un dispositivo de microfluidos que forma un flujo laminar coaxial doble. Cada 'capa' del dispositivo de microfluidos (células sembradas en ECM , una vaina de hidrogel y finalmente una solución de cloruro de calcio). Las células sembradas se cultivan dentro de la vaina de hidrogel durante varios días y luego se retira la vaina con fibras celulares viables. Se insertaron varios tipos de células en el núcleo de la MEC, incluidos miocitos , células endoteliales , fibras de células nerviosas y fibras de células epiteliales . Luego, este grupo demostró que estas fibras se pueden tejer juntas para fabricar tejidos u órganos en un mecanismo similar al tejido textil . Las morfologías fibrosas son ventajosas porque proporcionan una alternativa al diseño tradicional de andamios y muchos órganos (como los músculos) están compuestos de células fibrosas.
Un órgano artificial es un dispositivo diseñado que puede ser extracorpóreo o implantarse para soportar sistemas de órganos deteriorados o defectuosos. [91] Los órganos bioartificiales generalmente se crean con la intención de restaurar funciones biológicas críticas, como en el reemplazo de corazones y pulmones enfermos, o proporcionar mejoras drásticas en la calidad de vida, como en el uso de piel diseñada en víctimas de quemaduras. [91] Si bien algunos ejemplos de órganos bioartificiales aún se encuentran en la etapa de investigación de desarrollo debido a las limitaciones involucradas en la creación de órganos funcionales, otros se están utilizando actualmente en entornos clínicos de manera experimental y comercial. [92]
Las máquinas de oxigenación por membrana extracorpórea (ECMO), también conocidas como máquinas cardíacas y pulmonares, son una adaptación de las técnicas de derivación cardiopulmonar que brindan apoyo al corazón y los pulmones. [93] Se utiliza principalmente para apoyar los pulmones durante un período prolongado pero aún temporal (1 a 30 días) y permitir la recuperación de enfermedades reversibles. [93] Robert Bartlett es conocido como el padre de la ECMO y realizó el primer tratamiento de un recién nacido utilizando una máquina ECMO en 1975. [94]
Piel
La piel obtenida mediante ingeniería tisular es un tipo de órgano bioartificial que a menudo se utiliza para tratar quemaduras, úlceras del pie diabético u otras heridas grandes que no pueden curarse bien por sí solas. La piel artificial se puede fabricar a partir de autoinjertos, aloinjertos y xenoinjertos. La piel autoinjertada proviene de la propia piel del paciente, lo que permite que la dermis tenga una tasa de curación más rápida y el sitio donante se puede volver a extraer varias veces. La piel del aloinjerto a menudo proviene de piel de cadáver y se usa principalmente para tratar a víctimas de quemaduras. Por último, la piel xenoinjertada proviene de animales y proporciona una estructura curativa temporal para la piel. Ayudan a la regeneración dérmica, pero no pueden formar parte de la piel del huésped. [23] La piel obtenida mediante ingeniería tisular ahora está disponible en productos comerciales. Integra, originalmente utilizado sólo para tratar quemaduras, consiste en una matriz de colágeno y sulfato de condroitina que puede usarse como reemplazo de la piel. El sulfato de condroitina funciona como componente de los proteoglicanos, lo que ayuda a formar la matriz extracelular. [95] Integra puede repoblarse y revascularizarse manteniendo su arquitectura de colágeno dérmico, lo que lo convierte en un órgano bioartificial. [96] Dermagraft, otro producto cutáneo de ingeniería tisular fabricado comercialmente, está hecho de fibroblastos vivos. Estos fibroblastos proliferan y producen factores de crecimiento, colágeno y proteínas de la MEC, que ayudan a formar tejido de granulación. [97]
Dado que el número de pacientes en espera de un trasplante de corazón aumenta continuamente con el tiempo y el número de pacientes en lista de espera supera la disponibilidad de órganos, [98] los órganos artificiales utilizados como terapia de reemplazo para la insuficiencia cardíaca terminal ayudarían a aliviar esta dificultad. Los corazones artificiales se utilizan normalmente para puentear el trasplante de corazón o pueden aplicarse como terapia de reemplazo en caso de disfunción cardíaca terminal. [99] El corazón artificial total (TAH), introducido por primera vez por el Dr. Vladimir P. Demikhov en 1937, [100] surgió como una alternativa ideal. Desde entonces, se ha desarrollado y mejorado como una bomba mecánica que proporciona soporte circulatorio a largo plazo y reemplaza los ventrículos cardíacos enfermos o dañados que no pueden bombear la sangre adecuadamente, restaurando así el flujo pulmonar y sistémico. [101] Algunos de los TAH actuales incluyen AbioCor, un dispositivo aprobado por la FDA que comprende dos ventrículos artificiales y sus válvulas, no requiere conexiones subcutáneas y está indicado para pacientes con insuficiencia cardíaca biventricular. En 2010, SynCardia lanzó el controlador de libertad portátil que permite a los pacientes tener un dispositivo portátil sin estar confinados en el hospital. [102]
Si bien los trasplantes de riñón son posibles, la insuficiencia renal se trata con mayor frecuencia mediante un riñón artificial. [103] Los primeros riñones artificiales y la mayoría de los que se utilizan actualmente son extracorpóreos, como en la hemodiálisis, que filtra la sangre directamente, o en la diálisis peritoneal, que se filtra a través de un líquido en el abdomen. [103] [104] Para contribuir a las funciones biológicas de un riñón, como la producción de factores metabólicos u hormonas, algunos riñones artificiales incorporan células renales. [103] [104] Ha habido avances en la forma de hacer que estos dispositivos sean más pequeños y más transportables, o incluso implantables. Un desafío que aún hay que afrontar en estos dispositivos más pequeños es contrarrestar el volumen limitado y, por tanto, las capacidades de filtrado limitadas. [103]
También se han introducido bioandamios para proporcionar un marco sobre el cual se pueda regenerar el tejido renal normal. Estos andamios abarcan andamios naturales (p. ej., riñones descelularizados, [105] hidrogel de colágeno, [106] [107] o fibroína de seda [108] ), andamios sintéticos (p. ej., ácido poli[láctico-co-glicólico] [109] [110 ] u otros polímeros), o una combinación de dos o más andamios naturales y sintéticos. Estos andamios se pueden implantar en el cuerpo sin tratamiento celular o después de un período de siembra e incubación de células madre. Se están realizando estudios in vitro e in vivo para comparar y optimizar el tipo de estructura y evaluar si la siembra de células antes de la implantación contribuye a la viabilidad, la regeneración y la función eficaz de los riñones. Una revisión sistemática y un metanálisis recientes compararon los resultados de estudios en animales publicados e identificaron que se obtienen mejores resultados con el uso de andamios híbridos (mixtos) y siembra de células; [111] sin embargo, el metanálisis de estos resultados no estuvo de acuerdo con la evaluación de los resultados descriptivos de la revisión. Por lo tanto, es aconsejable realizar más estudios con animales más grandes y estructuras novedosas, así como una reproducción más transparente de estudios anteriores.
La biomimética es un campo que tiene como objetivo producir materiales y sistemas que repliquen los presentes en la naturaleza. [112] En el contexto de la ingeniería de tejidos, este es un enfoque común utilizado por los ingenieros para crear materiales para estas aplicaciones que sean comparables a los tejidos nativos en términos de su estructura, propiedades y biocompatibilidad. Las propiedades de los materiales dependen en gran medida de las características físicas, estructurales y químicas de ese material. Posteriormente, un enfoque biomimético para el diseño de sistemas será importante en la integración de materiales, y será necesaria una comprensión suficiente de los procesos e interacciones biológicos. La replicación de sistemas y procesos biológicos también se puede utilizar en la síntesis de materiales bioinspirados para lograr condiciones que produzcan el material biológico deseado. Por lo tanto, si se sintetiza un material que tiene las mismas características de los tejidos biológicos tanto estructural como químicamente, lo ideal es que el material sintetizado tenga propiedades similares. Esta técnica tiene una extensa historia que se origina a partir de la idea de utilizar fenómenos naturales como inspiración de diseño para soluciones a problemas humanos. Muchos avances modernos en tecnología se han inspirado en la naturaleza y los sistemas naturales, incluidos aviones, automóviles, arquitectura e incluso sistemas industriales. Los avances en nanotecnología iniciaron la aplicación de esta técnica a problemas de micro y nanoescala , incluida la ingeniería de tejidos. Esta técnica se ha utilizado para desarrollar tejidos óseos sintéticos, tecnologías vasculares, materiales de andamiaje y técnicas de integración, y nanopartículas funcionalizadas. [112]
En 2018, científicos de la Universidad Brandeis informaron sobre su investigación sobre material blando incrustado con redes químicas que pueden imitar el comportamiento suave y coordinado del tejido neuronal. Esta investigación fue financiada por el Laboratorio de Investigación del Ejército de EE. UU . [113] Los investigadores presentaron un sistema experimental de redes neuronales, teóricamente modelados como sistemas de reacción-difusión . Dentro de las redes había una serie de reactores modelados, cada uno de los cuales realizaba la reacción Belousov-Zhabotinsky (BZ). Estos reactores podrían funcionar a escala de nanolitros. [114]
Los investigadores afirman que la inspiración de su proyecto fue el movimiento de la anguila cinta azul . Los movimientos de la anguila están controlados por impulsos eléctricos determinados por una clase de redes neuronales llamadas generador de patrones centrales . Los generadores de patrones centrales funcionan dentro del sistema nervioso autónomo para controlar funciones corporales como la respiración, el movimiento y la peristalsis . [115]
Las cualidades del reactor que se diseñaron fueron la topología de la red, las condiciones de contorno , las condiciones iniciales, el volumen del reactor, la fuerza de acoplamiento y la polaridad sináptica del reactor (si su comportamiento es inhibidor o excitador). [115] Se diseñó un sistema de emulsión BZ con un elastómero sólido polidimetilsiloxano (PDMS). Se ha informado que tanto el PDMS permeable a la luz como al bromo son métodos viables para crear un marcapasos para redes neuronales. [114]
La historia del mercado de la ingeniería de tejidos se puede dividir en tres partes principales. La época anterior al colapso del mercado de la biotecnología a principios de la década de 2000, el colapso y el tiempo posterior.
La mayor parte de los primeros avances en la investigación de ingeniería de tejidos se realizaron en Estados Unidos. Esto se debe a regulaciones menos estrictas con respecto a la investigación con células madre y a una mayor financiación disponible que en otros países. Esto lleva a la creación de startups académicas, muchas de ellas procedentes de Harvard o el MIT . Algunos ejemplos son BioHybrid Technologies, cuyo fundador, Bill Chick, fue a la Facultad de Medicina de Harvard y se centró en la creación de páncreas artificial. Otro ejemplo sería Organogenesis Inc., cuyo fundador fue al MIT y trabajó en productos de ingeniería de la piel. Otras empresas vinculadas al MIT son TEI Biosciences, Therics y Guilford Pharmaceuticals. [8] El renovado interés en las biotecnologías en la década de 1980 llevó a que muchos inversores privados invirtieran en estas nuevas tecnologías a pesar de que los modelos de negocio de estas primeras empresas a menudo no eran muy claros y no presentaban un camino hacia la rentabilidad a largo plazo. [116] Los patrocinadores gubernamentales fueron más restringidos en su financiación ya que la ingeniería de tejidos se consideraba una inversión de alto riesgo. [8]
En el Reino Unido, el mercado tuvo un comienzo más lento a pesar de que las regulaciones sobre la investigación con células madre tampoco eran estrictas. Esto se debe principalmente a que cada vez más inversores están menos dispuestos a invertir en estas nuevas tecnologías que se consideraban inversiones de alto riesgo. [116] Otro problema al que se enfrentaron las empresas británicas fue conseguir que el NHS pagara por sus productos. Esto especialmente porque el NHS realiza un análisis de rentabilidad de todos los productos admitidos. Las nuevas tecnologías a menudo no funcionan bien en este sentido. [116]
En Japón, la situación regulatoria era bastante diferente. El primer cultivo de células sólo se permitía en un entorno hospitalario y el segundo, a los científicos académicos empleados por universidades estatales no se les permitía trabajar fuera del país hasta 1998. Además, las autoridades japonesas tardaron más en aprobar nuevos medicamentos y tratamientos que sus homólogos estadounidenses y europeos. [116]
Por estas razones, en los primeros días del mercado japonés, la atención se centraba principalmente en conseguir productos que ya estuvieran aprobados en otros lugares de Japón y venderlos. A diferencia del mercado estadounidense, los primeros actores en Japón fueron principalmente grandes empresas o subempresas de empresas tan grandes, como J-TEC, Menicon y Terumo, y no pequeñas empresas emergentes. [116] Después de los cambios regulatorios en 2014, que permitieron el cultivo de células fuera de un entorno hospitalario, la velocidad de la investigación en Japón aumentó y las empresas japonesas también comenzaron a desarrollar sus propios productos. [116]
Poco después del gran boom, empezaron a aparecer los primeros problemas. Hubo problemas para lograr que la FDA aprobara los productos y, si los aprobaban, a menudo había dificultades para lograr que los proveedores de seguros pagaran los productos y lograr que los proveedores de atención médica los aceptaran. [116] [117]
Por ejemplo, la organogénesis tuvo problemas para comercializar su producto e integrarlo en el sistema de salud. Esto se debe en parte a las dificultades de manipular células vivas y a las mayores dificultades que enfrentan los médicos al utilizar estos productos en comparación con los métodos convencionales. [116]
Otro ejemplo sería el producto para la piel Dermagraft de Advanced Tissue Sciences, que no podría crear una demanda lo suficientemente alta sin reembolsos de los proveedores de seguros. Las razones de esto fueron el precio de $4000 y la circunstancia de que adicionalmente Advanced Tissue Sciences tuvo dificultades para que los médicos conocieran su producto. [116]
Los ejemplos anteriores demuestran cómo las empresas lucharon por obtener ganancias. Esto, a su vez, lleva a los inversores a perder la paciencia y a suspender la financiación adicional. En consecuencia, varias empresas de ingeniería de tejidos, como Organogenesis y Advanced Tissue Sciences, se declararon en quiebra a principios de la década de 2000. En ese momento, estos eran los únicos que tenían productos comerciales para la piel en el mercado. [117]
Las tecnologías de las empresas en quiebra o en dificultades fueron compradas a menudo por otras empresas que continuaron su desarrollo bajo modelos de negocio más conservadores. [117] Ejemplos de empresas que vendieron sus productos después del plegado fueron Curis [117] e Intercytex. [116]
Muchas de las empresas abandonaron sus objetivos a largo plazo de desarrollar órganos completamente funcionales en favor de productos y tecnologías que podrían generar ganancias en el corto plazo. [116] Ejemplos de este tipo de productos son los productos de la industria cosmética y de pruebas.
En otros casos, como en el caso de Advanced Tissue Sciences, los fundadores iniciaron nuevas empresas. [116]
En la década de 2010, el marco regulatorio también comenzó a facilitar un tiempo de comercialización más rápido, especialmente en los EE. UU., a medida que la FDA creó nuevos centros y vías específicamente dirigidas a productos provenientes de células vivas, como el Centro de Evaluación e Investigación de Productos Biológicos . [116]
Los primeros productos de ingeniería de tejidos empezaron a ser comercialmente rentables en la década de 2010. [117]
En Europa, la regulación se divide actualmente en tres áreas de regulación: dispositivos médicos , productos medicinales y productos biológicos . Los productos de ingeniería de tejidos suelen ser de naturaleza híbrida, ya que suelen estar compuestos de células y una estructura de soporte. Si bien algunos productos pueden aprobarse como medicamentos, otros necesitan obtener la aprobación como dispositivos médicos. [118] Derksen explica en su tesis que los investigadores en ingeniería de tejidos a veces se enfrentan a regulaciones que no se ajustan a las características de la ingeniería de tejidos. [119]
En Europa se han observado nuevos regímenes regulatorios que abordan estas cuestiones. [120] Una encuesta realizada en el Reino Unido explica las dificultades para encontrar un consenso normativo en esta materia. [118] Los autores atribuyen estos problemas a la estrecha relación y superposición con otras tecnologías como los xenotrasplantes . Por lo tanto, los órganos reguladores no pueden tratarlo por separado. [118] La regulación se complica aún más por las controversias éticas asociadas con este y otros campos de investigación relacionados (por ejemplo, controversia sobre las células madre , ética del trasplante de órganos ). El mismo estudio mencionado anteriormente [118] muestra, con el ejemplo del autotrasplante de cartílago, que una tecnología específica puede ser considerada "pura" o "contaminada" por el mismo actor social.
Dos movimientos regulatorios son los más relevantes para la ingeniería de tejidos en la Unión Europea . Se trata de la Directiva 2004/23/CE sobre normas de calidad y seguridad para el abastecimiento y procesamiento de tejidos humanos [121] , que fue adoptada por el Parlamento Europeo en 2004, y una propuesta de reglamento sobre productos fabricados con tejidos humanos. Este último fue desarrollado bajo los auspicios de la DG Empresa de la Comisión Europea y presentado en Bruselas en 2004. [122]