La clasificación de Goldschmidt , [1] [2] desarrollada por Victor Goldschmidt (1888-1947), es una clasificación geoquímica que agrupa los elementos químicos dentro de la Tierra según sus fases anfitrionas preferidas en litófilos ( amantes de las rocas ), siderófilos ( amantes del hierro ), calcófilos ( amantes de los minerales de sulfuro o calcógenos ) y atmófilos (amantes de los gases) o volátiles (el elemento, o un compuesto en el que se encuentra, es líquido o gaseoso en condiciones ambientales de la superficie).
Algunos elementos tienen afinidades con más de una fase. La afinidad principal se indica en la tabla siguiente y a continuación se incluye un análisis de cada grupo.
Clasificación de Goldschmidt: Litófilo Siderófilo Calcofilo Atmófilo Traza/Sintético
Los elementos litófilos (del griego antiguo λῐ́θος ( líthos ) 'piedra' y φίλος ( phílos ) 'querido, amado') son aquellos que permanecen en la superficie o cerca de ella porque se combinan fácilmente con el oxígeno, formando compuestos que no se hundieron en el núcleo de la Tierra . Los elementos litófilos incluyen Al , B , Ba , Be , Br , Ca , Cl , Cr , Cs , F , I , Hf , K , Li , Mg , Na , Nb , O , P , Rb , Sc , Si , Sr , Ta , Th , Ti , U , V , Y , Zr , W y los lantánidos o elementos de tierras raras (REE).
Los elementos litófilos están compuestos principalmente por metales altamente reactivos de los bloques s y f . También incluyen una pequeña cantidad de no metales reactivos y los metales más reactivos del bloque d, como el titanio , el circonio y el vanadio .
La mayoría de los elementos litófilos forman iones muy estables con una configuración electrónica de gas noble (a veces con electrones f adicionales). Los pocos que no lo hacen, como el silicio, el fósforo y el boro, forman fuertes enlaces covalentes con el oxígeno, a menudo implicando enlaces pi . Su fuerte afinidad por el oxígeno hace que los elementos litófilos se asocien muy fuertemente con el sílice , formando minerales de densidad relativamente baja que así se elevaron hacia la corteza durante la diferenciación planetaria . Los minerales más solubles formados por los metales alcalinos tienden a concentrarse en el agua de mar o en regiones áridas donde pueden cristalizar. Los elementos litófilos menos solubles se concentran en antiguos escudos continentales donde los minerales solubles han sido erosionados .
Debido a su fuerte afinidad por el oxígeno, la mayoría de los elementos litófilos están enriquecidos en la corteza terrestre en relación con su abundancia en el sistema solar. Se sabe que los metales de los bloques s y f más reactivos, que forman hidruros salinos o metálicos , están extraordinariamente enriquecidos en la Tierra en su conjunto en relación con sus abundancias solares. Esto se debe a que durante las primeras etapas de la formación de la Tierra , la abundancia de formas estables de cada elemento estaba determinada por la facilidad con la que forma hidruros volátiles; estos volátiles podían entonces "escapar" de la proto-Tierra, dejando atrás aquellos elementos no reactivos con el hidrógeno. En estas condiciones, los metales de los bloques s y f se enriquecieron fuertemente durante la formación de la Tierra. Los elementos más enriquecidos son el rubidio , el estroncio y el bario , que juntos representan más del 50 por ciento en masa de todos los elementos más pesados que el hierro en la corteza terrestre.
Los litófilos no metálicos ( el fósforo y los halógenos ) existen en la Tierra en forma de sales iónicas con metales del bloque s en las pegmatitas y el agua de mar. Con excepción del flúor , cuyo hidruro forma enlaces de hidrógeno y, por lo tanto, es de una volatilidad relativamente baja, estos elementos han visto sus concentraciones en la Tierra reducidas significativamente a través del escape de hidruros volátiles durante la formación de la Tierra. Aunque están presentes en la corteza terrestre en concentraciones bastante cercanas a sus abundancias solares, el fósforo y los halógenos más pesados probablemente estén significativamente agotados en la Tierra en su conjunto en relación con sus abundancias solares.
Varios metales de transición, entre ellos el cromo , el molibdeno , el hierro y el manganeso , presentan características litófilas y siderófilas y pueden encontrarse en ambas capas. Aunque estos metales forman fuertes enlaces con el oxígeno y nunca se encuentran en la corteza terrestre en estado libre, se cree que es muy probable que existan formas metálicas de estos elementos en el núcleo de la Tierra como reliquias de cuando la atmósfera no contenía oxígeno. Al igual que los siderófilos "puros", estos elementos (excepto el hierro) están considerablemente agotados en la corteza en relación con sus abundancias solares.
Debido a su fuerte afinidad por el oxígeno, los metales litófilos, aunque constituyen la mayor parte de los elementos metálicos de la corteza terrestre, nunca estuvieron disponibles como metales libres antes del desarrollo de la electrólisis . Con este desarrollo, muchos metales litófilos tienen un valor considerable como metales estructurales ( magnesio , aluminio , titanio , vanadio ) o como agentes reductores ( sodio , magnesio , calcio ).
Los primeros químicos tampoco conocían los no metales fósforo y halógenos, aunque la producción de estos elementos es menos difícil que la de los litófilos metálicos, ya que solo se requiere electrólisis con flúor. El cloro elemental es particularmente importante como agente oxidante , y generalmente se produce por electrólisis del cloruro de sodio .
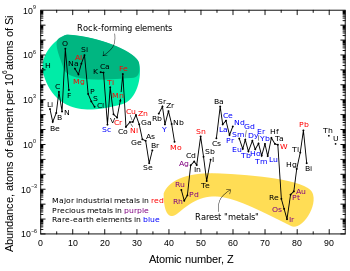
Los elementos siderófilos (del griego antiguo σίδηρος ( sídēros ) 'hierro') son los metales de transición que tienden a hundirse hacia el núcleo durante la diferenciación planetaria , porque se disuelven fácilmente en hierro, ya sea como soluciones sólidas o en estado fundido. Algunas fuentes [3] incluyen elementos que no son metales de transición en su lista de siderófilos, como el germanio . Otras fuentes también pueden diferir en su lista según la temperatura en cuestión: el niobio , el vanadio , el cromo y el manganeso pueden considerarse siderófilos o no, dependiendo de la temperatura y la presión asumidas. [4] También es confuso el tema porque algunos elementos, como el manganeso antes mencionado , así como el molibdeno , forman enlaces fuertes con el oxígeno, pero en estado libre (como existían en la Tierra primitiva cuando no existía el oxígeno libre ) pueden mezclarse tan fácilmente con el hierro que no se concentran en la corteza silícea, como lo hacen los verdaderos elementos litófilos. Mientras tanto, el hierro está simplemente en todas partes .
Los elementos siderófilos incluyen el altamente siderófilo rutenio , rodio , paladio , renio , osmio , iridio , platino y oro , el moderadamente siderófilo cobalto y níquel , además de los elementos "disputados" mencionados anteriormente –algunas fuentes [3] incluso incluyen tungsteno y plata . [5]
La mayoría de los elementos siderófilos prácticamente no tienen afinidad por el oxígeno: de hecho, los óxidos de oro son termodinámicamente inestables . Forman enlaces más fuertes con el carbono o el azufre , pero incluso estos no son lo suficientemente fuertes como para separarse con los elementos calcófilos. Por lo tanto, los elementos siderófilos están unidos al hierro a través de enlaces metálicos en el núcleo de la Tierra, donde las presiones pueden ser lo suficientemente altas como para mantener el hierro sólido. El manganeso, el hierro y el molibdeno forman enlaces fuertes con el oxígeno, pero en estado libre (como en la Tierra primitiva) pueden mezclarse tan fácilmente con el hierro que no se concentran en la corteza silícea, como lo hacen los verdaderos elementos litófilos. Sin embargo, los minerales de manganeso se encuentran en los mismos sitios que los de aluminio y titanio, debido a la gran reactividad del manganeso hacia el oxígeno.
Debido a que están tan concentrados en el núcleo denso, los elementos siderófilos son conocidos por su rareza en la corteza terrestre. La mayoría de ellos siempre han sido conocidos como metales preciosos debido a esto. El iridio es el metal de transición más raro que se encuentra dentro de la corteza terrestre, con una abundancia en masa de menos de una parte por mil millones. Los depósitos explotables de metales preciosos generalmente se forman como resultado de la erosión de rocas ultramáficas , pero no están altamente concentrados incluso en comparación con sus abundancias en la corteza , que suelen ser varios órdenes de magnitud inferiores a sus abundancias solares. Sin embargo, debido a que están concentrados en el manto y el núcleo de la Tierra , se cree que los elementos siderófilos están presentes en la Tierra en su conjunto (incluido el núcleo) en algo que se acerca a sus abundancias solares.
Los elementos calcófilos (del griego antiguo χαλκός ( khalkós ) 'cobre, latón, bronce', también 'mineral') incluyen Ag , As , Bi , Cd , Cu , Ga , Ge , Hg , In , Pb , S , Sb , Se , Sn , Te , Tl y Zn . [6]
Los elementos calcófilos son aquellos que permanecen en la superficie o cerca de ella porque se combinan fácilmente con el azufre y otros calcógenos distintos del oxígeno, formando compuestos que no se hundieron junto con el hierro hacia el núcleo de la Tierra. Los elementos calcófilos son aquellos metales y no metales más pesados que tienen una baja afinidad por el oxígeno y prefieren unirse con el azufre en forma de sulfuros altamente insolubles .
Como estos sulfuros son mucho más densos que los minerales de silicato formados por elementos litófilos, los elementos calcófilos se separaron por debajo de los litófilos en el momento de la primera cristalización de la corteza terrestre. Esto ha provocado su agotamiento en la corteza terrestre en relación con su abundancia solar, aunque como los minerales que forman son no metálicos, este agotamiento no ha alcanzado los niveles encontrados con los elementos siderófilos.
Sin embargo, debido a que formaron hidruros volátiles en la nebulosa protosolar en proceso de acreción cuando la reacción redox controladora fue la oxidación o reducción del hidrógeno, los elementos calcófilos menos metálicos están fuertemente agotados en la Tierra en su conjunto en relación con las abundancias cósmicas. Esto es especialmente cierto en el caso de los calcógenos selenio y telurio (que formaron seleniuro de hidrógeno volátil y telururo de hidrógeno , respectivamente), que por esta razón se encuentran entre los elementos más raros que se encuentran en la corteza terrestre (para ilustrarlo, el telurio es tan abundante como el platino ).
Los elementos calcófilos más metálicos (de los grupos del cobre, el cinc y el boro) pueden mezclarse en cierta medida con el hierro en el núcleo de la Tierra. No es probable que se agoten en la Tierra en su conjunto en relación con sus abundancias solares, ya que no forman hidruros volátiles. El cinc y el galio son algo "litófilos" en la naturaleza porque a menudo se encuentran en silicatos o minerales relacionados y forman enlaces bastante fuertes con el oxígeno. El galio, en particular, se obtiene principalmente de la bauxita , un mineral de hidróxido de aluminio en el que los iones de galio sustituyen al aluminio, químicamente similar.
Aunque ningún elemento calcófilo es muy abundante en la corteza terrestre, los elementos calcófilos constituyen la mayor parte de los metales de importancia comercial. Esto se debe a que, mientras que los elementos litófilos requieren una electrólisis intensiva en energía para su extracción, los calcófilos se pueden extraer fácilmente por reducción y la concentración geoquímica de los calcófilos, que en casos extremos puede superar las 100.000 veces su abundancia media en la corteza terrestre. Estos mayores enriquecimientos se producen en altas mesetas como la meseta tibetana y el altiplano boliviano , donde grandes cantidades de elementos calcófilos han sido elevadas a través de la tectónica de placas . Un efecto secundario de esto en los tiempos modernos es que los calcófilos más raros (como el mercurio ) están tan completamente explotados que su valor como minerales ha desaparecido casi por completo.
Los elementos atmófilos (del griego antiguo ἀτμός ( atmós ) 'vapor, humo') son H , C , N y los gases nobles . [7]
Los elementos atmófilos (también llamados " elementos volátiles ") se definen como aquellos que permanecen principalmente sobre la superficie de la Tierra o por encima de ella porque son, o se encuentran en, líquidos y/o gases a temperaturas y presiones que se encuentran en la superficie. Los gases nobles no forman compuestos estables y se presentan como gases monoatómicos , mientras que el nitrógeno , aunque altamente reactivo como átomo libre, se enlaza tan fuertemente al nitrógeno molecular diatómico que todos los óxidos de nitrógeno son termodinámicamente inestables con respecto al nitrógeno y al oxígeno. En consecuencia, con el desarrollo del oxígeno libre en la atmósfera de la Tierra, el amoníaco se oxidó a nitrógeno molecular que ha llegado a formar cuatro quintas partes de la atmósfera de la Tierra. El carbono también se clasifica como un atmófilo porque forma enlaces múltiples muy fuertes con el oxígeno en el monóxido de carbono (oxidado lentamente en la atmósfera) y el dióxido de carbono . Este último es el cuarto constituyente más grande de la atmósfera de la Tierra, mientras que el monóxido de carbono se produce naturalmente a partir de varias fuentes ( volcanes , combustión) y tiene un tiempo de residencia en la atmósfera de unos pocos meses.
El hidrógeno, que se encuentra en el agua, también se clasifica como un átomo atmófilo. El agua se clasifica como volátil, porque la mayor parte es líquida o gaseosa, aunque puede existir como un compuesto sólido en la superficie de la Tierra. El agua también se puede incorporar a otros minerales como agua de cristalización (como en el caso del yeso ) o mediante enlaces iónicos y de hidrógeno (como en el caso del talco ), lo que le otorga al hidrógeno un carácter litófilo.
Como todos los elementos atmófilos son gases o forman hidruros volátiles, los elementos atmófilos están fuertemente agotados en la Tierra en su conjunto en relación con sus abundancias solares debido a las pérdidas de la atmósfera durante la formación de la Tierra . Los gases nobles más pesados ( criptón , xenón ) son los elementos estables más raros en la Tierra. (De hecho, ellos, junto con el neón , fueron todos ellos aislados y descritos por primera vez por William Ramsay y Morris Travers y asistentes, quienes les dieron nombres con derivaciones del griego antiguo de 'oculto', 'extraño' y 'nuevo', respectivamente).
El argón es la excepción entre los gases nobles: es el tercer componente más abundante de la atmósfera actual de la Tierra después del nitrógeno y el oxígeno, y representa aproximadamente el 1%. El argón-40 es un hijo estable del potasio-40 radiactivo, y el argón es lo suficientemente pesado como para ser capturado gravitacionalmente por la Tierra post-acreción, por lo que, si bien el argón primordial de la proto-Tierra fue expulsado en su mayor parte, este argón radiogénico se ha acumulado a lo largo del tiempo geológico. Esto hace que la abundancia de argón de la Tierra sea sustancialmente diferente de las proporciones de abundancia cósmica para el argón, al estar enormemente enriquecido en40
Arkansas
, mientras36
Arkansas
predomina cósmicamente.
Los elementos sintéticos quedan excluidos de la clasificación porque no se encuentran en la naturaleza.
Los elementos radiactivos traza (a saber, Tc, Pm, Po, At, Rn, Fr, Ra, Ac, Pa, Np, Pu) también se tratan como sintéticos. Aunque estos ocurren en la naturaleza, [8] [9] [10] su ocurrencia depende de sus progenitores de larga vida Th y U, y no son muy móviles. Por ejemplo, la química del polonio predeciría que es un calcófilo, pero tiende a ocurrir en cambio como un litófilo junto con su progenitor uranio . Incluso el radón , un gas en condiciones estándar , no suele tener tiempo para viajar muy lejos de la fuente original de uranio antes de desintegrarse. Cuando es necesario, estos elementos normalmente se producen sintéticamente en reactores nucleares en lugar de extraerlos de minerales.