
En química orgánica , la reducción de carbonilo es la conversión de cualquier grupo carbonilo , generalmente en un alcohol. Es una transformación común que se practica de muchas maneras. [1] Las cetonas , aldehídos , ácidos carboxílicos , ésteres , amidas y haluros de ácido (algunos de los grupos funcionales más extendidos ) comprenden compuestos carbonílicos. Los ácidos carboxílicos, ésteres y haluros de ácido se pueden reducir a aldehídos o un paso más allá a alcoholes primarios , dependiendo de la fuerza del agente reductor. Los aldehídos y las cetonas se pueden reducir respectivamente a alcoholes primarios y secundarios . En la desoxigenación , el grupo alcohol se puede reducir aún más y eliminar por completo mediante su reemplazo con H.
Existen dos estrategias generales para la reducción de carbonilo. Un método, que se prefiere en la industria, utiliza hidrógeno como reductor. Este enfoque se denomina hidrogenación y requiere catalizadores metálicos. El otro enfoque general emplea reactivos estequiométricos que liberan H - y H + por separado. Este artículo se centra en el uso de estos reactivos. Entre ellos, destacan las sales de metales alcalinos de borohidruros e hidruros de aluminio.

En términos del mecanismo de reacción , los hidruros metálicos efectúan la adición nucleofílica del hidruro al carbono carbonílico. La facilidad de adición del hidruro al carbonilo se ve afectada por la electrofilicidad y el volumen del carbonilo, así como por las propiedades electrónicas y estéricas correspondientes del reactivo hidruro. El resultado de estas tendencias es que los haluros de ácido, las cetonas y los aldehídos suelen ser los compuestos que se reducen más fácilmente, mientras que los ácidos y los ésteres requieren agentes reductores más fuertes. Es importante y característico que estos reactivos hidruros generalmente no ataquen los enlaces C=C. [2]
Varios factores contribuyen a la fuerza de los agentes reductores de hidruro metálico. El poder reductor de los reactivos de borohidruro se ve afectado por el contraión , como Na + vs Li + que puede activar carbonilos al coordinarse con el oxígeno carbonílico. Li + se une al oxígeno carbonílico con más fuerza que Na + . [3] En el caso de los tetrahidroaluminatos, sin embargo, NaAlH 4 y LiAlH 4 se comportan de manera similar. [2] Se han investigado muchos aditivos metálicos. Por ejemplo, el borohidruro de zinc, nominalmente Zn(BH 4 ) 2 , se utiliza para la reducción selectiva suave de aldehídos y cetonas en presencia de otros grupos reducibles. [4]
El metal central (normalmente B frente a Al) influye considerablemente en la fuerza del agente reductor. Los hidruros de aluminio son más nucleófilos y mejores agentes reductores en relación con los borohidruros. [5] El borohidruro de sodio, un reductor relativamente débil, se utiliza normalmente para reducir cetonas y aldehídos. Tolera muchos grupos funcionales (grupo nitro, nitrilo, éster). [6]
En cuanto a sus propiedades de manipulación, el hidruro de litio y aluminio y el borohidruro de sodio (y sus derivados) difieren considerablemente. El NaBH4 es mucho más fácil de manipular que el LiAlH4 , ya que es estable al aire durante semanas. Se puede utilizar con agua o etanol como disolventes, mientras que el LiAlH4 reacciona de forma explosiva con disolventes próticos.
Los sustituyentes del boro o del aluminio modulan la potencia, la selectividad y las propiedades de manipulación de estos agentes reductores. Los grupos que atraen electrones, como el acetoxi y el ciano, reducen la potencia reductora, de modo que el NaBH(OAc) 3 y el NaBH3 ( CN) son agentes reductores débiles. Los grupos que donan electrones, como los grupos alquilo, mejoran la fuerza reductora. El superhidruro (trietilborohidruro de litio) y el L-selectruro son fuertes reductores, por lo que su manipulación es peligrosa.
La siguiente tabla [7] ilustra qué grupos funcionales carbonilo pueden reducirse mediante qué agentes reductores (algunos de estos reactivos varían en eficacia dependiendo de las condiciones de reacción):

En comparación con los aldehídos y las cetonas, los ácidos carboxílicos son difíciles de reducir. El hidruro de litio y aluminio suele ser eficaz. El primer paso implica la desprotonación del ácido carboxílico. El paso final en la reducción de ácidos carboxílicos y ésteres es la hidrólisis del alcóxido de aluminio. [8] Los ésteres (y las amidas ) se reducen más fácilmente que los ácidos carboxílicos originales. Su reducción produce alcoholes y aminas, respectivamente. [9] La ecuación idealizada para la reducción de un éster mediante hidruro de litio y aluminio es:
El borohidruro de sodio puede, en algunas circunstancias, utilizarse para la reducción de ésteres, especialmente con aditivos. [1]
La formación de aldehídos a partir de derivados de ácido carboxílico es un desafío porque los agentes reductores más débiles (NaBH 4 ) suelen ser muy lentos para reducir ésteres y ácidos carboxílicos, mientras que los agentes reductores más fuertes (LiAlH 4 ) reducen inmediatamente el aldehído formado a un alcohol. [10]

En la reducción de Fukuyama , un ácido carboxílico se convierte primero en un tioéster mediante la adición de un tiol (con un mecanismo similar a la esterificación ). [11] Luego, el tioéster se reduce a un aldehído mediante un hidruro de sililo con un catalizador de paladio.
Los cloruros de ácido se pueden reducir para dar aldehídos con donantes de hidruros estéricamente impedidos. El agente reductor DIBAL-H (hidruro de diisobutilaluminio) se utiliza a menudo para este fin, aunque normalmente reduce cualquier carbonilo. DIBAL-H puede reducir selectivamente los cloruros de ácido al nivel de aldehído si sólo se utiliza un equivalente a bajas temperaturas. [12] LiAlH(OtBu) 3 (formado a partir de LiAlH 4 y tBuOH in situ) se comporta de forma similar. [13] La ecuación idealizada para la reducción de un cloruro de ácido a un aldehído por hidruro de litio y aluminio es:
El método tradicional de formación de aldehídos sin reducción a alcoholes (mediante el uso de hidruros impedidos y carbonilos reactivos) está limitado por su estrecho espectro de sustratos y su gran dependencia de las condiciones de reacción. Una solución alternativa para evitar este método es reducir el derivado de ácido carboxílico hasta formar un alcohol y luego oxidar el alcohol nuevamente hasta formar un aldehído. Otras alternativas incluyen la formación de un tioéster o una amida de Weinreb y luego reducir la nueva especie a un aldehído mediante la reducción de Fukuyama o la reacción de Weinreb respectivamente, o mediante hidrogenación catalítica como en la reacción de Rosenmund.
En la síntesis de cetonas de Weinreb , un cloruro de acilo se convierte primero en la amida de Weinreb, luego se trata con un reactivo organometálico para formar una cetona, o hidruro de litio y aluminio para formar un aldehído: [14]
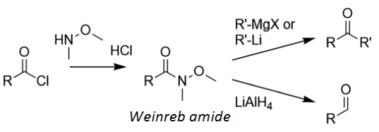
La amida de Weinreb se reduce a través de un quelato estable , en lugar del carbonilo electrófilo que se forma a través de reducciones con hidruro metálico; por lo tanto, el quelato solo se reduce una vez, como se ilustra a continuación:

La reacción de Rosenmund reduce los cloruros de acilo a aldehídos utilizando gas hidrógeno con un catalizador de paladio sobre sulfato de bario, cuya pequeña área superficial evita la sobrereducción. [15]
Las cetonas son menos reactivas que los aldehídos, debido a mayores efectos estéricos y a que el grupo alquilo adicional aporta densidad electrónica al enlace C=O, lo que lo hace menos electrofílico. [16] Dado que los aldehídos se reducen más fácilmente que las cetonas, requieren reactivos y condiciones más suaves. En el otro extremo, los ácidos carboxílicos, las amidas y los ésteres son poco electrofílicos y requieren agentes reductores fuertes. [17]
La ecuación idealizada para la reducción de una cetona por borohidruro de sodio es:

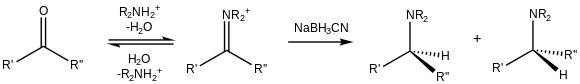
Además de su reducción a alcoholes, los aldehídos y cetonas pueden convertirse en aminas, es decir, aminación reductora. [18] Debido a su sustituyente ciano, NaBH 3 CN es un reductor débil a pH moderado (>4), por lo que reduce preferentemente los cationes iminio que existen en presencia de carbonilos:

Cuando se reduce un carbonilo α,β-insaturado, pueden resultar tres productos: un alcohol alílico de una reducción simple de carbonilo, una cetona saturada o un aldehído resultante de una reducción 1,4 (también llamada reducción conjugada ) o el alcohol saturado de una reducción doble. [19] El uso de NaBH 4 puede dar cualquiera de estos resultados, pero InCl 3 o NiCl 2 catalizan específicamente reducciones 1,4. [1] El tri(sec-butil)borohidruro de potasio o litio a veces selecciona reducciones 1,4, pero puede verse obstaculizado por un impedimento estérico. [20] Los grupos de hidruro de trifenilfosfinocobre dirigen la hidrogenación catalítica para realizar específicamente una reducción conjugada.
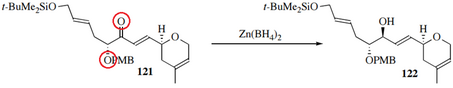
Para formar selectivamente el alcohol alílico y evitar el producto 1,4, la reducción de Luche utiliza "borohidruro de cerio" generado in situ a partir de NaBH 4 y CeCl 3 (H 2 O) 7 [21] [22] La fuente de hidruro Zn(BH 4 ) 2 también muestra selectividad 1,2, así como una mayor diastereoselectividad. Lo hace coordinándose no solo con el oxígeno del carbonilo sino también con los átomos adyacentes: [23]
Un caso especial de reducción de carbonilo implica la desoxigenación completa, es decir, la hidrogenólisis. Este resultado suele ser indeseable porque implica desfuncionalización.
Algunas reacciones para esta transformación incluyen la reducción de Clemmensen (en condiciones fuertemente ácidas) y la reducción de Wolff-Kishner (en condiciones fuertemente básicas), así como las diversas modificaciones de la reacción de Wolff-Kishner. La modificación de Caglioti, por ejemplo, utiliza tosilhidrazona con un donante de hidruro en condiciones más suaves sin base; [24] la modificación de Myers sustituye la hidrazina con bis(terc-butildimetilsilil)-hidrazina, utiliza condiciones más suaves a temperatura ambiente y es rápida y eficiente. [25]
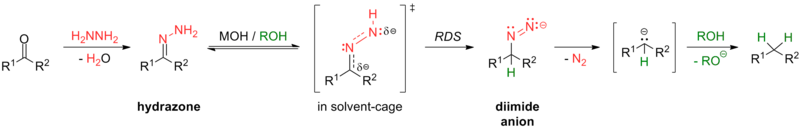
Los carbonilos aromáticos se reducen más fácilmente a sus respectivos alcanos que los compuestos alifáticos . [26] Por ejemplo, las cetonas se reducen a sus respectivos alquilbencenos mediante hidrogenación catalítica [27] [28] o mediante reducción de Birch [29] en condiciones suaves.
En la reducción de ciclohexanonas, la fuente de hidruro puede atacar axialmente para producir un alcohol ecuatorial, o ecuatorialmente para producir un alcohol axial. En el ataque axial (mostrado en rojo), el hidruro encuentra una tensión 1,3-diaxial . En el ataque ecuatorial (mostrado en azul), el hidruro evita la interacción 1,3-diaxial, pero el sustrato sufre una tensión torsional desfavorable cuando el alcohol recién formado y el átomo de hidrógeno agregado se eclipsan entre sí en el intermedio de reacción (como se muestra en la proyección de Newman para el alcohol axial).
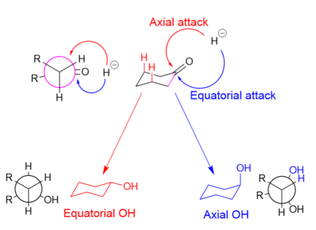
Los agentes reductores grandes, como LiBH(Me 2 CHCHMe) 3 , se ven obstaculizados por las interacciones 1,3-axiales y, por lo tanto, atacan ecuatorialmente. [6] Los agentes reductores pequeños, como NaBH 4 , atacan preferentemente axialmente para evitar las interacciones eclipsantes, porque la interacción 1,3-diaxial para moléculas pequeñas es mínima; también se han citado razones estereoelectrónicas para la preferencia axial de los agentes reductores pequeños. [30] Sin embargo, hacer que el sustrato sea más voluminoso (y aumentar las interacciones 1,3-axiales) disminuye la prevalencia de ataques axiales, incluso para pequeños donantes de hidruro. [31]
Cuando se reducen las cetonas asimétricas, el alcohol secundario resultante tiene un centro quiral que puede controlarse utilizando catalizadores quirales.
Las reducciones de carbonilo bien conocidas en la síntesis asimétrica son la hidrogenación asimétrica de Noyori (reducción de beta-cetoéster/Ru/BINAP) y la reducción de CBS (BH 3 , catalizador quiral derivado de prolina).
La reducción de Bouveault-Blanc , que emplea una mezcla de sodio metálico en presencia de alcoholes, fue un método temprano para la reducción de carbonilos. [32] Ahora está en gran parte obsoleto. Después del descubrimiento de la reducción de Bouveault-Blanc, se desarrollaron muchos métodos, incluido el gran avance de la hidrogenación catalítica donde el H 2 actúa como reductor. [33] Las sales de boro e hidruros de aluminio, descubiertos a partir de la década de 1940, demostraron ser reactivos muy convenientes para la reducción de carbonilos.
En la reducción de Meerwein-Ponndorf-Verley , el isopropóxido de aluminio funciona como fuente de hidruro. El estado de esta reacción se ha resumido de la siguiente manera: "el químico orgánico sintético rara vez intentará utilizar una técnica tan convencional como la reacción de Meerwein-Ponndorf-Verley (MPV)". [34]