La reducción de Corey-Itsuno , también conocida como reducción de Corey-Bakshi-Shibata (CBS) , es una reacción química en la que una cetona proquiral se reduce enantioselectivamente para producir el correspondiente alcohol quiral , no racémico. El reactivo de oxazaborolidina que media en la reducción enantioselectiva de cetonas fue desarrollado previamente por el laboratorio de Itsuno y, por tanto, esta transformación puede denominarse más propiamente reducción de oxazaborolidina de Itsuno-Corey. [1]

En 1981, Itsuno y sus colaboradores informaron por primera vez sobre el uso de complejos quirales de alcoxia-amina-borano para reducir cetonas aquirales a alcoholes quirales de forma enantioselectiva y con alto rendimiento. [1] Varios años más tarde, en 1987, EJ Corey y sus compañeros de trabajo desarrollaron la reacción entre aminoalcoholes quirales y borano (BH 3 ), generando productos de oxazaborolidina que demostraron catalizar rápidamente la reducción enantioselectiva de cetonas aquirales en presencia de BH 3 •THF. . [2] [3]
Desde entonces, los químicos orgánicos han utilizado la reducción de CBS como un método fiable para la reducción asimétrica de cetonas aquirales. En particular, ha encontrado un uso destacado no sólo en una serie de síntesis de productos naturales, sino que también se ha utilizado a gran escala en la industria (consulte el alcance a continuación). Se han publicado varias reseñas. [4] [5] [6]
Corey y compañeros de trabajo propusieron originalmente el siguiente mecanismo de reacción para explicar la selectividad obtenida en la reducción catalítica. [2] [3]
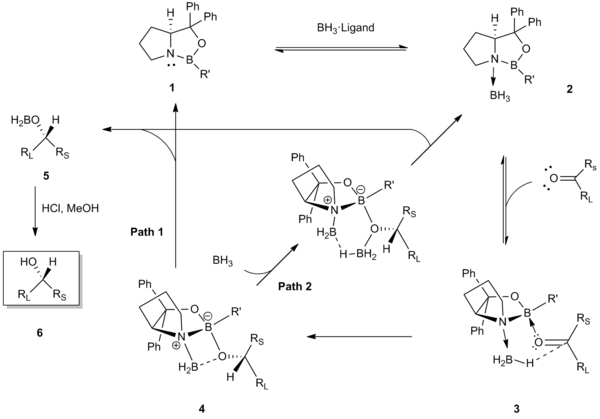
El primer paso del mecanismo implica la coordinación de BH 3 con el átomo de nitrógeno del catalizador 1 de oxazaborolidina CBS . Esta coordinación sirve para activar el BH 3 como donante de hidruro y para mejorar la acidez de Lewis del boro endocíclico del catalizador. [5] Las estructuras cristalinas de rayos X y los análisis espectroscópicos de RMN 11 B del complejo coordinado catalizador-borano 2 han brindado apoyo para este paso inicial. [5] [7] Posteriormente, el boro endocíclico del catalizador se coordina con la cetona en el par solitario de electrones estéricamente más accesible (es decir, el par solitario más cercano al sustituyente más pequeño, Rs). Esta unión preferencial en 3 actúa para minimizar las interacciones estéricas entre la cetona (el sustituyente R L grande dirigido hacia afuera) y el grupo R' del catalizador, y alinea el carbonilo y el borano coordinado para una transferencia de hidruro selectiva de cara favorable a través de un estado de transición de seis miembros 4 . [8] [9] La transferencia de hidruro produce el alcoxiborano quiral 5 , que tras un tratamiento ácido produce el alcohol quiral 6 . El último paso para regenerar el catalizador puede tener lugar por dos vías diferentes ( Ruta 1 o 2 ). [10] [11] [12]
La fuerza impulsora predominante para esta transferencia intramolecular de hidruro selectiva por caras es la activación simultánea del reactivo de borano mediante la coordinación con el nitrógeno básico de Lewis y el aumento de la acidez de Lewis del átomo de boro endocíclico para la coordinación con la cetona. [5]
La reducción de CBS ha demostrado ser un método eficaz y potente para reducir una amplia gama de diferentes tipos de cetonas de forma estereoselectiva y quimioselectiva . Los sustratos incluyen una gran variedad de sistemas aril-alifáticos, dialifáticos, di-arílicos, enonas e inonas α,β insaturadas , así como cetonas que contienen heteroátomos . [5] [13] Se han empleado combinaciones de diferentes derivados del catalizador CBS y agentes reductores de borano para optimizar la enantioselectividad.

En esta selección de sustratos cabe destacar varios casos interesantes. Primero, en el caso del sistema diarilo 9 , se logra una estereoselectividad relativamente alta a pesar de la naturaleza isostérica de los sustituyentes cetonas, lo que sugiere que la electrónica además de los estéricos puede desempeñar un papel en la estereoselectividad de la reducción de CBS. [5] Las diferencias en la sustitución de los restos alquino en las ynonas 11 y 12 dan como resultado un cambio de selectividad para que el alquino funcione como el sustituyente estéricamente más voluminoso en lugar del más pequeño. Para los sistemas α,β insaturados 10 - 12 , se produce una reducción eficiente de la cetona a pesar de la posible reacción secundaria de hidroboración del enlace insaturado CC. También se ha demostrado que la reducción de CBS tolera la presencia de heteroátomos como en la cetona 13 , que es capaz de coordinarse con el borano.
Se ha demostrado que la presencia de agua en la mezcla de reacción tiene un efecto significativo sobre los excesos enantioméricos y, por tanto, la reducción de CBS debe realizarse en condiciones anhidras. [14] La temperatura también juega un papel crítico en la estereoselectividad observada. En general, a temperaturas más bajas se obtienen excesos enantioméricos (ee). Sin embargo, cuando se aumenta la temperatura, los valores de ee alcanzan un valor máximo que depende de la estructura del catalizador y del agente reductor de borano utilizado. [15] El uso del reactivo borano catecolborano, que se ha demostrado que participa en las reducciones de CBS realizadas a temperaturas tan bajas como -126 °C con marcada enantioselectividad, ofrece una solución potencial para mejorar los valores disminuidos de ee obtenidos a temperaturas más bajas. [16] [17]
Se han informado problemas de enantioselectividad asociados con el uso de BH 3 como agente reductor para la reducción de CBS. Soluciones disponibles comercialmente de BH 3 •THF evaluadas por Nettles et al. Se demostró que contienen trazas de especies de borohidruro, que participan en reducciones no selectivas que condujeron a una enantioselectividad disminuida. [18] Aunque la vía de reducción catalizada por borohidruro es mucho más lenta que la reducción catalizada por CBS, la reacción secundaria todavía presenta un desafío potencial para optimizar la estereoselectividad.
En 2012, Mahale et al. desarrolló un procedimiento seguro y económico para la reducción asimétrica de cetonas utilizando catalizador de N , N -dietilanilina - borano y oxazaborolidina preparado in situ a partir de borohidruro de sodio, clorhidrato de N , N -dietilanilina y (S)-α,α-difenilprolinol [19]
Aunque el catalizador CBS 1 desarrollado por Corey se ha empleado habitualmente en la reacción de reducción de CBS, se han desarrollado y utilizado con éxito otros derivados del catalizador. El grupo R' del catalizador CBS juega un papel importante en la enantioselectividad de la reducción y, como se ilustra anteriormente en la sección Alcance, se han empleado varias variaciones del grupo CBS R' para optimizar la selectividad. [5] [13]
En las últimas dos décadas, la reducción de CBS ha adquirido una importante utilidad sintética en la síntesis de un número significativo de productos naturales, incluidas lactonas, terpenoides, alcaloides, esteroides y biotinas. [5] [6] [20] La reducción enantioselectiva también se ha empleado a gran escala en la industria. Jones y cols. utilizaron la reducción de CBS en la síntesis total de MK-0417, un inhibidor de la anhidrasa carbónica soluble en agua que se ha utilizado terapéuticamente para reducir la presión intraocular. [14] La reducción asimétrica de un intermedio de sulfona bicíclica clave se logró con el catalizador de oxazaborolidina CBS que contenía Me como grupo R'.

La reducción asimétrica de un compuesto 1,1,1-tricloro-2-ceto es la primera etapa de la reacción de Corey-Link para la síntesis de aminoácidos y estructuras relacionadas con la opción de estereoquímica natural o no natural y varias cadenas laterales. .
La reducción asimétrica de 7-(benciloxi)hept-1-en-3-ona conduce a (S)-7-(benciloxi)hept-1-en-3-ol, un alcohol quiral que conduce directamente a la síntesis de kanamienamidas , que Actualmente se investigan como enamidas que contienen éteres enólicos que muestran una potente inhibición de las células cancerosas. La formación selectiva del producto quiral se logra mediante el catalizador (R)-CBS con un rendimiento del 89 % y un exceso enantiomérico del 91 %. [21]