La hidrogenación asimétrica es una reacción química que agrega dos átomos de hidrógeno a una molécula objetivo (sustrato) con selectividad espacial tridimensional . Fundamentalmente, esta selectividad no proviene de la molécula objetivo en sí, sino de otros reactivos o catalizadores presentes en la reacción. Esto permite que la información espacial (lo que los químicos llaman quiralidad ) se transfiera de una molécula al objetivo, formando el producto como un solo enantiómero . La información quiral suele estar contenida en un catalizador y, en este caso, la información de una sola molécula de catalizador puede transferirse a muchas moléculas de sustrato, amplificando la cantidad de información quiral presente. Procesos similares ocurren en la naturaleza, donde una molécula quiral como una enzima puede catalizar la introducción de un centro quiral para dar un producto como un enantiómero único, como los aminoácidos , que una célula necesita para funcionar. Al imitar este proceso, los químicos pueden generar muchas moléculas sintéticas novedosas que interactúan con los sistemas biológicos de maneras específicas, dando lugar a nuevos agentes farmacéuticos y agroquímicos . La importancia de la hidrogenación asimétrica tanto en el mundo académico como en la industria contribuyó a que dos de sus pioneros, William Standish Knowles y Ryōji Noyori, recibieran colectivamente la mitad del Premio Nobel de Química de 2001 . [1]
En 1956 se demostró que un catalizador heterogéneo hecho de paladio depositado sobre seda efectuaba una hidrogenación asimétrica. [2] Posteriormente, en 1968, los grupos de William Knowles y Leopold Horner publicaron de forma independiente los ejemplos de hidrogenación asimétrica utilizando catalizadores homogéneos . Si bien solo mostraron excesos enantioméricos modestos , estas primeras reacciones demostraron viabilidad. En 1972, se alcanzó un exceso enantiomérico del 90% y se inició la primera síntesis industrial del fármaco L-DOPA para el Parkinson utilizando esta tecnología. [3] [4]

El campo de la hidrogenación asimétrica siguió experimentando una serie de avances notables. Henri Kagan desarrolló DIOP , una difosfina simétrica C2 de fácil preparación que daba altos ee en ciertas reacciones. Ryōji Noyori introdujo catalizadores a base de rutenio para sustratos polares hidrogenados asimétricos, como cetonas y aldehídos. Robert H. Crabtree demostró la capacidad de los compuestos de iridio para catalizar reacciones de hidrogenación asimétricas en 1979 con la invención del catalizador de Crabtree . [5] A principios de la década de 1990, la introducción de ligandos P,N por varios grupos de forma independiente amplió aún más el alcance de los ligandos simétricos C 2 , aunque no son fundamentalmente superiores a los ligandos quirales que carecen de simetría rotacional . [6]
Hoy en día, la hidrogenación asimétrica es una metodología de rutina en la química orgánica a escala industrial y de laboratorio. La importancia de la hidrogenación asimétrica fue reconocida por el Premio Nobel de Química de 2001 otorgado a William Standish Knowles y Ryōji Noyori .
Las hidrogenaciones asimétricas operan mediante mecanismos convencionales invocados para otras hidrogenaciones. Esto incluye mecanismos de esfera interna, mecanismos de esfera externa y mecanismos de metátesis del enlace σ. [7] El tipo de mecanismo empleado por un catalizador depende en gran medida de los ligandos utilizados en un sistema, lo que a su vez conduce a ciertas afinidades catalizador-sustrato.
El llamado mecanismo de esfera interna implica la coordinación del alqueno con el centro metálico. [8] Otras características de este mecanismo incluyen una tendencia a una división homolítica del dihidrógeno cuando hay más metales ricos en electrones y de baja valencia, mientras que los metales pobres en electrones y de alta valencia normalmente exhiben una escisión heterolítica del dihidrógeno asistida por una base. [9]
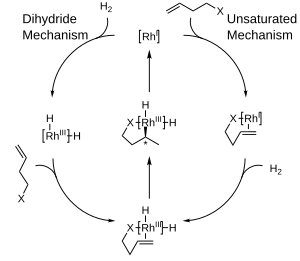
El siguiente diagrama muestra los mecanismos propuestos para la hidrogenación catalítica con complejos de rodio que son mecanismos de esfera interna. En el mecanismo insaturado, el producto quiral formado tendrá el modo opuesto al catalizador utilizado. Mientras que el complejo termodinámicamente favorecido entre el catalizador y el sustrato no puede sufrir una hidrogenación, el complejo inestable y desfavorecido sufre una hidrogenación rápidamente. [10] Por otro lado, el mecanismo del dihidruro ve el complejo inicialmente hidrogenado a la forma dihidruro. Esto permite posteriormente la coordinación del doble enlace en el lado no obstaculizado. Mediante inserción y eliminación reductora, la quiralidad del producto coincide con la del ligando. [11]
La preferencia por producir un enantiómero en lugar de otro en estas reacciones a menudo se explica en términos de interacciones estéricas entre el ligando y el sustrato proquiral . La consideración de estas interacciones ha llevado al desarrollo de diagramas de cuadrantes donde las áreas "bloqueadas" se indican con un cuadro sombreado, mientras que las áreas "abiertas" se dejan sin rellenar. En la reacción modelada, los grupos grandes en una olefina entrante tenderán a orientarse para llenar las áreas abiertas del diagrama, mientras que los grupos más pequeños se dirigirán a las áreas bloqueadas y luego se producirá el suministro de hidrógeno a la cara posterior de la olefina, fijando la estereoquímica . Tenga en cuenta que, en aras de la claridad, solo se muestra una parte del ligando de fosfina quiral.

Algunos catalizadores operan mediante "mecanismos de esfera externa", de modo que el sustrato nunca se une directamente al metal sino que interactúa con sus ligandos, que a menudo son un hidruro metálico y un hidrógeno prótico en un ligando. Como tal, en la mayoría de los casos el dihidrógeno se divide heterolíticamente, actuando el metal como un ácido de Lewis y una base externa o interna "desprotonando" el hidruro. [7]

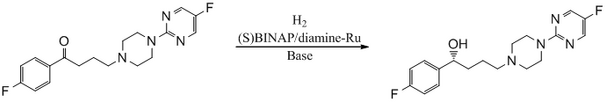
Como ejemplo de este mecanismo, podemos considerar el sistema BINAP-Ru-diamina. La forma dihaluro del catalizador se convierte en catalizadores mediante la reacción de H2 en presencia de una base: [12]
Los catalizadores resultantes tienen tres tipos de ligandos:
La "clase Noyori" de catalizadores a menudo se denomina catalizadores bifuncionales para enfatizar el hecho de que tanto el metal como el ligando (amina) son funcionales. [13]
En la hidrogenación de sustratos que contienen C=O, durante mucho tiempo se supuso que el mecanismo operaba mediante un estado de transición pericíclico /intermedio de seis miembros mediante el cual el centro hidruro de hidruro de rutenio ( H Ru-N H ) interactúa con el sustrato carbonilo R 2 C = O. [14] Estudios experimentales y DFT más recientes han demostrado que este modelo es en gran medida incorrecto. En cambio, la cadena principal de amina interactúa fuertemente con el activador de base, que a menudo se usa en gran exceso. [12] Sin embargo, en ambos casos, el sustrato no se une directamente con el centro metálico, lo que lo convierte en un gran ejemplo de mecanismo de esfera exterior.
Los AH prácticos emplean catalizadores a base de metal platino. [15] [16] [17]
El hierro es un objetivo de investigación popular para muchos procesos catalíticos, debido en gran parte a su bajo costo y baja toxicidad en relación con otros metales de transición. [18] Se han realizado métodos de hidrogenación asimétrica utilizando hierro, aunque en términos de velocidad y selectividad, son inferiores a los catalizadores basados en metales preciosos. [19] En algunos casos, las nanopartículas estructuralmente mal definidas han demostrado ser las especies activas in situ y la modesta selectividad observada puede deberse a sus geometrías no controladas. [20]
Los ligandos de fosfina quirales , especialmente los ligandos simétricos C2 , son la fuente de quiralidad en la mayoría de los catalizadores de hidrogenación asimétricos. De estos es muy conocido el ligando BINAP , como resultado de su aplicación ganadora del Premio Nobel en la hidrogenación asimétrica de Noyori . [3]
Los ligandos de fosfina quirales se pueden clasificar generalmente como mono o bidentados . Se pueden clasificar además según la ubicación del centro estereogénico: fósforo versus sustituyentes orgánicos. Los ligandos con un elemento de simetría C2 han sido particularmente populares, en parte porque la presencia de dicho elemento reduce drásticamente las posibles conformaciones de unión de un sustrato a un complejo metal-ligando (lo que a menudo resulta en una enantioselectividad excepcional). [21]
Los ligandos de tipo monofosfina estuvieron entre los primeros en aparecer en la hidrogenación asimétrica, por ejemplo, el ligando CAMP. [22] La investigación continua sobre estos tipos de ligandos ha explorado ligandos unidos tanto por P -alquilo como por P -heteroátomo, y los ligandos de P -heteroátomo como los fosfitos y las fosforamiditas generalmente logran resultados más impresionantes. [23] Las clases estructurales de ligandos que han tenido éxito incluyen aquellas basadas en la estructura binaptil de MonoPHOS [24] o el sistema de anillos espiro de SiPHOS. [25] En particular, estos ligandos monodentados se pueden usar en combinación entre sí para lograr una mejora sinérgica en la enantioselectividad; [26] algo que no es posible con los ligandos de difosfina . [23]
Los ligandos de difosfina han recibido mucha más atención que las monofosfinas y, tal vez como consecuencia, tienen una lista de logros mucho más larga. Esta clase incluye el primer ligando que logra una alta selectividad ( DIOP ), el primer ligando que se utiliza en la síntesis asimétrica industrial ( DIPAMP [27] [28] [4] ) y el que probablemente sea el ligando quiral más conocido (BINAP). [3] Los ligandos quirales de difosfina son ahora omnipresentes en la hidrogenación asimétrica.

El uso de ligandos P,N en la hidrogenación asimétrica se remonta al ligando de bisoxazolina simétrico C2 . [29] Sin embargo, estos ligandos simétricos pronto fueron reemplazados por ligandos mono oxazolina cuya falta de simetría C 2 no limita de ninguna manera su eficacia en la catálisis asimétrica. [30] Dichos ligandos generalmente consisten en un heterociclo aquiral que contiene nitrógeno que está funcionalizado con un brazo colgante que contiene fósforo, aunque tanto la naturaleza exacta del heterociclo como el centro de fósforo del entorno químico han variado ampliamente. Ninguna estructura ha resultado consistentemente efectiva con una amplia gama de sustratos, aunque se han establecido ciertas estructuras privilegiadas (como la arquitectura fosfina-oxazolina o PHOX ). [31] [30] [32] Además, dentro de una clase de sustrato estrechamente definida, el rendimiento de los complejos metálicos con ligandos quirales P,N puede acercarse mucho a la conversión y selectividad perfectas en sistemas que de otro modo serían muy difíciles de detectar. [33] Ciertos complejos derivados de ligandos quelantes de PO han mostrado resultados prometedores en la hidrogenación de cetonas y ésteres α,β-insaturados. [34]
Los ligandos simples basados en N -carbeno heterocíclico (NHC) han demostrado ser poco prácticos para la hidrogenación asimétrica.
Algunos ligandos C,N combinan un NHC con una oxazolina quiral para dar un ligando quelante. [35] [36] Los ligandos basados en NHC del primer tipo se han generado como grandes bibliotecas a partir de la reacción de bibliotecas más pequeñas de NHC y oxazolinas individuales. [35] [36] Los catalizadores basados en NHC que presentan un metalociclo voluminoso de siete miembros sobre iridio se han aplicado a la hidrogenación catalítica de olefinas no funcionalizadas [35] y alcoholes de éter vinílico con conversiones y ee en los 80 o 90 altos. [37] El mismo sistema se ha aplicado a la síntesis de varios motivos aldol, [38] dimetilo vecinal [39] y desoxipolicétido [40] , y a los propios desoxipolicétidos. [41]
Los NHC simétricos en C2 han demostrado ser ligandos muy útiles para la hidrogenación asimétrica. [42]
Los sustratos se pueden clasificar según su polaridad. Los sustratos apolares están dominados por los alquenos . Los sustratos polares incluyen cetonas , enaminas , cetiminas .
[43]
Los alquenos que son particularmente susceptibles a la hidrogenación asimétrica a menudo presentan un grupo funcional polar adyacente al sitio a hidrogenar. En ausencia de este grupo funcional, la catálisis a menudo da como resultado ee bajos. Sin embargo , para algunas olefinas no funcionalizadas, el iridio con ligandos basados en P , N ha demostrado ser eficaz. Los sustratos de alqueno se clasifican a menudo según sus sustituyentes, por ejemplo, olefinas 1,1-disustituidas, 1,2-diaril trisustituidas, 1,1,2-trialquil y tetrasustituidas. [44] [45] e incluso dentro de estas clases pueden existir variaciones que hacen que diferentes soluciones sean óptimas. [46]


A la inversa del caso de las olefinas, la hidrogenación asimétrica de enaminas ha favorecido a los ligandos de tipo difosfina; Se han logrado excelentes resultados con sistemas basados en iridio y rodio. Sin embargo, incluso los mejores sistemas suelen sufrir de ee bajos y falta de generalidad. Ciertas enaminas de cetonas aromáticas derivadas de pirrolidina son susceptibles de hidrogenación asimétrica con sistemas catiónicos de fosfonito de rodio (I) y sistemas de ácido acético e I 2 con valores de ee generalmente superiores al 90 % y potencialmente tan altos como el 99,9 %. [47] Un sistema similar que utiliza iridio(I) y un ligando de fosforamidita muy estrechamente relacionado es eficaz para la hidrogenación asimétrica de enaminas de tipo pirrolidina donde el doble enlace estaba dentro del anillo: en otras palabras, de dihidropirroles. [48] En ambos casos, la enantioselectividad disminuyó sustancialmente cuando el tamaño del anillo se aumentó de cinco a seis.

Las cetonas y las iminas son grupos funcionales relacionados, y las tecnologías efectivas para la hidrogenación asimétrica de cada una también están estrechamente relacionadas. Los primeros ejemplos son el sistema rutenio-difosfina-diamina quiral de Noyori. [49] [50]
Para sustratos carbonilo e imina, la coordinación final, η 1 puede competir con el modo η 2 . Para sustratos unidos a η 1 , el carbono que acepta hidrógeno se elimina del catalizador y resiste la hidrogenación. [51]
Los sistemas basados en ligandos de iridio/P,N han sido eficaces para algunas cetonas e iminas. Por ejemplo, un sistema consistente para aril iminas bencílico utiliza el ligando P,N SIPHOX junto con iridio(I) en un complejo catiónico para lograr una hidrogenación asimétrica con ee >90%. [52] Un catalizador eficaz para las cetonas ( número de rotación (TON) de hasta 4.550.000 y ee de hasta 99,9%) es un sistema de iridio(I) con un ligando tridentado estrechamente relacionado . [53]

El catalizador BINAP/diamina-Ru es eficaz para la reducción asimétrica de cetonas simples y funcionalizadas, [54] y el catalizador BINAP/diamina-Ru puede catalizar cetonas aromáticas , heteroaromáticas y olefínicas enantioselectivamente. [55] Se logra una mejor estereoselectividad cuando un sustituyente es más grande que el otro (ver ángulo Flippin-Lodge ).
La hidrogenación asimétrica de sustratos aromáticos (especialmente heteroaromáticos ) es un campo muy activo de investigación en curso. Los catalizadores en este campo deben lidiar con una serie de factores que complican la situación, incluida la tendencia de los compuestos aromáticos altamente estables a resistir la hidrogenación, las capacidades potenciales de coordinación (y por lo tanto de envenenamiento del catalizador) tanto del sustrato como del producto, y la gran diversidad en los patrones de sustitución que puede estar presente en cualquier anillo aromático. [56] De estos sustratos, el éxito más consistente se ha observado con los heterociclos que contienen nitrógeno, donde el anillo aromático a menudo se activa ya sea por protonación o por una mayor funcionalización del nitrógeno (generalmente con un grupo protector aceptor de electrones). Estas estrategias son menos aplicables a los heterociclos que contienen oxígeno y azufre, ya que son menos básicos y menos nucleofílicos; Esta dificultad adicional puede ayudar a explicar por qué existen pocos métodos eficaces para su hidrogenación asimétrica.
Existen dos sistemas para la hidrogenación asimétrica de quinolinas 2-sustituidas con rendimientos aislados generalmente superiores al 80% y valores de ee generalmente superiores al 90%. El primero es un sistema de iridio(I)/fosfina quiral/I 2 , descrito por primera vez por Zhou et al. . [57] Si bien la primera fosfina quiral utilizada en este sistema fue MeOBiPhep, las iteraciones más recientes se han centrado en mejorar el rendimiento de este ligando. Con este fin, los sistemas utilizan fosfinas (o ligandos relacionados) con estabilidad al aire mejorada, [58] reciclabilidad, [58] facilidad de preparación, [59] menor carga de catalizador [60] [61] y el papel potencial de los aditivos de fosfina aquiral. [62] En octubre de 2012 no parece haberse propuesto ningún mecanismo, aunque se han documentado tanto la necesidad de I 2 o un sustituto halógeno como el posible papel del N heteroaromático para ayudar a la reactividad. [56]
El segundo es un sistema de hidrogenación por transferencia organocatalítica basado en ésteres de Hantzsch y un ácido de Brønsted quiral . En este caso, los autores imaginan un mecanismo en el que la isoquinolina se protona alternativamente en un paso de activación y luego se reduce mediante la adición conjugada de hidruro del éster de Hantzsch. [63]
Gran parte de la química de hidrogenación asimétrica de las quinoxalinas está estrechamente relacionada con la de las quinolinas estructuralmente similares . Se pueden obtener resultados efectivos (y eficientes) con un sistema Ir(I)/fofinito/I 2 [64] y un sistema organocatalítico basado en éster de Hantzsh, [65] ambos similares a los sistemas discutidos anteriormente con respecto a las quinolinas. .
Las piridinas son sustratos muy variables para la reducción asimétrica (incluso en comparación con otros heteroaromáticos), en el sentido de que cinco centros de carbono están disponibles para la sustitución diferencial en el anillo inicial. En octubre de 2012, no parece existir ningún método que pueda controlar los cinco, aunque existe al menos un método razonablemente general.
El método más general de hidrogenación asimétrica de piridina es en realidad un método heterogéneo, en el que la asimetría se genera a partir de una oxazolidinona quiral unida a la posición C2 de la piridina. La hidrogenación de dichas piridinas funcionalizadas sobre varios catalizadores metálicos heterogéneos diferentes dio la piperidina correspondiente con los sustituyentes en las posiciones C3, C4 y C5 en una geometría totalmente cis , con alto rendimiento y excelente enantioselectividad. El auxiliar de oxazolidinona también se escinde convenientemente en las condiciones de hidrogenación. [66]

Los métodos diseñados específicamente para la hidrogenación de piridina 2-sustituida pueden implicar sistemas asimétricos desarrollados para sustratos relacionados como quinolinas y quinoxalinas 2-sustituidas. Por ejemplo, un sistema de iridio(I)\fosfina quiral\I 2 es eficaz en la hidrogenación asimétrica de 2-piridinios activados (alquilados) [67] o ciertas piridinas fusionadas con ciclohexanona. [68] De manera similar, la catálisis quiral con ácido de Brønsted con un éster de Hantzsh como fuente de hidruro es eficaz para algunas 2-alquilpiridinas con una sustitución activadora adicional. [69]
Se ha establecido la hidrogenación asimétrica de indoles con protección N -Boc . [70]

Un sistema Pd(TFA) 2 /H8-BINAP logra la cis -hidrogenación enantioselectiva de indoles 2,3- y 2-sustituidos. [71] [72]

De manera similar al comportamiento de los indoles, los pirroles se pueden convertir en pirrolidinas mediante hidrogenación asimétrica. [73]

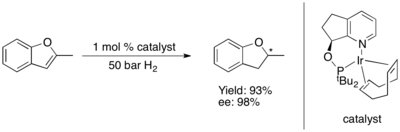
La hidrogenación asimétrica de furanos y benzofuranos supone un desafío. [74]
La hidrogenación asimétrica de tiofenos y benzotiofenos ha sido catalizada por algunos complejos de rutenio (II) de N -carbenos heterocíclicos (NHC). Este sistema parece poseer una selectividad excelente (ee > 90%) y una diastereoselectividad perfecta (todo cis ) si el sustrato tiene un anillo de fenilo fusionado (o directamente unido), pero produce solo producto racémico en todos los demás casos probados. [75]

No se ha comercializado ningún catalizador heterogéneo para la hidrogenación asimétrica.
La primera hidrogenación asimétrica se centró en el paladio depositado sobre un soporte de seda. Los alcaloides de quina se han utilizado como modificadores quirales para la hidrogenación por enantioselectividad. [76]

Una técnica alternativa y que permite un mayor control sobre las propiedades estructurales y electrónicas de los sitios catalíticos activos es la inmovilización de catalizadores que han sido desarrollados para catálisis homogénea sobre un soporte heterogéneo. El enlace covalente del catalizador a un polímero u otro soporte sólido es quizás el más común, aunque la inmovilización del catalizador también se puede lograr mediante adsorción sobre una superficie, intercambio iónico o incluso encapsulación física. Un inconveniente de este enfoque es la posibilidad de que la proximidad del soporte cambie el comportamiento del catalizador, reduciendo la enantioselectividad de la reacción. Para evitar esto, el catalizador suele estar unido al soporte mediante un conector largo, aunque se conocen casos en los que la proximidad del soporte puede mejorar realmente el rendimiento del catalizador. [76]
El enfoque final implica la construcción de MOF que incorporan sitios de reacción quirales de varios componentes diferentes, incluyendo potencialmente ligandos orgánicos quirales y aquirales, iones metálicos estructurales, iones metálicos catalíticamente activos y/o núcleos organometálicos catalíticamente activos preensamblados. [77] Uno de ellos involucraba catalizadores a base de rutenio . Tan solo un 0,005% en moles de tales catalizadores resultó suficiente para lograr la hidrogenación asimétrica de arilcetonas, aunque las condiciones habituales incluían un 0,1% en moles de catalizador y dieron como resultado un exceso enantiomérico de 90,6 a 99,2%. [78]


Las hidrogenaciones asimétricas se utilizan en la producción de varios fármacos, como el antibacteriano levofloxina, el antibiótico carbapenem y el agente antipsicótico BMS181100. [15] [16] [17]
La investigación de Knowles sobre la hidrogenación asimétrica y su aplicación a la síntesis a escala de producción de L-Dopa [4] dio a la hidrogenación asimétrica un fuerte comienzo en el mundo industrial. Una revisión de 2001 indicó que la hidrogenación asimétrica representaba el 50% de la escala de producción, el 90% de la escala piloto y el 74% de los procesos catalíticos y enantioselectivos a escala de laboratorio en la industria, con la salvedad de que los métodos catalíticos asimétricos en general aún no se utilizaban ampliamente. [79]
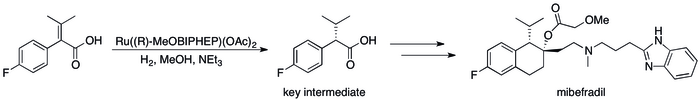
La hidrogenación asimétrica ha reemplazado a los métodos basados en resolución cinética y ha dado como resultado mejoras sustanciales en la eficiencia del proceso. [12] se puede observar en una serie de casos específicos en los que, por ejemplo, el Grupo de Catálisis de Roche pudo lograr la síntesis de ( S , S )-Ro 67-8867 con un rendimiento total del 53%, un aumento espectacular por encima del 3,5%. eso se logró en la síntesis basada en resolución. [80] La síntesis de mibefradil de Roche también mejoró reemplazando la resolución con hidrogenación asimétrica, reduciendo el número de pasos en tres y aumentando el rendimiento de un intermedio clave al 80% desde el 70% original. [81]
Los catalizadores de hidrogenación inspirados en Noyori se han aplicado a la síntesis comercial de varios productos químicos finos. (R)-1,2-Propandiol, precursor del antibacteriano levofloxacino , se puede sintetizar eficientemente a partir de hidroxiacetona mediante hidrogenación asimétrica de Noyori: [17]
Las rutas más nuevas se centran en la hidrogenación del (R) -lactato de metilo . [12]
También se prepara un antibiótico carbapenem mediante hidrogenación asimétrica de Noyori mediante 2-(benzamidometil)-3-hidroxibutanoato de (2S,3R)-metilo, que se sintetiza a partir de 2-(benzamidometil)-3-oxobutanoato de metilo racémico mediante resolución cinética dinámica .
Se sintetiza un agente antipsicótico BMS 181100 utilizando un catalizador BINAP/diamina-Ru.