
La presentación de antígenos es un proceso inmunológico vital que es esencial para desencadenar la respuesta inmune de las células T. Debido a que las células T reconocen sólo antígenos fragmentados que se muestran en las superficies celulares , el procesamiento del antígeno debe ocurrir antes de que un receptor de células T pueda reconocer el fragmento de antígeno . En concreto, el fragmento, unido al complejo mayor de histocompatibilidad (MHC) , es transportado a la superficie de la célula, proceso conocido como presentación. Si ha habido una infección por virus o bacterias, la célula presentará un fragmento peptídico endógeno o exógeno derivado del antígeno por moléculas del MHC. Hay dos tipos de moléculas MHC que se diferencian en el comportamiento de los antígenos: las moléculas MHC de clase I (MHC-I) se unen a péptidos del citosol celular , mientras que los péptidos generados en las vesículas endocíticas después de la internalización se unen a MHC de clase II (MHC- II). [1] Las membranas celulares separan estos dos ambientes celulares: intracelular y extracelular. Cada célula T sólo puede reconocer de decenas a cientos de copias de una secuencia única de un único péptido entre miles de otros péptidos presentados en la misma célula, porque una molécula de MHC en una célula puede unirse a una gama bastante amplia de péptidos. [2] [3] Predecir qué (fragmentos de) antígenos serán presentados al sistema inmunológico por un determinado tipo de MHC/HLA es difícil, pero la tecnología involucrada está mejorando. [4]

Las células T citotóxicas (también conocidas como Tc , células T asesinas o linfocitos T citotóxicos (CTL)) expresan correceptores CD8 y son una población de células T especializadas en inducir la muerte celular programada de otras células. Las células T citotóxicas patrullan regularmente todas las células del cuerpo para mantener la homeostasis del organismo. Siempre que encuentran signos de enfermedad, causados por ejemplo por la presencia de virus o bacterias intracelulares o una célula tumoral transformada, inician procesos para destruir la célula potencialmente dañina. [1] Todas las células nucleadas del cuerpo (junto con las plaquetas ) muestran el complejo mayor de histocompatibilidad de clase I (moléculas MHC-I). Los antígenos generados endógenamente dentro de estas células se unen a moléculas de MHC-I y se presentan en la superficie celular. Esta vía de presentación de antígenos permite al sistema inmunológico detectar células transformadas o infectadas que muestran péptidos de proteínas modificadas (mutadas) o extrañas. [5] [6]
En el proceso de presentación, estas proteínas son principalmente degradadas en pequeños péptidos por proteasas citosólicas en el proteosoma , pero también existen otras vías proteolíticas citoplasmáticas. Luego, los péptidos se distribuyen al retículo endoplásmico (RE) mediante la acción de proteínas de choque térmico y el transportador asociado con el procesamiento de antígenos (TAP), que transloca los péptidos citosólicos a la luz del RE en un mecanismo de transporte dependiente de ATP. Hay varias chaperonas del RE involucradas en el ensamblaje del MHC-I, como calnexina , calreticulina , Erp57, proteína disulfuro isomerasa (PDI), [7] y tapasina . Específicamente, el complejo de TAP, tapasina, MHS Clase 1, ERp57 y calreticulina se denomina complejo de carga de péptidos (PLC). [8] Los péptidos se cargan en el surco de unión del péptido MHC-I entre dos hélices alfa en la parte inferior de los dominios α1 y α2 de la molécula MHC de clase I. Después de liberarse de la tapasina, los complejos péptido-MHC-I (pMHC-I) salen del RE y son transportados a la superficie celular mediante vesículas exocíticas. [9] [10]
Las células T antivirales vírgenes ( CD8+ ) no pueden eliminar directamente las células transformadas o infectadas. Deben ser activados por los complejos pMHC-I de las células presentadoras de antígenos (APC). En este caso, el antígeno se puede presentar directamente (como se describió anteriormente) o indirectamente ( presentación cruzada ) a partir de células infectadas y no infectadas por virus. [11] Después de la interacción entre pMHC-I y TCR, en presencia de señales coestimuladoras y/o citocinas, las células T se activan, migran a los tejidos periféricos y matan las células diana (células infectadas o dañadas) induciendo citotoxicidad . [ cita necesaria ]
La presentación cruzada es un caso especial en el que las moléculas del MHC-I pueden presentar antígenos extracelulares, que normalmente sólo se muestran en las moléculas del MHC-II. Esta capacidad aparece en varias APC, principalmente en células dendríticas plasmocitoides en tejidos que estimulan directamente a las células T CD8+. Este proceso es esencial cuando las APC no están infectadas directamente, lo que desencadena respuestas inmunes antivirales y antitumorales locales inmediatamente sin transportar las APC a los ganglios linfáticos locales. [6]
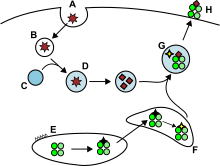
Los antígenos del espacio extracelular y a veces también los endógenos [12] están encerrados en vesículas endocíticas y presentados en la superficie celular por moléculas MHC-II a las células T auxiliares que expresan la molécula CD4 . Sólo las APC, como las células dendríticas , las células B o los macrófagos, expresan moléculas de MHC-II en su superficie en cantidades sustanciales, por lo que la expresión de moléculas de MHC-II es más específica de cada célula que la de MHC-I. [ cita necesaria ]
Las APC suelen internalizar antígenos exógenos mediante endocitosis , pero también mediante pinocitosis , macroautofagia , microautofagia endosómica o autofagia mediada por chaperonas . [12] En el primer caso, después de la internalización, los antígenos quedan encerrados en vesículas llamadas endosomas . Hay tres compartimentos implicados en esta vía de presentación de antígenos: los endosomas tempranos, los endosomas tardíos o endolisosomas y los lisosomas , donde los antígenos son hidrolizados por enzimas asociadas a los lisosomas (hidrolasas ácido-dependientes, glicosidasas, proteasas, lipasas). Este proceso se ve favorecido por la reducción gradual del pH. Las principales proteasas de los endosomas son las catepsinas y el resultado es la degradación de los antígenos en oligopéptidos. [ cita necesaria ]
Las moléculas de MHC-II se transportan desde el RE al compartimento de carga del MHC de clase II junto con la cadena invariante de proteína (Ii, CD74). Una molécula MHC-II no clásica ( HLA-DO y HLA-DM ) cataliza el intercambio de parte del CD74 ( péptido CLIP ) con el antígeno peptídico. Los complejos péptido-MHC-II (pMHC-II) se transportan a la membrana plasmática y el antígeno procesado se presenta a las células T auxiliares en los ganglios linfáticos. [9]
Las APC experimentan un proceso de maduración mientras migran, a través de señales quimiotácticas , a los tejidos linfoides, en los que pierden la capacidad fagocítica y desarrollan una mayor capacidad para comunicarse con las células T mediante la presentación de antígenos. [13] Además de las células T citotóxicas CD8+, las APC necesitan pMHC-II y señales coestimuladoras adicionales para activar completamente las células T auxiliares vírgenes.
"Existe una vía alternativa de procesamiento y presentación de antígenos endógenos sobre moléculas de MHC-II en las células epiteliales del timo medular (mTEC) mediante el proceso de autofagia ". Para el proceso de tolerancia central de las células T es importante, en particular, la selección negativa de clones autorreactivos. La expresión genética aleatoria de todo el genoma se logra mediante la acción de AIRE y la autodigestión de las moléculas expresadas presentadas en las moléculas MHC-I y MHC-II. [ cita necesaria ]
Los receptores de células B en la superficie de las células B se unen a antígenos nativos intactos y no digeridos de naturaleza estructural, en lugar de a una secuencia lineal de un péptido que ha sido digerido en pequeños fragmentos y presentado por moléculas de MHC. Las células dendríticas foliculares presentan grandes complejos de antígeno intacto en los ganglios linfáticos a las células B en forma de complejos inmunes . Por lo tanto, es menos probable que algunas APC que expresan niveles comparativamente más bajos de enzimas lisosomales digieran el antígeno que han capturado antes de presentarlo a las células B. [14] [15]