El iridio es un elemento químico ; tiene símbolo Ir y número atómico 77. Un metal de transición de color blanco plateado muy duro, quebradizo, del grupo del platino , se considera el segundo metal natural más denso (después del osmio ) con una densidad de 22,56 g/cm 3 (0,815 lb/cu in) [7] según lo definido por cristalografía de rayos X experimental . [a] 191 Ir y 193 Ir son los dos únicos isótopos naturales de iridio, así como los únicos isótopos estables ; este último es el más abundante. Es uno de los metales más resistentes a la corrosión , [10] incluso a temperaturas de hasta 2000 °C (3630 °F).
El iridio fue descubierto en 1803 entre las impurezas insolubles del platino natural . Smithson Tennant , el principal descubridor, le puso el nombre de la diosa griega Iris , personificación del arco iris, por los llamativos y diversos colores de sus sales. El iridio es uno de los elementos más raros de la corteza terrestre , con una producción y consumo anual estimado de solo 7,3 toneladas (16 mil libras) en 2018. [11]
Los usos dominantes del iridio son el propio metal y sus aleaciones, como en bujías de alto rendimiento , crisoles para la recristalización de semiconductores a altas temperaturas y electrodos para la producción de cloro en el proceso cloro-álcali . Los compuestos importantes del iridio son los cloruros y los yoduros en la catálisis industrial . El iridio es un componente de algunos OLED .
El iridio se encuentra en los meteoritos en mucha mayor abundancia que en la corteza terrestre. [12] Por esta razón, la abundancia inusualmente alta de iridio en la capa de arcilla en el límite Cretácico-Paleógeno dio lugar a la hipótesis de Álvarez de que el impacto de un objeto extraterrestre masivo causó la extinción de los dinosaurios y muchas otras especies hace 66 millones de años. , ahora se sabe que fue producido por el impacto que formó el cráter Chicxulub . De manera similar, una anomalía de iridio en muestras de núcleos del Océano Pacífico sugirió el impacto de Eltanin hace unos 2,5 millones de años. [13]
Se cree que la cantidad total de iridio en el planeta Tierra es mucho mayor que la observada en las rocas de la corteza terrestre, pero como ocurre con otros metales del grupo del platino, la alta densidad y la tendencia del iridio a unirse con el hierro hicieron que la mayor parte del iridio descendiera por debajo de la superficie. corteza cuando el planeta era joven y todavía estaba fundido.

Miembro del grupo de los metales del platino , el iridio es blanco, parecido al platino , pero con un ligero tono amarillento. Debido a su dureza , fragilidad y punto de fusión muy alto , el iridio sólido es difícil de mecanizar, formar o trabajar; por lo tanto, en su lugar se emplea comúnmente la metalurgia de polvos . [14] Es el único metal que mantiene buenas propiedades mecánicas en el aire a temperaturas superiores a 1.600 °C (2.910 °F). [15] Tiene el décimo punto de ebullición más alto entre todos los elementos y se convierte en un superconductor a temperaturas inferiores a 0,14 K (−273,010 °C; −459,418 °F). [dieciséis]
El módulo de elasticidad del iridio es el segundo más alto entre los metales, siendo superado sólo por el osmio . [15] Esto, junto con un alto módulo de corte y una cifra muy baja para el índice de Poisson (la relación entre la deformación longitudinal y lateral ), indican el alto grado de rigidez y resistencia a la deformación que han hecho que su fabricación en componentes útiles sea una cuestión de gran dificultad. A pesar de estas limitaciones y del alto costo del iridio, se han desarrollado varias aplicaciones donde la resistencia mecánica es un factor esencial en algunas de las condiciones extremadamente severas que se encuentran en la tecnología moderna. [15]
La densidad medida del iridio es sólo ligeramente inferior (aproximadamente un 0,12%) que la del osmio, el metal más denso conocido. [17] [18] Se produjo cierta ambigüedad con respecto a cuál de los dos elementos era más denso, debido al pequeño tamaño de la diferencia en densidad y las dificultades para medirla con precisión, [19] pero, con una mayor precisión en los factores utilizados para calcular la densidad, Los datos cristalográficos de rayos X arrojaron densidades de 22,56 g/cm 3 (0,815 lb/cu in) para iridio y 22,59 g/cm 3 (0,816 lb/cu in) para osmio. [20]
El iridio es extremadamente frágil, hasta el punto de ser difícil de soldar porque la zona afectada por el calor se agrieta, pero se puede hacer más dúctil añadiendo pequeñas cantidades de titanio y circonio (el 0,2% de cada uno aparentemente funciona bien). [21]
La dureza Vickers del platino puro es de 56 HV, mientras que el platino con un 50% de iridio puede alcanzar más de 500 HV. [22] [23]
El iridio es el metal más resistente a la corrosión que se conoce: [24] no es atacado por ácidos , incluido el agua regia . En presencia de oxígeno, reacciona con sales de cianuro . [25] Los oxidantes tradicionales también reaccionan, incluidos los halógenos y el oxígeno [26] a temperaturas más altas. [27] El iridio también reacciona directamente con el azufre a presión atmosférica para producir disulfuro de iridio . [28]
El iridio tiene dos isótopos estables naturales , 191 Ir y 193 Ir, con abundancias naturales del 37,3% y 62,7%, respectivamente. [29] También se han sintetizado al menos 37 radioisótopos , cuyo número de masa oscila entre 164 y 202. 192 Ir , que se encuentra entre los dos isótopos estables, es el radioisótopo más estable, con una vida media de 73,827 días, y encuentra aplicación. en braquiterapia [30] y en radiografía industrial , particularmente para pruebas no destructivas de soldaduras en acero en las industrias de petróleo y gas; Las fuentes de iridio-192 han estado implicadas en varios accidentes radiológicos. Otros tres isótopos tienen vidas medias de al menos un día: 188 Ir, 189 Ir y 190 Ir. [29] Los isótopos con masas inferiores a 191 se desintegran mediante alguna combinación de desintegración β + , desintegración α y (rara) emisión de protones , con la excepción de 189 Ir, que desintegra por captura de electrones . Los isótopos sintéticos más pesados que el 191 se desintegran mediante desintegración β , aunque el 192 Ir también tiene una ruta de desintegración por captura de electrones menor. [29] Todos los isótopos conocidos de iridio se descubrieron entre 1934 y 2008, siendo los descubrimientos más recientes 200-202 Ir. [31]
Se han caracterizado al menos 32 isómeros metaestables , cuyo número de masa oscila entre 164 y 197. El más estable de ellos es el Ir de 192 m2 , que se desintegra mediante transición isomérica con una vida media de 241 años, [29] lo que lo hace más estable que cualquier otro. de los isótopos sintéticos del iridio en sus estados fundamentales. El isómero menos estable es el 190 m3 Ir con una vida media de sólo 2 μs. [29] El isótopo 191 Ir fue el primero de cualquier elemento en demostrar que presenta un efecto Mössbauer . Esto lo hace útil para la espectroscopia de Mössbauer en investigaciones en física, química, bioquímica, metalurgia y mineralogía. [32]
El iridio forma compuestos en estados de oxidación entre −3 y +9, pero los estados de oxidación más comunes son +1, +2, +3 y +4. [14] Los compuestos bien caracterizados que contienen iridio en el estado de oxidación +6 incluyen IrF 6 y los óxidos Sr 2 MgIrO 6 y Sr 2 CaIrO 6 . [14] [33] Se generó óxido de iridio (VIII) ( IrO 4 ) en condiciones de aislamiento de matriz a 6 K en argón . [34] El estado de oxidación más alto (+9), que también es el más alto registrado para cualquier elemento, se encuentra en el [IrO 4 ] + gaseoso . [3]
El iridio no forma hidruros binarios . Sólo un óxido binario está bien caracterizado: dióxido de iridio , IrO
2. Es un sólido negro azulado que adopta la estructura de fluorita . [14] Un sesquióxido , Ir
2oh
3, se ha descrito como un polvo negro azulado, que se oxida a IrO
2por HNO
3. [26] Se conocen los correspondientes disulfuros, diselenuros, sesquisulfuros y sesquiselenuros, así como el IrS.
3. [14]
Trihaluros binarios, IrX
3, son conocidos por todos los halógenos. [14] Para los estados de oxidación +4 y superiores, sólo se conocen el tetrafluoruro , el pentafluoruro y el hexafluoruro . [14] Hexafluoruro de iridio, IrF
6, es un sólido amarillo volátil, compuesto de moléculas octaédricas. Se descompone en agua y se reduce a IrF.
4. [14] El pentafluoruro de iridio también es un oxidante fuerte, pero es un tetrámero , Ir
4F
20, formado por cuatro octaedros que comparten esquinas. [14]
x.jpg/440px-IrCl3(aq)x.jpg)
Iridium tiene una extensa química de coordinación .
El iridio en sus complejos es siempre de bajo espín . Ir(III) e Ir(IV) generalmente forman complejos octaédricos . [14] Los complejos de polihidruro son conocidos por los estados de oxidación +5 y +3. [35] Un ejemplo es IrH 5 (P i Pr 3 ) 2 . [36] El hidruro ternario Mg
6ir
2h
11Se cree que contiene tanto el IrH4-5
_y el IrH de 18 electrones5-4
_anión. [37]
El iridio también forma oxianiones con estados de oxidación +4 y +5. k
2IrO
3y KIRO
3Se puede preparar a partir de la reacción de óxido de potasio o superóxido de potasio con iridio a altas temperaturas. Estos sólidos no son solubles en disolventes convencionales. [38]
Al igual que muchos elementos, el iridio forma importantes complejos de cloruros. Ácido hexacloroirídico (IV), H
2IrCl
6y su sal de amonio son los compuestos de iridio más comunes desde la perspectiva industrial y preparativa. [39] Son intermediarios en la purificación de iridio y se utilizan como precursores de la mayoría de los demás compuestos de iridio, así como en la preparación de revestimientos anódicos . El IrCl2-6
_El ion tiene un color marrón oscuro intenso y se puede reducir fácilmente al IrCl de color más claro.3-6
_y viceversa. [39] Tricloruro de iridio , IrCl
3, que se puede obtener en forma anhidra a partir de la oxidación directa del polvo de iridio con cloro a 650 °C, [39] o en forma hidratada disolviendo Ir
2oh
3En ácido clorhídrico , se utiliza a menudo como material de partida para la síntesis de otros compuestos de Ir (III). [14] Otro compuesto utilizado como material de partida es el hexacloroiridato de amonio (III), (NH
4)
3IrCl
6. [ cita necesaria ]
En presencia de aire, el metal iridio se disuelve en cianuros de metales alcalinos fundidos para producir Ir (CN).3-6
_(hexacianoiridato) y tras la oxidación produce el óxido más estable. [ cita necesaria ]

Los compuestos de organoiridio contienen enlaces iridio- carbono . Los primeros estudios identificaron el muy estable tetrairidio dodecacarbonilo , Ir
4(CO)
12. [14] En este compuesto, cada uno de los átomos de iridio está unido a los otros tres, formando un grupo tetraédrico. El descubrimiento del complejo de Vaska ( IrCl(CO)[P(C
6h
5)
3]
2) abrió la puerta a las reacciones de adición oxidativa , un proceso fundamental para las reacciones útiles. Por ejemplo, el catalizador de Crabtree , un catalizador homogéneo para reacciones de hidrogenación . [40] [41]

Los complejos de iridio desempeñaron un papel fundamental en el desarrollo de la activación del enlace carbono-hidrógeno (activación C-H), que promete permitir la funcionalización de los hidrocarburos, que tradicionalmente se consideran no reactivos. [44]

El descubrimiento del iridio está entrelazado con el del platino y los demás metales del grupo del platino. La primera referencia europea al platino aparece en 1557 en los escritos del humanista italiano Julio César Scaliger como descripción de un metal noble desconocido encontrado entre Darién y México, "que ningún fuego ni ningún artificio español ha podido todavía licuar". [45] Desde sus primeros encuentros con el platino, los españoles generalmente vieron el metal como una especie de impureza del oro, y fue tratado como tal. A menudo simplemente se desechaba y existía un decreto oficial que prohibía la adulteración del oro con impurezas de platino. [46]


En 1735, Antonio de Ulloa y Jorge Juan y Santacilia vieron a los nativos americanos extrayendo platino mientras los españoles viajaban por Colombia y Perú durante ocho años. Ulloa y Juan encontraron minas con pepitas de metal blanquecino y se las llevaron a España. Antonio de Ulloa regresó a España y estableció el primer laboratorio de mineralogía en España y fue el primero en estudiar sistemáticamente el platino, lo cual fue en 1748. Su relato histórico de la expedición incluyó una descripción del platino como no separable ni calcinable . Ulloa también anticipó el descubrimiento de minas de platino. Tras publicar el informe en 1748, Ulloa no continuó investigando el nuevo metal. En 1758, fue enviado a supervisar las operaciones mineras de mercurio en Huancavelica . [45]
En 1741, Charles Wood, [47] un metalúrgico británico , encontró varias muestras de platino colombiano en Jamaica, que envió a William Brownrigg para una mayor investigación.
En 1750, después de estudiar el platino que le envió Wood, Brownrigg presentó una descripción detallada del metal a la Royal Society , afirmando que no había visto ninguna mención del mismo en ningún relato anterior de minerales conocidos. [48] Brownrigg también tomó nota del punto de fusión extremadamente alto del platino y del comportamiento similar al de un metal refractario hacia el bórax . Otros químicos de toda Europa pronto comenzaron a estudiar el platino, incluidos Andreas Sigismund Marggraf , [49] Torbern Bergman , Jöns Jakob Berzelius , William Lewis y Pierre Macquer . En 1752, Henrik Scheffer publicó una descripción científica detallada del metal, al que llamó "oro blanco", y explicó cómo logró fundir el mineral de platino con ayuda de arsénico . Scheffer describió el platino como menos flexible que el oro, pero con una resistencia similar a la corrosión. [45]
Los químicos que estudiaron el platino lo disolvieron en agua regia (una mezcla de ácidos clorhídrico y nítrico ) para crear sales solubles. Siempre observaron una pequeña cantidad de un residuo oscuro e insoluble. [15] Joseph Louis Proust pensó que el residuo era grafito . [15] Los químicos franceses Victor Collet-Descotils , Antoine François, conde de Fourcroy , y Louis Nicolas Vauquelin también observaron el residuo negro en 1803, pero no obtuvieron suficiente para realizar más experimentos. [15]
En 1803, el científico británico Smithson Tennant (1761-1815) analizó el residuo insoluble y concluyó que debía contener un metal nuevo. Vauquelin trató el polvo alternativamente con álcalis y ácidos [24] y obtuvo un nuevo óxido volátil, que creía que era de este nuevo metal, al que llamó pteno , de la palabra griega πτηνός ptēnós , "alado". [50] [51] Tennant, que tenía la ventaja de una cantidad mucho mayor de residuos, continuó su investigación e identificó los dos elementos no descubiertos previamente en el residuo negro, iridio y osmio. [15] [24] Obtuvo cristales de color rojo oscuro (probablemente de Na
2[IrCl
6] · nH
2O ) por una secuencia de reacciones con hidróxido de sodio y ácido clorhídrico . [51] Llamó a iridio en honor a Iris ( Ἶρις ), la diosa griega alada del arco iris y mensajera de los dioses olímpicos, porque muchas de las sales que obtuvo tenían colores fuertes. [c] [52] El descubrimiento de los nuevos elementos se documentó en una carta a la Royal Society el 21 de junio de 1804. [15] [53]
El científico británico John George Children fue el primero en fundir una muestra de iridio en 1813 con la ayuda de "la batería galvánica más grande jamás construida" (en ese momento). [15] El primero en obtener iridio de alta pureza fue Robert Hare en 1842. Descubrió que tenía una densidad de alrededor de 21,8 g/cm 3 (0,79 lb/cu in) y observó que el metal es casi inmaleable y muy duro. La primera fusión en cantidad apreciable fue realizada por Henri Sainte-Claire Deville y Jules Henri Debray en 1860. Requirieron quemar más de 300 litros (79 gal EE.UU.) de O puro.
2y h
2gas por cada 1 kilogramo (2,2 libras) de iridio. [15]
Estas dificultades extremas para fundir el metal limitaron las posibilidades de manipular el iridio. John Isaac Hawkins buscaba obtener una punta fina y dura para las plumas de las estilográficas, y en 1834 logró crear una pluma de oro con punta de iridio. En 1880, John Holland y William Lofland Dudley pudieron fundir iridio añadiendo fósforo y patentaron el proceso en los Estados Unidos; La empresa británica Johnson Matthey afirmó más tarde que utilizaba un proceso similar desde 1837 y que ya había presentado iridio fundido en varias ferias mundiales . [15] El primer uso de una aleación de iridio con rutenio en termopares fue realizado por Otto Feussner en 1933. Estos permitieron medir altas temperaturas en el aire hasta 2000 °C (3630 °F). [15]
En Munich, Alemania, en 1957 Rudolf Mössbauer , en lo que se ha llamado uno de los "experimentos emblemáticos de la física del siglo XX", [54] descubrió la emisión y absorción resonantes y sin retroceso de rayos gamma por átomos en una muestra de metal sólido. que contiene sólo 191 Ir. [55] Este fenómeno, conocido como efecto Mössbauer, le valió el Premio Nobel de Física en 1961, a la edad de 32 años, apenas tres años después de publicar su descubrimiento. [56]
Al igual que todos los elementos con pesos atómicos superiores al hierro , el iridio sólo se forma de forma natural mediante el proceso r (captura rápida de neutrones) en supernovas y fusiones de estrellas de neutrones . [57] [58]
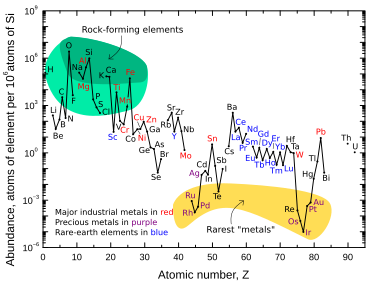

El iridio es uno de los nueve elementos estables menos abundantes en la corteza terrestre y tiene una fracción de masa promedio de 0,001 ppm en la roca de la corteza terrestre; el platino es 10 veces más abundante, el oro es 40 veces más abundante y la plata y el mercurio son 80 veces más abundantes. [14] El telurio es casi tan abundante como el iridio. [14] En contraste con su baja abundancia en la roca de la corteza terrestre, el iridio es relativamente común en los meteoritos , con concentraciones de 0,5 ppm o más. [60] Se cree que la concentración general de iridio en la Tierra es mucho mayor que la que se observa en las rocas de la corteza terrestre, pero debido a la densidad y el carácter siderófilo ("amante del hierro") del iridio, descendió por debajo de la corteza y hacia la Tierra. núcleo cuando el planeta todavía estaba fundido. [39]
El iridio se encuentra en la naturaleza como elemento no combinado o en aleaciones naturales , especialmente las aleaciones de iridio-osmio osmiridio (rico en osmio) e iridosmio (rico en iridio). [24] En los depósitos de níquel y cobre , los metales del grupo del platino se presentan como sulfuros , telururos , antimonuros y arseniuros . En todos estos compuestos, el platino se puede intercambiar con una pequeña cantidad de iridio u osmio. Como ocurre con todos los metales del grupo del platino, el iridio se puede encontrar de forma natural en aleaciones con níquel en bruto o cobre en bruto . [61] Se conocen varios minerales con predominio de iridio, siendo el iridio el elemento formador de especies. Son extremadamente raros y a menudo representan análogos de iridio de los mencionados anteriormente. Los ejemplos son la irarsita y la cuproiridsita, por mencionar algunos. [62] [63] [64] Dentro de la corteza terrestre, el iridio se encuentra en concentraciones más altas en tres tipos de estructuras geológicas: depósitos ígneos (intrusiones de la corteza desde abajo), cráteres de impacto y depósitos reelaborados a partir de una de las estructuras anteriores. Las reservas primarias más grandes conocidas se encuentran en el complejo ígneo de Bushveld en Sudáfrica , [65] (cerca de la estructura de impacto más grande conocida, la estructura de impacto de Vredefort ), aunque los grandes depósitos de cobre y níquel cerca de Norilsk en Rusia , y la cuenca de Sudbury (también una cráter de impacto) en Canadá también son fuentes importantes de iridio. En Estados Unidos se encuentran reservas más pequeñas. [65] El iridio también se encuentra en depósitos secundarios, combinado con platino y otros metales del grupo del platino en depósitos aluviales . Los depósitos aluviales utilizados por los pueblos precolombinos en el departamento de Chocó de Colombia siguen siendo una fuente de metales del grupo del platino. Hasta 2003, no se han estimado las reservas mundiales. [24]
El iridio se encuentra en los organismos marinos, los sedimentos y la columna de agua. La abundancia de iridio en el agua de mar [66] y en los organismos [67] es relativamente baja, ya que no forma fácilmente complejos de cloruro . [67] La abundancia en los organismos es de aproximadamente 20 partes por billón, o alrededor de cinco órdenes de magnitud menos que en las rocas sedimentarias en el límite Cretácico-Paleógeno (K-T) . [67] La concentración de iridio en el agua de mar y los sedimentos marinos es sensible a la oxigenación marina , la temperatura del agua de mar y diversos procesos geológicos y biológicos. [68]
El iridio en los sedimentos puede provenir del polvo cósmico , volcanes, precipitaciones del agua de mar, procesos microbianos o respiraderos hidrotermales , [68] y su abundancia puede ser un fuerte indicativo de la fuente. [69] [68] Tiende a asociarse con otros metales ferrosos en nódulos de manganeso . [66] El iridio es uno de los elementos característicos de las rocas extraterrestres y, junto con el osmio, puede utilizarse como elemento trazador de material meteorítico en los sedimentos. [70] [71] Por ejemplo, muestras de núcleos del Océano Pacífico con niveles elevados de iridio sugirieron el impacto de Eltanin de hace aproximadamente 2,5 millones de años. [13]
Algunas de las extinciones masivas , como la extinción del Cretácico , pueden identificarse por concentraciones anormalmente altas de iridio en los sedimentos, y éstas pueden vincularse a importantes impactos de asteroides . [72]

El límite Cretácico-Paleógeno de hace 66 millones de años, que marca el límite temporal entre los períodos geológicos Cretácico y Paleógeno , fue identificado por un delgado estrato de arcilla rica en iridio . [73] Un equipo dirigido por Luis Álvarez propuso en 1980 un origen extraterrestre para este iridio, atribuyéndolo al impacto de un asteroide o un cometa . [73] Su teoría, conocida como la hipótesis de Álvarez , ahora es ampliamente aceptada para explicar la extinción de los dinosaurios no aviares . Posteriormente se identificó una gran estructura de cráter de impacto enterrada con una edad estimada de unos 66 millones de años bajo lo que hoy es la Península de Yucatán (el cráter Chicxulub ). [74] [75] Dewey M. McLean y otros sostienen que el iridio puede haber sido de origen volcánico , porque el núcleo de la Tierra es rico en iridio y volcanes activos como el Piton de la Fournaise , en la isla de Reunión , todavía están liberando iridio. [76] [77]
La producción mundial de iridio fue de aproximadamente 7.300 kilogramos (16.100 libras) en 2018. [11] El precio es alto y variable (ver tabla). Los factores ilustrativos que afectan el precio incluyen el exceso de oferta de crisoles de Ir [78] [79] y los cambios en la tecnología LED . [80]
Los metales de platino se encuentran juntos como minerales diluidos. El iridio es uno de los metales del platino más raros: por cada 190 toneladas de platino obtenidas de minerales, sólo se aíslan 7,5 toneladas de iridio. [81] Para separar los metales, primero deben ponerse en solución . Dos métodos para hacer solubles los minerales que contienen Ir son (i) fusión del sólido con peróxido de sodio seguida de extracción del vidrio resultante en agua regia y (ii) extracción del sólido con una mezcla de cloro con ácido clorhídrico . [39] [65] De los extractos solubles, el iridio se separa precipitando hexacloroiridato de amonio sólido ( (NH
4)
2IrCl
6) o extrayendo IrCl2-6
_con aminas orgánicas. [82] El primer método es similar al procedimiento que Tennant y Wollaston utilizaron para su separación original. El segundo método puede planificarse como extracción continua líquido-líquido y, por lo tanto, es más adecuado para la producción a escala industrial. En cualquier caso, el producto, una sal de cloruro de iridio, se reduce con hidrógeno, produciendo el metal en forma de polvo o esponja , que es susceptible de técnicas de pulvimetalurgia . [83] [84] El iridio también se obtiene comercialmente como subproducto de la minería y el procesamiento de níquel y cobre . Durante el electrorrefinado de cobre y níquel, metales nobles como la plata, el oro y los metales del grupo del platino, así como el selenio y el telurio , se depositan en el fondo de la celda como lodo anódico , que constituye el punto de partida para su extracción. [78]
Debido a la resistencia del iridio a la corrosión, tiene aplicaciones industriales. Los principales campos de aplicación son electrodos para la producción de cloro y otros productos corrosivos, OLED , crisoles, catalizadores (p. ej. ácido acético ) y puntas de encendido para bujías. [81]
La resistencia al calor y la corrosión son las bases de varios usos del iridio y sus aleaciones.
Debido a su alto punto de fusión, dureza y resistencia a la corrosión , el iridio se utiliza para fabricar crisoles. Estos crisoles se utilizan en el proceso de Czochralski para producir monocristales de óxido (como los zafiros ) para su uso en dispositivos de memoria de computadoras y en láseres de estado sólido. [86] [87] Los cristales, como el granate de gadolinio y galio y el granate de itrio y galio, se cultivan fundiendo cargas presinterizadas de óxidos mixtos en condiciones oxidantes a temperaturas de hasta 2100 °C (3810 °F). [15]
Ciertas piezas de motores de aviones de larga duración están hechas de una aleación de iridio, y se utiliza una aleación de iridio- titanio para tuberías de aguas profundas debido a su resistencia a la corrosión. [24] El iridio se utiliza para hileras de poros múltiples , a través de las cuales se extruye un polímero plástico fundido para formar fibras, como el rayón . [88] El osmio-iridio se utiliza para los rumbos de las brújulas y para las balanzas. [15]
Debido a su resistencia a la erosión del arco, algunos fabricantes utilizan aleaciones de iridio para contactos eléctricos de bujías , [86] [89] y las bujías a base de iridio se utilizan particularmente en la aviación.
Los compuestos de iridio se utilizan como catalizadores en el proceso Cativa para la carbonilación de metanol para producir ácido acético . [90] [91]
Los complejos de iridio suelen ser activos tanto para la hidrogenación asimétrica como para la hidrogenación tradicional . [92] y hidrogenación por transferencia . [93] Esta propiedad es la base de la ruta industrial hacia el herbicida quiral (S)-metolaclor. Tal como lo practica Syngenta en la escala de 10.000 toneladas/año, el complejo [[ [Ir(COD)Cl] 2 en presencia de ligandos de Josiphos . [94]
El radioisótopo iridio-192 es una de las dos fuentes de energía más importantes para su uso en radiografía γ industrial para ensayos no destructivos de metales . [95] [96] Además,192
ir
Se utiliza como fuente de radiación gamma para el tratamiento del cáncer mediante braquiterapia , una forma de radioterapia en la que se coloca una fuente radiactiva sellada dentro o junto al área que requiere tratamiento. Los tratamientos específicos incluyen braquiterapia de próstata de alta dosis, braquiterapia de vías biliares y braquiterapia intracavitaria del cuello uterino. [24] El iridio-192 normalmente se produce mediante la activación neutrónica del isótopo iridio-191 en el iridio metálico de abundancia natural. [97]
Los complejos de iridio son componentes clave de los OLED blancos . En fotocatálisis se utilizan complejos similares . [98]

En 1889 se utilizó una aleación de 90% de platino y 10% de iridio para construir el prototipo internacional de metro y kilogramo de masa, conservado por la Oficina Internacional de Pesas y Medidas cerca de París . [24] La barra del metro fue reemplazada como definición de unidad fundamental de longitud en 1960 por una línea en el espectro atómico del criptón , [d] [99] pero el prototipo del kilogramo siguió siendo el estándar internacional de masa hasta el 20 de mayo de 2019 . cuando el kilogramo fue redefinido en términos de la constante de Planck . [100]

Se utilizaron aleaciones de iridio-osmio en las puntas de las plumas estilográficas . El primer uso importante del iridio fue en 1834 en puntas montadas en oro. [15] Desde 1944, la famosa pluma estilográfica Parker 51 estaba equipada con una punta rematada en una aleación de rutenio e iridio (con un 3,8% de iridio). El material de la punta de las plumas estilográficas modernas todavía se llama convencionalmente "iridio", aunque rara vez contiene iridio; otros metales como el rutenio , el osmio y el tungsteno han tomado su lugar. [101]
Se utilizó una aleación de iridio y platino para los orificios de contacto o las piezas de ventilación de los cañones . Según un informe de la Exposición de París de 1867 , una de las piezas expuestas por Johnson y Matthey "ha sido utilizada en un arma Whitworth durante más de 3000 disparos y apenas muestra signos de desgaste todavía. Quienes conocen los constantes problemas y Los gastos que ocasiona el desgaste de las bocas de ventilación de los cañones cuando están en servicio activo, agradecerán esta importante adaptación". [102]
El pigmento negro de iridio , que se compone de iridio muy finamente dividido, se utiliza para pintar porcelana de un negro intenso; Se dijo que "todos los demás colores negros de porcelana aparecen grises al lado". [103]
El iridio en forma metálica a granel no es biológicamente importante ni peligroso para la salud debido a su falta de reactividad con los tejidos; sólo hay unas 20 partes por billón de iridio en el tejido humano. [24] Como la mayoría de los metales, el polvo de iridio finamente dividido puede ser peligroso de manipular, ya que es irritante y puede encenderse en el aire. [65] En 2015 se sabe muy poco sobre la toxicidad de los compuestos de iridio, [104] principalmente porque se usa tan raramente que pocas personas entran en contacto con él y quienes lo hacen solo con cantidades muy pequeñas. Sin embargo, las sales solubles, como los haluros de iridio, podrían ser peligrosas debido a elementos distintos del iridio o al propio iridio. [30] Al mismo tiempo, la mayoría de los compuestos de iridio son insolubles, lo que dificulta la absorción en el cuerpo. [24]
Un radioisótopo de iridio,192
Ir , es peligroso, como otros isótopos radiactivos. Las únicas lesiones notificadas relacionadas con el iridio se refieren a la exposición accidental a la radiación de192
Se utiliza en braquiterapia . [30] Radiación gamma de alta energía procedente de192
Ir puede aumentar el riesgo de cáncer. La exposición externa puede provocar quemaduras, envenenamiento por radiación y la muerte. La ingestión de 192 Ir puede quemar las paredes del estómago y los intestinos. [105] 192 Ir, 192 m Ir y 194 m Ir tienden a depositarse en el hígado y pueden presentar riesgos para la salud debido a la radiación gamma y beta . [60]