



La química del organoiridio es la química de los compuestos organometálicos que contienen un enlace químico iridio - carbono . [2] Los compuestos de organoiridio son relevantes para muchos procesos importantes, incluida la hidrogenación de olefinas y la síntesis industrial de ácido acético. También son de gran interés académico debido a la diversidad de las reacciones y su relevancia para la síntesis de productos químicos finos. [3]
Los compuestos de organoiridio comparten muchas características con los del rodio, pero menos con los del cobalto. El iridio puede existir en estados de oxidación de -III a +V, pero el iridio(I) y el iridio(III) son los más comunes. Los compuestos de iridio(I) (configuración d 8 ) suelen presentarse con geometrías bipiramidales trigonales o planares cuadradas, mientras que los compuestos de iridio(III) (configuración d 6 ) suelen tener una geometría octaédrica. [3]
Los complejos de iridio(0) son carbonilos binarios, siendo el miembro principal el dodecacarbonilo de tetrairidio , Ir 4 (CO) 12 . A diferencia del Rh 4 (CO) 12 relacionado , todos los ligandos CO son terminales en Ir 4 (CO) 12 , análogo a la diferencia entre Fe 3 (CO) 12 y Ru 3 (CO) 12 . [4]
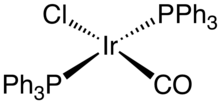
Un ejemplo bien conocido es el complejo de Vaska , el cloruro de carbonilo de bis(trifenilfosfina)iridio. Aunque los complejos de iridio(I) suelen ser catalizadores homogéneos útiles , el complejo de Vaska no lo es. Más bien, es emblemático por la diversidad de sus reacciones. Otros complejos comunes incluyen Ir2Cl2 ( ciclooctadieno ) 2 , dímero de clorobis(cicloocteno)iridio . El análogo del catalizador de Wilkinson , IrCl(PPh3 ) 3 , sufre ortometalación:
Esta diferencia entre RhCl(PPh 3 ) 3 e IrCl(PPh 3 ) 3 refleja la tendencia generalmente mayor del iridio a sufrir adición oxidativa . RhCl(CO)(PPh 3 ) 2 e IrCl(CO)(PPh 3 ) 2 exhiben una tendencia similar , solo que el último agrega oxidativamente O 2 y H 2 . [5] Los complejos de olefina dímero de clorobis(cicloocteno)iridio y dímero de cloruro de ciclooctadieno-iridio se utilizan a menudo como fuentes de "IrCl", explotando la labilidad de los ligandos de alqueno o su susceptibilidad a la eliminación por hidrogenación. El catalizador de Crabtree ([Ir(P(C 6 H 11 ) 3 )(piridina)(ciclooctadieno)]PF 6 ) es un catalizador homogéneo versátil para la hidrogenación de alquenos. [6]
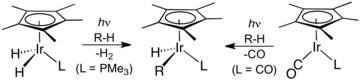
(η 5 - Cp )Ir(CO) 2 agrega oxidativamente enlaces CH tras la disociación fotolítica de un ligando CO.
Al igual que el rodio (II), el iridio (II) se encuentra raramente. Un ejemplo es el iridoceno, IrCp 2 . [7] Al igual que el rodoceno , el iridoceno dimeriza a temperatura ambiente. [8]
El iridio se suele suministrar comercialmente en los estados de oxidación Ir(III) e Ir(IV). Los reactivos de partida importantes son el tricloruro de iridio hidratado y el hexacloroiridato de amonio . Estas sales se reducen tras el tratamiento con CO, hidrógeno y alquenos. Un ejemplo es la carbonilación del tricloruro: IrCl 3 (H 2 O) x + 3 CO → [Ir(CO) 2 Cl 2 ] − + CO 2 + 2 H + + Cl − + (x-1) H 2 O
Muchos compuestos de organoiridio (III) se generan a partir del dímero de dicloruro de pentametilciclopentadienil iridio . Muchos de los derivados presentan ligandos ciclometalados cinéticamente inertes. [9] Los complejos de semisándwich relacionados fueron fundamentales en el desarrollo de la activación de CH . [10] [11]
Los estados de oxidación superiores a III son más comunes en el iridio que en el rodio. Por lo general, presentan ligandos de campo fuerte. Un ejemplo que se cita con frecuencia es el oxotrimesitirilidio(V). [12]
La aplicación dominante de los complejos de organoiridio es como catalizador en el proceso Cativa para la carbonilación de metanol para producir ácido acético . [13]

Los complejos de iridio , como los derivados ciclometalados de 2-fenilpiridinas, se utilizan como diodos emisores de luz orgánicos fosforescentes . [14] Los complejos relacionados son los catalizadores fotorredox .
Los complejos de iridio son muy activos para la hidrogenación tanto directa como por hidrogenación por transferencia . Las versiones asimétricas de estas reacciones han sido ampliamente estudiadas.
Se han investigado muchos complejos de medio sándwich como posibles fármacos contra el cáncer. Los complejos relacionados son electrocatalizadores para la conversión de dióxido de carbono en formato. [9] [15] En los laboratorios académicos, los complejos de iridio se estudian ampliamente porque sus complejos promueven la activación de CH , pero dichas reacciones no se emplean en ningún proceso comercial.