El polonio es un elemento químico de símbolo Po y número atómico 84. El polonio es un metal raro y altamente radiactivo (aunque a veces clasificado como metaloide ) sin isótopos estables, es un calcógeno y químicamente similar al selenio y al telurio , aunque su carácter metálico se asemeja al de sus vecinos horizontales en la tabla periódica : talio , plomo y bismuto . Debido a la corta vida media de todos sus isótopos, su presencia natural se limita a pequeñas trazas del fugaz polonio-210 (con una vida media de 138 días) en los minerales de uranio , ya que es el penúltimo hijo del uranio-238 natural . Aunque existen isótopos de vida más larga, como el polonio-209 con una vida media de 124 años, son mucho más difíciles de producir. Hoy en día, el polonio se produce generalmente en cantidades de miligramos mediante la irradiación neutrónica del bismuto . Debido a su intensa radiactividad, que produce radiólisis de enlaces químicos y autocalentamiento radiactivo, su química se ha investigado mayoritariamente sólo a escala traza.
El polonio fue descubierto el 18 de julio de 1898 por Marie Skłodowska-Curie y Pierre Curie , cuando se extrajo del mineral de uranio pechblenda [4] e identificado únicamente por su fuerte radiactividad: fue el primer elemento en ser descubierto de esta manera. [5] El polonio recibió su nombre de la patria de Marie Skłodowska Curie, Polonia, que en ese momento estaba dividida entre tres países. El polonio tiene pocas aplicaciones, y están relacionadas con su radiactividad: calentadores en sondas espaciales , dispositivos antiestáticos , fuentes de neutrones y partículas alfa y veneno , por ejemplo, envenenamiento de Alexander Litvinenko . Es extremadamente peligroso para los humanos.
El 210 Po es un emisor alfa que tiene una vida media de 138,4 días; se desintegra directamente en su isótopo hijo estable , el 206 Pb . Un miligramo (5 curies ) de 210 Po emite aproximadamente tantas partículas alfa por segundo como 5 gramos de 226 Ra , [6] lo que significa que es 5.000 veces más radiactivo que el radio. Unos pocos curies (1 curie equivale a 37 gigabecquerelios , 1 Ci = 37 GBq) de 210 Po emiten un brillo azul causado por la ionización del aire circundante.
Aproximadamente una de cada 100.000 emisiones alfa provoca una excitación en el núcleo que luego resulta en la emisión de un rayo gamma con una energía máxima de 803 keV. [7] [8]
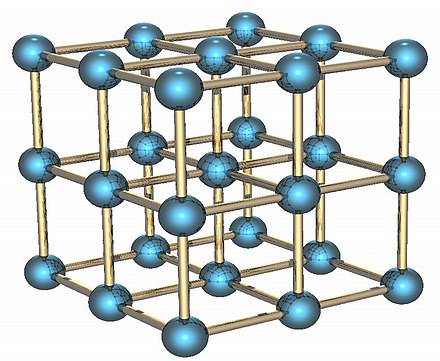
El polonio es un elemento radiactivo que existe en dos alótropos metálicos . La forma alfa es el único ejemplo conocido de una estructura cristalina cúbica simple en una base de un solo átomo en condiciones normales ( grupo espacial Pm 3 m, n.º 221). La celda unitaria tiene una longitud de arista de 335,2 picómetros ; la forma beta es romboédrica . [9] [10] [11] La estructura del polonio se ha caracterizado por difracción de rayos X [12] [13] y difracción de electrones . [14]
El 210 Po tiene la capacidad de volverse fácilmente transportado por el aire : si una muestra se calienta en el aire a 55 °C (131 °F), el 50% de ella se vaporiza en 45 horas para formar moléculas diatómicas de Po 2 , a pesar de que el punto de fusión del polonio es de 254 °C (489 °F) y su punto de ebullición es de 962 °C (1764 °F). [15] [16] [1] Existe más de una hipótesis sobre cómo el polonio hace esto; una sugerencia es que pequeños grupos de átomos de polonio se desprenden por la desintegración alfa. [17]
La química del polonio es similar a la del telurio , aunque también muestra algunas similitudes con su vecino bismuto debido a su carácter metálico. El polonio se disuelve fácilmente en ácidos diluidos pero es solo ligeramente soluble en álcalis . Las soluciones de polonio primero se colorean de rosa por los iones Po 2+ , pero luego se vuelven rápidamente amarillas porque la radiación alfa del polonio ioniza el solvente y convierte Po 2+ en Po 4+ . Como el polonio también emite partículas alfa después de la desintegración, este proceso está acompañado de burbujeo y emisión de calor y luz por el material de vidrio debido a las partículas alfa absorbidas; como resultado, las soluciones de polonio son volátiles y se evaporarán en cuestión de días a menos que estén selladas. [18] [19] A un pH de aproximadamente 1, los iones de polonio se hidrolizan y complejan fácilmente con ácidos como el ácido oxálico , el ácido cítrico y el ácido tartárico . [20]
El polonio no tiene compuestos comunes, y casi todos sus compuestos se crean sintéticamente; se conocen más de 50 de ellos. [ 21] La clase más estable de compuestos de polonio son los polonuros , que se preparan por reacción directa de dos elementos. Na2Po tiene la estructura de antifluorito , los polonuros de Ca , Ba, Hg, Pb y los lantánidos forman una red de NaCl, BePo y CdPo tienen la estructura de wurtzita y MgPo la estructura de arseniuro de níquel . La mayoría de los polonuros se descomponen al calentarlos a unos 600 °C, excepto el HgPo que se descompone a ~300 °C y los polonuros de lantánidos , que no se descomponen pero se funden a temperaturas superiores a 1000 °C. Por ejemplo, el polonuro de praseodimio (PrPo) se funde a 1250 °C, y el de tulio (TmPo) se funde a 2200 °C. [22] El PbPo es uno de los pocos compuestos de polonio que se encuentran en la naturaleza, ya que el polonio alfa se desintegra para formar plomo . [23]
Hidruro de polonio ( PoH
2) es un líquido volátil a temperatura ambiente propenso a la disociación; es térmicamente inestable. [22] El agua es el único otro calcogenuro de hidrógeno conocido que es líquido a temperatura ambiente; sin embargo, esto se debe a la unión de hidrógeno. Los tres óxidos, PoO , PoO 2 y PoO 3 , son los productos de la oxidación del polonio. [24]
Se conocen haluros de la estructura PoX 2 , PoX 4 y PoF 6 . Son solubles en los haluros de hidrógeno correspondientes, es decir, PoCl X en HCl, PoBr X en HBr y PoI 4 en HI. [25] Los dihaluros de polonio se forman por reacción directa de los elementos o por reducción de PoCl 4 con SO 2 y con PoBr 4 con H 2 S a temperatura ambiente. Los tetrahaluros se pueden obtener haciendo reaccionar dióxido de polonio con HCl, HBr o HI. [26]
Otros compuestos de polonio incluyen la polonita, polonita de potasio; varias soluciones de polonato; y las sales de acetato , bromato , carbonato , citrato , cromato , cianuro, formato , hidróxido (II) o (IV), nitrato , selenato, selenito, monosulfuro, sulfato , disulfato o sulfito. [25] [27]
Se conoce una química limitada del organopolonio , restringida principalmente a dialquil y diaryl poloniuros (R 2 Po), haluros de triarilpolonio (Ar 3 PoX) y dihaluros de diarilpolonio (Ar 2 PoX 2 ). [28] [29] El polonio también forma compuestos solubles con algunos ligandos , como 2,3-butanodiol y tiourea . [28]
El polonio tiene 42 isótopos conocidos, todos ellos radiactivos . Tienen masas atómicas que van desde 186 a 227 u . El 210 Po (vida media de 138,376 días) es el más disponible y se produce mediante captura de neutrones por bismuto natural . El 209 Po (vida media de 124 años, el más longevo de todos los isótopos del polonio) [3] y el 208 Po (vida media de 2,9 años) de vida más larga se pueden producir mediante el bombardeo de plomo o bismuto con electrones alfa, protones o deuterónicos en un ciclotrón . [35]
El polonio, cuyo nombre provisional era « radio F », fue descubierto por Marie y Pierre Curie en julio de 1898, [36] [37] y recibió el nombre de la tierra natal de Marie Curie, Polonia ( en latín : Polonia ). [38] [39] En ese momento, Polonia estaba bajo la partición rusa , alemana y austrohúngara , y no existía como país independiente. Curie esperaba que nombrar al elemento en honor a su tierra natal daría a conocer su falta de independencia. El polonio puede ser el primer elemento nombrado para resaltar una controversia política. [40]
Este elemento fue el primero que descubrieron los Curie mientras investigaban la causa de la radiactividad de la pechblenda . La pechblenda, después de eliminar los elementos radiactivos uranio y torio , era más radiactiva que el uranio y el torio juntos. Esto impulsó a los Curie a buscar elementos radiactivos adicionales. Primero separaron el polonio de la pechblenda en julio de 1898, y cinco meses después, también aislaron el radio . [18] [36] [41] El científico alemán Willy Marckwald aisló con éxito 3 miligramos de polonio en 1902, aunque en ese momento creía que era un elemento nuevo, al que denominó "radiotelurio", y no fue hasta 1905 que se demostró que era lo mismo que el polonio. [42] [43]
En los Estados Unidos, el polonio se produjo como parte del Proyecto Dayton del Proyecto Manhattan durante la Segunda Guerra Mundial . El polonio y el berilio eran los ingredientes clave del iniciador " Urchin " en el centro del pozo esférico de la bomba . [44] "Urchin" iniciaba la reacción nuclear en cadena en el momento de criticidad inmediata para asegurar que el arma no fallara . "Urchin" se utilizó en las primeras armas estadounidenses; las armas estadounidenses posteriores utilizaron un generador de neutrones de pulso para el mismo propósito. [44]
Gran parte de la física básica del polonio estuvo clasificada hasta después de la guerra. El hecho de que se utilizara un iniciador de polonio-berilio (Po-Be) en las armas nucleares de tipo cañón estuvo clasificado hasta la década de 1960. [45]
La Comisión de Energía Atómica y el Proyecto Manhattan financiaron experimentos humanos utilizando polonio en cinco personas en la Universidad de Rochester entre 1943 y 1947. A las personas se les administraron entre 9 y 22 microcurios (330 y 810 kBq ) de polonio para estudiar su excreción . [46] [47] [48]
El polonio es un elemento muy raro en la naturaleza debido a las cortas vidas medias de todos sus isótopos. Nueve isótopos, desde el 210 hasta el 218 inclusive, se encuentran en trazas como productos de desintegración : el 210 Po, el 214 Po y el 218 Po se encuentran en la cadena de desintegración del 238 U ; el 211 Po y el 215 Po se encuentran en la cadena de desintegración del 235 U ; el 212 Po y el 216 Po se encuentran en la cadena de desintegración del 232 Th ; y el 213 Po y el 217 Po se encuentran en la cadena de desintegración del 237 Np . (Ningún 237 Np primordial sobrevive, pero trazas del mismo se regeneran continuamente a través de reacciones de eliminación (n,2n) en el 238 U natural). [49] De estos, el 210 Po es el único isótopo con una vida media mayor a 3 minutos. [50]
El polonio se puede encontrar en minerales de uranio en una proporción de aproximadamente 0,1 mg por tonelada métrica (1 parte en 10 10 ), [51] [52] lo que representa aproximadamente el 0,2% de la abundancia de radio. Las cantidades presentes en la corteza terrestre no son dañinas. Se ha encontrado polonio en el humo de tabaco de hojas de tabaco cultivadas con fertilizantes fosfatados . [53] [54] [55]
Debido a que está presente en pequeñas concentraciones, el aislamiento del polonio de fuentes naturales es un proceso tedioso. El lote más grande del elemento jamás extraído, realizado en la primera mitad del siglo XX, contenía solo 40 Ci (1,5 TBq) (9 mg) de polonio-210 y se obtuvo procesando 37 toneladas de residuos de la producción de radio. [56] El polonio se obtiene actualmente por irradiación de bismuto con neutrones o protones de alta energía. [18] [57]
En 1934, un experimento demostró que cuando el 209 Bi natural es bombardeado con neutrones , se crea 210 Bi, que luego se desintegra en 210 Po mediante la desintegración beta-menos. Al irradiar ciertas sales de bismuto que contienen núcleos de elementos ligeros como el berilio, también se puede inducir una reacción en cascada (α,n) para producir 210 Po en grandes cantidades. [58] La purificación final se realiza piroquímicamente seguida de técnicas de extracción líquido-líquido. [59] El polonio ahora se puede producir en cantidades de miligramos en este procedimiento que utiliza altos flujos de neutrones que se encuentran en los reactores nucleares . [57] Solo se producen alrededor de 100 gramos cada año, prácticamente todo en Rusia, lo que hace que el polonio sea extremadamente raro. [60] [61]
Este proceso puede causar problemas en los reactores nucleares refrigerados por metal líquido basados en plomo y bismuto, como los utilizados en el K-27 de la Armada Soviética . En estos reactores se deben tomar medidas para abordar la posibilidad no deseada de que se libere 210 Po del refrigerante. [62] [63]
Los isótopos de polonio de vida más larga, 208 Po y 209 Po, se pueden formar mediante el bombardeo de bismuto con protones o deuterones utilizando un ciclotrón . Otros isótopos más deficientes en neutrones y más inestables se pueden formar mediante la irradiación de platino con núcleos de carbono . [64]
En la antigua Unión Soviética se produjeron fuentes de partículas alfa basadas en polonio . [65] Dichas fuentes se aplicaron para medir el espesor de revestimientos industriales mediante la atenuación de la radiación alfa. [66]
Debido a la intensa radiación alfa, una muestra de un gramo de 210 Po se calentará espontáneamente hasta más de 500 °C (932 °F) generando unos 140 vatios de potencia. Por lo tanto, el 210 Po se utiliza como fuente de calor atómico para alimentar generadores termoeléctricos de radioisótopos a través de materiales termoeléctricos . [6] [18] [67] [68] Por ejemplo, las fuentes de calor de 210 Po se utilizaron en los exploradores lunares Lunokhod 1 (1970) y Lunokhod 2 (1973) para mantener calientes sus componentes internos durante las noches lunares, así como en los satélites Kosmos 84 y 90 (1965). [65] [69]
Las partículas alfa emitidas por el polonio se pueden convertir en neutrones utilizando óxido de berilio, a una tasa de 93 neutrones por millón de partículas alfa. [67] Las mezclas de Po-BeO se utilizan como fuentes pasivas de neutrones con una relación de producción de rayos gamma a neutrones de 1,13 ± 0,05, menor que para las fuentes de neutrones basadas en la fisión nuclear . [70] Ejemplos de mezclas o aleaciones de Po-BeO utilizadas como fuentes de neutrones son un disparador o iniciador de neutrones para armas nucleares [18] [71] y para inspecciones de pozos de petróleo. Alrededor de 1500 fuentes de este tipo, con una actividad individual de 1850 Ci (68 TBq), se habían utilizado anualmente en la Unión Soviética. [72]
El polonio también formaba parte de cepillos o herramientas más complejas que eliminaban cargas estáticas en placas fotográficas, fábricas textiles , rollos de papel, láminas de plástico y sustratos (como los de los automóviles) antes de la aplicación de recubrimientos. [73] Las partículas alfa emitidas por el polonio ionizan las moléculas de aire que neutralizan las cargas en las superficies cercanas. [74] [75] Algunos cepillos antiestáticos contienen hasta 500 microcurios (20 MBq) de 210 Po como fuente de partículas cargadas para neutralizar la electricidad estática. [76] En los EE. UU., los dispositivos con no más de 500 μCi (19 MBq) de 210 Po (sellado) por unidad se pueden comprar en cualquier cantidad bajo una "licencia general", [77] lo que significa que un comprador no necesita estar registrado por ninguna autoridad. El polonio debe reemplazarse en estos dispositivos casi todos los años debido a su corta vida media; también es altamente radiactivo y, por lo tanto, ha sido reemplazado en su mayoría por fuentes de partículas beta menos peligrosas . [6]
En ocasiones, se utilizan cantidades minúsculas de 210 Po en el laboratorio y con fines didácticos (normalmente del orden de 4 a 40 kBq (0,11 a 1,08 μCi), en forma de fuentes selladas, con el polonio depositado sobre un sustrato o en una matriz de resina o polímero) que a menudo están exentas de licencia por parte de la NRC y autoridades similares, ya que no se consideran peligrosas. En Estados Unidos, se fabrican pequeñas cantidades de 210 Po para su venta al público como "fuentes de aguja" para la experimentación de laboratorio, y las venden empresas de suministros científicos. El polonio es una capa de revestimiento que a su vez está revestida con un material como el oro, que permite el paso de la radiación alfa (utilizada en experimentos como las cámaras de niebla) al tiempo que evita que el polonio se libere y presente un riesgo tóxico. [ cita requerida ]
Las bujías de polonio fueron comercializadas por Firestone desde 1940 hasta 1953. Si bien la cantidad de radiación de las bujías era minúscula y no representaba una amenaza para el consumidor, los beneficios de dichas bujías disminuyeron rápidamente después de aproximadamente un mes debido a la corta vida media del polonio y porque la acumulación en los conductores bloquearía la radiación que mejoraba el rendimiento del motor. (La premisa detrás de la bujía de polonio, así como la bujía de radio prototipo de Alfred Matthew Hubbard que la precedió, era que la radiación mejoraría la ionización del combustible en el cilindro y, por lo tanto, permitiría que el motor se encendiera de manera más rápida y eficiente). [78] [79]
El polonio puede ser peligroso y no tiene ningún papel biológico. [18] En masa, el polonio-210 es alrededor de 250.000 veces más tóxico que el cianuro de hidrógeno (la LD50 para 210Po es menos de 1 microgramo para un adulto promedio (ver más abajo) en comparación con aproximadamente 250 miligramos para el cianuro de hidrógeno [80] ). El principal peligro es su intensa radiactividad (como emisor alfa), lo que dificulta su manipulación segura. Incluso en cantidades de microgramos , la manipulación de 210Po es extremadamente peligrosa y requiere equipo especializado (una caja de guantes alfa de presión negativa equipada con filtros de alto rendimiento), una vigilancia adecuada y procedimientos de manipulación estrictos para evitar cualquier contaminación. Las partículas alfa emitidas por el polonio dañarán fácilmente el tejido orgánico si el polonio se ingiere, inhala o absorbe, aunque no penetran la epidermis y, por lo tanto, no son peligrosas siempre que las partículas alfa permanezcan fuera del cuerpo y no se acerquen a los ojos, que son tejido vivo. El uso de guantes resistentes a los productos químicos e intactos es una precaución obligatoria para evitar la difusión transcutánea del polonio directamente a través de la piel . El polonio administrado en ácido nítrico concentrado puede difundirse fácilmente a través de guantes inadecuados (por ejemplo, guantes de látex ) o el ácido puede dañar los guantes. [81]
El polonio no tiene propiedades químicas tóxicas. [82]
Se ha informado que algunos microbios pueden metilar el polonio mediante la acción de la metilcobalamina . [83] [84] Esto es similar a la forma en que el mercurio , el selenio y el telurio se metilan en los seres vivos para crear compuestos organometálicos . Los estudios que investigan el metabolismo del polonio-210 en ratas han demostrado que solo entre el 0,002 y el 0,009 % del polonio-210 ingerido se excreta como polonio-210 volátil. [85]
La dosis letal media ( DL50 ) para la exposición aguda a la radiación es de unos 4,5 Sv . [86] La dosis equivalente efectiva comprometida de 210 Po es de 0,51 μSv/ Bq si se ingiere, y de 2,5 μSv/Bq si se inhala. [87] Una dosis letal de 4,5 Sv puede ser causada por la ingestión de 8,8 MBq (240 μCi), unos 50 nanogramos (ng), o por la inhalación de 1,8 MBq (49 μCi), unos 10 ng. Un gramo de 210 Po podría, en teoría, envenenar a 20 millones de personas, de las cuales 10 millones morirían. La toxicidad real del 210 Po es inferior a estas estimaciones porque la exposición a la radiación que se extiende a lo largo de varias semanas (la vida media biológica del polonio en los seres humanos es de 30 a 50 días [88] ) es algo menos dañina que una dosis instantánea. Se ha estimado que una dosis letal media de 210 Po es de 15 megabecquerels (0,41 mCi), o 0,089 microgramos (μg), una cantidad todavía extremadamente pequeña. [89] [90] A modo de comparación, un grano de sal de mesa equivale aproximadamente a 0,06 mg = 60 μg. [91]
Además de los efectos agudos, la exposición a la radiación (tanto interna como externa) conlleva un riesgo a largo plazo de muerte por cáncer de 5 a 10% por Sv. [86] La población general está expuesta a pequeñas cantidades de polonio como descendiente del radón en el aire interior; se cree que los isótopos 214Po y 218Po causan la mayoría [92] de las 15.000 a 22.000 muertes por cáncer de pulmón estimadas cada año en los EE. UU. que se han atribuido al radón en interiores. [93] Fumar tabaco causa exposición adicional al polonio. [94]
La carga corporal máxima permitida para el 210 Po ingerido es de solo 1,1 kBq (30 nCi), lo que equivale a una partícula con una masa de solo 6,8 picogramos. [95] La concentración máxima permitida en el lugar de trabajo de 210 Po en el aire es de aproximadamente 10 Bq/m 3 (3 × 10 −10 μCi/cm 3 ). [96] Los órganos diana del polonio en humanos son el bazo y el hígado . [97] Como el bazo (150 g) y el hígado (1,3 a 3 kg) son mucho más pequeños que el resto del cuerpo, si el polonio se concentra en estos órganos vitales, es una amenaza mayor para la vida que la dosis que sufriría (en promedio) todo el cuerpo si se distribuyera uniformemente por todo el cuerpo, de la misma manera que el cesio o el tritio (como T 2 O). [98] [99]
El 210 Po se utiliza ampliamente en la industria y se encuentra disponible con facilidad y sin apenas regulación ni restricción. [100] [101] En los EE. UU., la Comisión Reguladora Nuclear implementó en 2007 un sistema de seguimiento para registrar las compras de más de 16 curies (590 GBq) de polonio-210 (suficiente para preparar 5000 dosis letales). Se dice que el OIEA "está considerando regulaciones más estrictas... Se habla de que podría endurecer el requisito de notificación del polonio por un factor de 10, a 1,6 curies (59 GBq)". [100] A partir de 2013, este sigue siendo el único material derivado emisor de alfa disponible, como una Cantidad Exenta de la NRC, que puede conservarse sin una licencia de material radiactivo. [ cita requerida ]
El polonio y sus compuestos deben manipularse con precaución dentro de cajas de guantes alfa especiales , equipadas con filtros HEPA y mantenidas continuamente bajo depresión para evitar que los materiales radiactivos se escapen. Los guantes hechos de caucho natural ( látex ) no resisten adecuadamente los ataques químicos, entre ellos el ácido nítrico concentrado (p. ej., 6 M HNO3 ) que se usa comúnmente para mantener el polonio en solución mientras se minimiza su sorción sobre el vidrio. No brindan protección suficiente contra la contaminación por polonio ( difusión de la solución de 210 Po a través de la membrana de látex intacta o, peor aún, contacto directo a través de pequeños orificios y grietas que se producen cuando el látex comienza a sufrir degradación por ácidos o rayos UV de la luz ambiental); son necesarios guantes quirúrgicos adicionales (dentro de la caja de guantes para proteger los guantes principales cuando se manipulan ácidos y bases fuertes, y también desde el exterior para proteger las manos del operador contra la contaminación por 210 Po por difusión o contacto directo a través de defectos en los guantes). Los guantes de neopreno y butilo, químicamente más resistentes y también más densos, protegen las partículas alfa emitidas por el polonio mejor que el caucho natural. [102] No se recomienda el uso de guantes de caucho natural para manipular soluciones de 210 Po.
A pesar de las propiedades altamente peligrosas del elemento, las circunstancias en las que puede ocurrir un envenenamiento por polonio son raras. Su extrema escasez en la naturaleza, [103] las cortas vidas medias de todos sus isótopos, las instalaciones y equipos especializados necesarios para obtener una cantidad significativa y las precauciones de seguridad contra accidentes de laboratorio hacen que los eventos de exposición perjudicial sean poco probables. Por lo tanto, solo se han confirmado unos pocos casos de envenenamiento por radiación específicamente atribuibles a la exposición al polonio. [104]
En respuesta a las preocupaciones sobre los riesgos de la exposición ocupacional al polonio, se administraron cantidades de 210 Po a cinco voluntarios humanos en la Universidad de Rochester entre 1944 y 1947, con el fin de estudiar su comportamiento biológico. Estos estudios fueron financiados por el Proyecto Manhattan y la AEC. Participaron cuatro hombres y una mujer, todos ellos con cánceres terminales, y con edades comprendidas entre los treinta y los cuarenta años; todos fueron elegidos porque los experimentadores querían sujetos que no hubieran estado expuestos al polonio ni en el trabajo ni por accidente. [105] Se inyectó 210 Po a cuatro pacientes hospitalizados y se administró por vía oral a un quinto. Ninguna de las dosis administradas (todas oscilaban entre 0,17 y 0,30 μ Ci kg −1 ) se acercó a las cantidades letales. [106] [105]
La primera muerte documentada como resultado directo de envenenamiento por polonio ocurrió en la Unión Soviética , el 10 de julio de 1954. [107] [108] Un hombre de 41 años no identificado se presentó para recibir tratamiento médico el 29 de junio, con vómitos severos y fiebre; el día anterior, había estado trabajando durante cinco horas en un área en la que, sin que él lo supiera, una cápsula que contenía 210 Po se había despresurizado y comenzado a dispersarse en forma de aerosol. Durante este período, su ingesta total de 210 Po en el aire se estimó en 0,11 GBq (casi 25 veces la LD 50 estimada por inhalación de 4,5 MBq). A pesar del tratamiento, su condición continuó empeorando y murió 13 días después del evento de exposición. [107]
Entre 1955 y 1957, las pilas de Windscale habían estado liberando polonio-210. El incendio de Windscale hizo necesario realizar pruebas en el terreno a sotavento para detectar contaminación con material radiactivo, y así fue como se encontró. Se ha calculado que había 8,8 terabecquerelios (240 Ci) de polonio-210.
También se ha sugerido que la muerte de Irène Joliot-Curie en 1956 por leucemia se debió a los efectos de la radiación del polonio. En 1946, estuvo expuesta accidentalmente cuando una cápsula sellada del elemento explotó en su mesa de laboratorio. [109]
Además, se ha alegado que varias muertes en Israel durante 1957-1969 fueron resultado de la exposición al 210 Po. [110] En 1957 se descubrió una fuga en un laboratorio del Instituto Weizmann. Se encontraron rastros de 210 Po en las manos del profesor Dror Sadeh, un físico que investigaba materiales radiactivos. Las pruebas médicas no indicaron ningún daño, pero las pruebas no incluyeron médula ósea. Sadeh, uno de sus estudiantes y dos colegas murieron de varios cánceres en los años siguientes. El asunto se investigó en secreto, pero nunca se admitió formalmente una conexión entre la fuga y las muertes. [111]
Se dice que el derrame de uranio en la planta de Church Rock del 16 de julio de 1979 liberó polonio-210 . El informe afirma que los animales tenían concentraciones más altas de plomo-210, polonio-210 y radio-226 que los tejidos de los animales de control. [112]
La causa de la muerte en 2006 de Alexander Litvinenko , un ex agente del FSB ruso que había desertado al Reino Unido en 2001, fue identificada como envenenamiento con una dosis letal de 210 Po; [113] [114] Posteriormente se determinó que el 210 Po probablemente le había sido administrado deliberadamente por dos ex agentes de seguridad rusos, Andrey Lugovoy y Dmitry Kovtun . [115] [116] Como tal, la muerte de Litvinenko fue el primer (y, hasta la fecha, único) caso confirmado en el que la toxicidad extrema del polonio se ha utilizado con intenciones maliciosas. [117] [118] [119]
En 2011, surgió una denuncia de que la muerte del líder palestino Yasser Arafat , quien murió el 11 de noviembre de 2004 por causas inciertas, también fue resultado de un envenenamiento deliberado con polonio, [120] [121] y en julio de 2012, el Instituto de Radiofísica de Lausana, Suiza, detectó concentraciones de 210 Po muchas veces superiores a lo normal en la ropa y las pertenencias personales de Arafat. [122] [123] Aunque los síntomas de Arafat eran gastroenteritis aguda con diarrea y vómitos, [124] el portavoz del instituto dijo que, a pesar de las pruebas, los síntomas descritos en los informes médicos de Arafat no eran compatibles con un envenenamiento por 210 Po, y no se podían sacar conclusiones. [123] En 2013, el equipo encontró niveles de polonio en las costillas y la pelvis de Arafat de 18 a 36 veces el promedio, [125] [126] aunque en ese momento la cantidad había disminuido en un factor de 2 millones. [127] El científico forense Dave Barclay declaró: "En mi opinión, es absolutamente seguro que la causa de su enfermedad fue el envenenamiento con polonio. ... Lo que tenemos es la prueba irrefutable: lo que causó su enfermedad y que se le dio con malicia". [124] [125] Posteriormente, los equipos francés y ruso afirmaron que los niveles elevados de 210 Po no fueron el resultado de un envenenamiento deliberado y no causaron la muerte de Arafat. [128] [129]
También se ha sospechado que el empresario ruso Roman Tsepov fue asesinado con polonio. Tenía síntomas similares a los de Aleksander Litvinenko. [130]
Se ha sugerido que los agentes quelantes , como el anti-Lewisita británico ( dimercaprol ), pueden usarse para descontaminar a los humanos. [131] En un experimento, se administró a las ratas una dosis letal de 1,45 MBq/kg (8,7 ng/kg) de 210 Po; todas las ratas no tratadas murieron después de 44 días, pero el 90% de las ratas tratadas con el agente quelante HOEtTTC permanecieron vivas durante cinco meses. [132]
El polonio-210 puede cuantificarse en muestras biológicas mediante espectrometría de partículas alfa para confirmar un diagnóstico de envenenamiento en pacientes hospitalizados o para proporcionar evidencia en una investigación médico-legal de muerte. La excreción urinaria basal de polonio-210 en personas sanas debido a la exposición rutinaria a fuentes ambientales se encuentra normalmente en un rango de 5 a 15 mBq/día. Los niveles superiores a 30 mBq/día son indicativos de una exposición excesiva al radionúclido. [133]
El polonio-210 está muy extendido en la biosfera , incluso en los tejidos humanos, debido a su posición en la cadena de desintegración del uranio-238 . El uranio-238 natural en la corteza terrestre se desintegra a través de una serie de intermediarios radiactivos sólidos, incluido el radio-226, en el gas noble radiactivo radón-222 , parte del cual, durante su vida media de 3,8 días, se difunde en la atmósfera. Allí se desintegra a través de varios pasos más en polonio-210, gran parte del cual, durante su vida media de 138 días, es arrastrado de regreso a la superficie de la Tierra, ingresando así a la biosfera, antes de desintegrarse finalmente en plomo-206 estable . [134] [135] [136]
Ya en la década de 1920, el biólogo francés Antoine Lacassagne , utilizando polonio proporcionado por su colega Marie Curie , demostró que el elemento tiene un patrón específico de absorción en los tejidos de conejo, con altas concentraciones, particularmente en el hígado , los riñones y los testículos . [137] Evidencias más recientes sugieren que este comportamiento resulta de la sustitución del polonio por su congénere azufre, también en el grupo 16 de la tabla periódica, en aminoácidos que contienen azufre o moléculas relacionadas [138] y que ocurren patrones similares de distribución en los tejidos humanos. [139] El polonio es de hecho un elemento presente de forma natural en todos los seres humanos, que contribuye apreciablemente a la dosis de fondo natural, con amplias variaciones geográficas y culturales, y niveles particularmente altos en los residentes del Ártico, por ejemplo. [140]
El polonio-210 presente en el tabaco contribuye a muchos de los casos de cáncer de pulmón en todo el mundo. La mayor parte de este polonio se deriva del plomo-210 depositado en las hojas de tabaco desde la atmósfera; el plomo-210 es un producto del gas radón-222 , gran parte del cual parece originarse de la descomposición del radio-226 de los fertilizantes aplicados a los suelos de tabaco. [55] [141] [142] [143] [144]
La presencia de polonio en el humo del tabaco se conoce desde principios de los años 1960. [145] [146] Algunas de las empresas tabacaleras más importantes del mundo investigaron formas de eliminar la sustancia (sin éxito) durante un período de 40 años. Los resultados nunca se publicaron. [55]
El polonio se encuentra en la cadena alimentaria, especialmente en los mariscos. [147] [148]
{{cite journal}}: CS1 maint: URL no apta ( enlace )Traducción al inglés.{{cite book}}: |journal=ignorado ( ayuda )Se llega a la conclusión de que es probable que 0,1–0,3 GBq o más absorbidos en la sangre de un hombre adulto sean letales en el plazo de 1 mes. Esto corresponde a la ingestión de 1–3 GBq o más, suponiendo una absorción del 10% en la sangre.
{{cite web}}: CS1 maint: varios nombres: lista de autores ( enlace )