El nivalenol ( NIV ) es una micotoxina del grupo de los tricotecenos . En la naturaleza se encuentra principalmente en hongos de la especie Fusarium . La especie Fusarium pertenece a los hongos productores de micotoxinas más frecuentes en las regiones templadas del hemisferio norte, lo que los convierte en un riesgo considerable para la industria de producción de cultivos alimentarios. [4]
Los hongos abundan en diversos productos agrícolas (cultivos de cereales) y sus productos procesados (malta, cerveza y pan). "Las especies de Fusarium invaden y crecen en los cultivos y pueden producir nivalenol en condiciones húmedas y frescas". [4]
En los cerdos, los síntomas observados después de la exposición al nivalenol son "rechazo de alimento, vómitos, irritación o necrosis gastroentérica y dérmica y disfunción inmunológica", [5] así como hematotoxicidad , lo que resulta en un recuento bajo de leucocitos. [5]
En el período comprendido entre 1946 y 1963, se notificaron en Japón, Corea y la India varios casos de intoxicación por ingestión de granos infectados con Fusarium (enfermedad de los granos raspados). No ha habido informes de casos letales y solo síntomas leves como náuseas , vómitos, diarrea y dolor abdominal . En estos incidentes se pudo aislar F. graminaerum , lo que sugiere una contaminación con nivalenol o deoxinivalenol .
En el mismo período se notificaron dos brotes que implicaron más de 100 casos en India y China. Estos brotes tampoco fueron letales.
Un brote agudo y bien documentado ocurrido en la India en 1987 afectó a unas 50.000.000 personas. Varias toxinas de Fusarium bajo las cuales nivalenol (0,03–0,1 mg/kg en 2 de 24 muestras), deoxinivalenol (0,34–8,4 mg/kg en 11 de 24 muestras) y acetildeoxinivalenol (0,6–2,4 mg/kg en 4 de 24 muestras) fueron encontrado en el trigo dañado por la lluvia utilizado para la producción de pan. Nuevamente no hubo casos letales y los síntomas reportados fueron dolor abdominal , diarrea, heces con sangre y vómitos. Estos casos muestran que el principal peligro emergente del nivalenol proviene de los cereales infectados por Fusarium y se produce principalmente a través de la ruta de digestión del trigo u otros granos no controlados que se procesan posteriormente o ingresan a la cadena alimentaria a través de otra ruta. [6]
El nivalenol, así como el deoxinivalenol y la toxina T-2 se han utilizado como agentes de guerra biológica en Laos y Camboya, así como en Afganistán. Se alega que la Unión Soviética proporcionó las micotoxinas y las utilizó ella misma en Afganistán. Los tres compuestos pudieron identificarse en la vegetación de los sitios afectados, mientras que la toxina T-2 también pudo encontrarse en muestras de orina y sangre de las víctimas. [7]
El uso mejor documentado de los tricotecenos en la guerra es la controversia de la lluvia amarilla, una serie de ataques en el sudeste asiático, Laos y Afganistán en los que se utilizó una " lluvia amarilla ", según lo descrito por testigos. Las toxinas se entregaron en forma de una nube de polvo o gotas amarillas. Un artículo de LR Ember publicado en 1984 en Chemical Engineering News describe el uso de micotoxinas tricotecenos como armas biológicas en el sudeste asiático de manera muy detallada, [8] cubriendo informes de supervivientes, testigos presenciales, prisioneros de guerra e informantes soviéticos junto con información sobre la presencia de técnicos y laboratorios soviéticos. Esto llevó a la conclusión de que estas toxinas se han utilizado en el sudeste asiático y Afganistán. Sin embargo, el gobierno ruso se niega a dar una declaración sobre estas pruebas. Además, se ha demostrado que las muestras tomadas en el lugar de los ataques contienen estas toxinas, mientras que los sitios que no han sido atacados no muestran ningún signo de toxinas en ellas.
Aunque sigue siendo dudoso que todos los informes de los testigos sean fuentes fiables de pruebas, los síntomas registrados son típicos de una intoxicación por tricotecenos.
Había varias formas en que los tricotecenos se utilizaban como armas, como la dispersión en forma de aerosol, humo, gotas o polvo de aviones, misiles, dispositivos portátiles o artillería. [9]
En 2000, el Comité Científico de la Alimentación (SCF) emitió un dictamen científico sobre el nivalenol . Se emitió una ingesta diaria tolerable temporal (t-TDI) de 0 a 0,7 μg/kg de peso corporal por día después de evaluar la toxicidad general, así como la hematotoxicidad y la inmunotoxicidad . Este t-TDI fue reafirmado por el SCF en 2002.
En 2010, la Comisión Japonesa de Seguridad Alimentaria (FSCJ) emitió una t-TDI de 0,4 μg/kg de peso corporal por día.
Entre 2001 y 2011, la Autoridad Europea de Seguridad Alimentaria (EFSA) recopiló datos de 15.774 casos de nivalenol en 18 países europeos para su evaluación. Esto llevó al establecimiento de una IDT de 1,2 μg/kg de peso corporal por día. En estos estudios se encontró que el nivalenol no era genotóxico, pero sí hematotóxico e inmunotóxico. [4]
El nivalenol como parte de la familia de micotoxinas tiene la estructura común que tienen todos los miembros de esta familia de toxinas. Esto incluye la estructura básica de un ciclohexeno y un anillo de tetrahidropirano conectados en C6 y C11. Además, un grupo etilo conecta el tetrahidropirano en C2 y C5 y un grupo ceto está unido al ciclohexeno en C8. El grupo epóxido , responsable en la mayor parte de la reactividad, está unido en C12 y C13 en el tetrahidropirano. Sólo los grupos restantes en las posiciones C3, C4, C7, C15 varían para las diferentes micotoxinas. En el caso del nivalenol, cada uno de los cuatro grupos restantes es un grupo hidroxilo sustituido que se suma a la reactividad en presencia de compuestos o subgrupos hidrófilos, respectivamente, gracias a sus características polares. En medio ácido, el grupo ceto es capaz de reaccionar con un protón promoviendo también la polaridad y la reactividad. Pero en conjunto, el grupo epóxido es crucial para la reactividad de la molécula. [10]
Nivalenol, deoxinivalenol]] y la toxina T2 son las tres micotoxinas sintetizadas estructurales y similares que aparecen naturalmente en los hongos (por ejemplo, Fusarium ). [10]
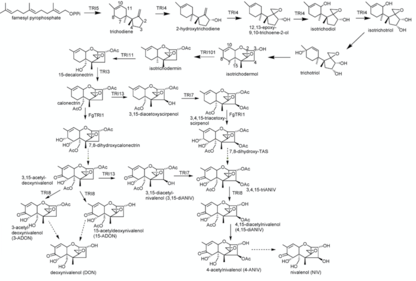
La síntesis de nivalenol es un proceso de 16 pasos. Puede diferir en el paso 11 al paso 14 dependiendo del orden en el que se catalizan las reacciones que controlan las tricodieno sintasas TRI1, TRI13 y TRI7. El pirofosfato de farnesilo se utiliza como compuesto de partida para la síntesis de nivalenol. Su reacción de ciclación a tricodieno está catalizada por la terpeno ciclasa tricodieno sintasa (Tri5). A esta reacción le siguen varias reacciones de oxidación catalizadas por la citocromo P450 monooxigenasa (codificada por TRI4). De este modo, se sustituyeron grupos hidroxilo en los átomos de carbono C2, C3 y C11 y se añadió oxígeno a C12 y C13, facilitando la formación de un grupo epóxido. Esto da como resultado el isotricotriol intermedio.
En una reacción adicional, el tricotriol se obtuvo mediante un desplazamiento del grupo hidroxilo C11 del isotricotriol al C9, de manera similar al cambio del doble enlace de C9=C10 a C10=C11. El tricotriol reacciona en una reacción de ciclación no enzimática con su isómero isotricodermol. En la reacción, el grupo hidroxilo del C2 del ciclopentano se une al C11 del ciclohexeno formando un anillo de tetrahidropirano . El grupo OH desplazado en C9 se pierde durante la reacción. Una acetiltransferasa (codificada por TRI101) cataliza la acetilación del grupo C3 OH del isotricodermol formando isotrichdermina.
La isotricodermina se convierte en 15-decalonecitrina debido a una sustitución (codificada por TRI11) de un hidrógeno por un hidroxilo en C15 que luego se acetila con la ayuda de TRI3. La misma sustitución y las siguientes reacciones de acetilación ocurren nuevamente en C4 bajo el control de TRI13 y TRI7. TRI1 en F. sporotrichiodies cataliza además la adición de un cuarto grupo OH en C8 y un quinto grupo OH en C7, en el que luego se elimina el hidrógeno y se forma un grupo ceto.
En un último paso, una esterasa controlada por TRI8 cataliza la desacetilación en C3, C4 y C15, dando como resultado el producto final nivalenol. Una síntesis parcialmente alternativa puede ocurrir cuando los catalizadores TRI1 y TRI13, TRI7 se usan en orden opuesto. Luego, la adición de los grupos hidroxilo en C7 y C8 controlada por TRI1 se produce con calonectrina como reactivo. En esta reacción se forma 7,8-dihidroxicalnectrina. Además, reacciona espontáneamente con 3,15-acetil-desoxinivalenol mediante la eliminación de un hidrógeno y la formación de un grupo ceto en C8. Se produce la adición de un grupo hidroxilo en C4 controlado por TRI13 y se acetila con la ayuda de TRI7. Esto produce 3,4,15-triacetilnivalenol (3,4,15-triANIV) a partir del cual se realiza nuevamente la misma síntesis descrita anteriormente. [9]
El nivalenol provoca un cambio en varias vías biológicas diferentes. La más conocida y probablemente importante es la vía NF-κB . NF-κB es un factor de transcripción que se puede encontrar en casi todas las células humanas y regula la expresión de sus genes diana uniéndose a motivos específicos del ADN genómico en elementos reguladores. Las pruebas in vitro han demostrado que el nivalenol puede cambiar la expresión de las citoquinas , que son importantes moléculas controladoras del sistema inmunológico. "Nivalenol indujo la secreción de IL-8, un mediador de la inflamación ". Cuando se trató con un inhibidor de NF-κB, la secreción de IL-8 disminuyó. Otro factor importante influenciado por el nivalenol es MCP-1 / CCL2 , esta citoquina juega un papel en la regulación de la movilidad de las células leucocitarias mononucleares. El nivalenol reduce la secreción de CCL2 y, por tanto, reduce la movilidad de los monocitos. Esto explica parte del carácter inmunosupresor del nivalenol. Nuevamente, este efecto se reduce mediante la inhibición de NF-κB, lo que muestra que el nivalenol y NF-κB interactúan para influir en la célula. [11] [12]
Se demostró que mientras el deoxinivalenol induce la secreción de quimiocinas , que también son moléculas mensajeras inmunorelevantes, el nivalenol inhibe su secreción. [13] [14] El nivalenol también regula positivamente la expresión de genes proinflamatorios en macrófagos, mostrando un efecto mixto en diferentes tipos de células. Lo hace incluso a niveles citotóxicos. [15]
Otro mecanismo de citotoxicidad del nivalenol es la citotoxicidad apoptótica que muestra que el nivalenol es más tóxico que su compañero micotoxina deoxinivalenol, que a menudo coexiste, y lo hace causando daño al ADN y apoptosis . [16] También se sabe que el nivalenol influye en la proliferación de leucocitos humanos. Se ha demostrado que el nivalenol puede cambiar las tasas de proliferación de los leucocitos humanos de forma dependiente de la dosis. Se sabe que concentraciones más bajas mejoran la proliferación de leucocitos, mientras que concentraciones más altas disminuyen la proliferación de una manera dependiente de la dosis. [17]

El nivalenol en ratones no sólo se metaboliza a través del hígado sino también, en menor parte, a través de la desintoxicación microbiana en los intestinos. De este modo se degrada especialmente el grupo epóxido como parte más tóxica de la molécula. Esto sucede eliminando el oxígeno del grupo epóxido dando como resultado un doble enlace carbono-carbono entre C12 y C13. Este doble enlace no es polar y es muy estable, lo que da lugar a una forma menos reactiva de nivalenol llamada deepoxinivalenol. El nivalenol desepoxinado obtenido es, por lo tanto, mucho menos tóxico, al igual que todos los tricodienos desepoxinados , y puede segregarse en la orina sin tener muchos efectos tóxicos (casi no tóxico).
En la orina de ratones y cerdos analizados se encontró que el 80% del compuesto desepoxidado y sólo el 7% del nivalenol real mostraban una alta tasa de metabolización de los tricodienos. [5] Por lo tanto, se observó una baja concentración de nitrógeno en proteínas bajas y urea, mientras que se observó que la concentración de colesterol era más alta de lo normal. Esto sugiere que el nivalenol está presente y luego se degrada en el hígado, ya que el hígado es responsable de la segregación del colesterol en el torrente sanguíneo. Una mayor cantidad de colesterol en la sangre conduce a una mayor cantidad de colesterol filtrado por los riñones y, finalmente, a un aumento de la concentración en urea. [10] [18]
Se supone que la menor concentración de amidas se debe al proceso de degradación del grupo epóxido reactivo. Por lo tanto, a menudo se encuentra que los epóxidos reaccionan con amidas o grupos amida añadiendo un grupo hidroxilo en una amina primaria o secundaria. Como consecuencia, el grupo epóxido se degrada y hay menos nitrógeno presente para la síntesis de proteínas o urea.
El nivalenol aún no ha encontrado uso en tratamientos médicos y, por lo tanto, no se le conocen efectos adversos además de los efectos tóxicos descritos. Sin embargo, cabe señalar que podría resultar interesante para la investigación debido a sus efectos inmunosupresores.
Como el nivalenol es un producto micotóxico de ciertas especies de Fusarium , a menudo se encuentra en el trigo y los cereales infectados. Dado que el trigo y los cereales sin procesar se utilizan a menudo como alimento para el ganado, estos corren un mayor riesgo de ingesta de nivalenol.
Los estudios de toxicidad en cerdos que recibieron una dosis de 0,05 mg de nivalenol/kg de peso corporal dos veces al día no mostraron efectos letales. La mayor parte del nivalenol se secretó con las heces y no llegó al torrente sanguíneo a pesar de que todavía había nivalenol en los intestinos después de 16 horas de alimentación. Además, no se encontraron metabolitos de nivalenol en las heces ni en la orina durante los primeros tres días. [19] Después de una semana de exposición a 2,5 o 5 mg de nivalenol por kg de peso corporal dos veces al día, se observó una adaptación microbiológica ya que se podían encontrar metabolitos de nivalenol (nivalenol desepoxidado) en las heces y la orina.
En ratas y ratones, el nivalenol demostró ser tóxico, con efectos adversos de retraso del crecimiento y leucopenia ya observados en dosis más bajas de 0,7 mg/kg de peso corporal por día. Las dosis letales dependieron de la vía de administración/ingesta de nivalenol. Como el nivalenol normalmente se absorbe con el alimento, se puede utilizar como estándar la DL50 de la administración oral, que es 38,9 mg/kg de peso corporal por día en ratones y 19,5 mg/kg por día en ratas . La LD 50 de la vía intravenosa, intraperitoneal y subcutánea (SC) está entre 7 y 7,5 mg/kg de peso corporal por día. [20]
La toxicidad del nivalenol en humanos aún se desconoce en gran medida, pero se ha investigado en ratones, ratas y células de hámster. De este modo, la toxicidad se dividió en los siguientes temas: aguda/subaguda, subcrónica, crónica y carcinógena, genotoxicidad, estudios de toxicidad para el desarrollo y estudios sobre la reproducción, inmunotoxicidad/hematotoxicidad y efectos sobre el sistema nervioso.
Se encontró que la LD 50 oral de nivalenol era de 38,9 mg/kg de peso corporal en ratones, mientras que las vías de exposición intraperitoneal, subcutánea e intravenosa dieron valores de LD 50 de 5 a 10 mg/kg de peso corporal. En los ratones, ya dentro de los 3 días, la mayoría de las muertes se produjeron después de la exposición oral debido a una marcada congestión y hemorragia en el intestino; en la toxicidad aguda también se incluyen los órganos linfoides. El nivalenol administrado durante períodos de 24 días en dosis más bajas (aproximadamente 3,5 mg/kg de peso corporal) mostró eritropenia significativa y leucopenia leve . [20]
La toxicidad subcrónica se probó alimentando ratones con una dosis diaria de 0 a 3,5 mg de nivalenol/kg de peso corporal durante 4 o 12 semanas. Las observaciones después de 4 semanas fueron una reducción del peso corporal y del consumo de alimentos. La reducción del peso corporal puede explicarse por la disminución estadística del peso de los órganos del timo, el bazo y los riñones. Mientras que el tiempo de consumo fue menor para las hembras en comparación con los machos. Después de 12 semanas, el consumo de toxina resultó en una reducción del peso relativo de los órganos tanto en hombres como en mujeres. En este caso sólo se vio afectado el hígado y no se observaron cambios histopatológicos . [20]
Se alimentaron ratones hembra con diferentes dosis de nivalenol (0, 0,7, 1,4 o 3,5 mg de nivalenol/kg de peso corporal) durante uno o dos años para investigar si el nivalenol es tóxico crónico y/o cancerígeno. También durante este estudio se observó una disminución en el peso corporal y en el consumo de alimento. El peso absoluto tanto del hígado como del riñón disminuyó con las dos dosis más altas. Los ratones alimentados durante un año con nivalenol (también con dosis más bajas) sufrieron leucopenia grave, mientras que los ratones alimentados durante dos años no tuvieron diferencias en el recuento de glóbulos blancos. Además "no se encontraron cambios histopatológicos, incluidos tumores, en el hígado, el timo, el bazo, los riñones, el estómago, las glándulas suprarrenales, la hipófisis, los ovarios, la médula ósea, los ganglios linfáticos, el cerebro y el intestino delgado con o sin parche de Peyer ". [20] Las dosis más bajas (0,7 mg de nivalenol/kg de peso corporal) inhibieron el crecimiento y provocaron leucopenia. "De estos estudios no se pudo derivar un nivel de efectos adversos no observables ( NOAEL ). IARC (1993) concluyó que no hay pruebas suficientes de la carcinogenicidad del nivalenol en animales de experimentación. No se disponía de datos en humanos. La conclusión general fue que la carcinogenicidad era no clasificable (grupo 3)". [20]
Se descubrió que el nivalenol afecta los genes de las células de hámster chino V79 (CHO) mediante un ligero aumento en la frecuencia de aberraciones cromosómicas y el intercambio de cromátidas hermanas. El ADN resultó dañado tanto en células CHO como en ratones. En ratones (que recibieron 20 mg de nivalenol/kg de peso corporal por vía oral o 3,7 mg/kg de peso corporal por vía intraperitoneal) se dañó el ADN del riñón, la médula ósea, el estómago, el yeyuno y el colon. El ADN del timo y del hígado no se vio afectado. En los órganos con daños en el ADN no se encontraron cambios necróticos en el examen histopatológico. Se puede concluir que no se permite una evaluación adecuada de la genotoxicidad basándose en los datos disponibles. [20]
Para estudios de desarrollo y reproducción, a ratones preñados se les inyectaron diferentes cantidades de nivalenol purificado en los días 7 a 15 de gestación y para un estudio adicional con arroz mohoso que contenía nivalenol. Los estudios demostraron que la toxina es embriotóxica en ratones. No se proporcionó evidencia de teratogenicidad . "Se indicó que el LOAEL en estudios de reproducción con nivalenol administrado por exposición oral fue de 1,4 mg/kg de peso corporal administrado en el alimento durante toda la gestación y de 5 mg/kg de peso corporal cuando se administró por sonda forzada en los días 7 a 15". [20] Aún no se proporcionan datos de otras especies ni sobre los efectos reproductivos en machos y hembras adultos. [20]
La toxicidad aguda del nivalenol induce toxicidad de la médula ósea y toxicidad de los órganos linfoides. La exposición prolongada puede provocar eritropenia y leucopenia. En ratones también se observó que el nivalenol aumentaba la presencia de IgA sérica , "acompañado de cambios inmunopatológicos en los riñones análogos a la nefropatía por IgA humana ". [20] El nivalenol inhibe la blastogénesis en linfocitos humanos cultivados, la proliferación de linfocitos masculinos y femeninos humanos estimulados con fitohemaglutina y hierba carmín y la producción de inmunoglobulinas inducida por hierba carmín. Los efectos del nivalenol están en el mismo rango que las mismas dosis de deoxinivalenol, mientras que la toxina T-2 es 100 veces más tóxica. Se obtiene un efecto aditivo combinando nivalenol con toxina T-2, 4,15-diacetoxiscirpenol o deoxinivalenol. [20]
Sobre el sistema nervioso aún no se han aportado datos. [20]