La nitroglicerina ( NG ) (ortografía alternativa de nitroglicerina), también conocida como trinitroglicerol ( TNG ), nitro , trinitrato de glicerilo ( GTN ) o 1,2,3-trinitroxipropano , es un líquido explosivo aceitoso, denso, incoloro o amarillo pálido que se produce más comúnmente al nitratar glicerol con ácido nítrico fumante blanco en condiciones apropiadas para la formación del éster de ácido nítrico . Químicamente, la sustancia es un compuesto de nitrato orgánico en lugar de un compuesto nitro , pero se conserva el nombre tradicional. Descubierta en 1846 por Ascanio Sobrero , [4] la nitroglicerina se ha utilizado como ingrediente activo en la fabricación de explosivos , a saber, dinamita , y como tal se emplea en las industrias de la construcción , la demolición y la minería . Se combina con nitrocelulosa para formar pólvora sin humo de base doble , utilizada como propulsor en artillería y armas de fuego desde la década de 1880.
Como es el caso de muchos otros explosivos, la nitroglicerina se vuelve cada vez más propensa a explotar (es decir, a la descomposición espontánea ) a medida que aumenta la temperatura. Al calentarse a 218 °C o más bajo presión atmosférica , la nitroglicerina se vuelve extremadamente inestable y tiende a explotar. Cuando se coloca al vacío, tiene una temperatura de autoignición de 270 °C en cambio. [5] Con un punto de fusión de 12,8 °C, el químico casi siempre se encuentra como un fluido espeso y viscoso, que cambia a un sólido cristalino cuando se congela. [5] [6] Aunque el compuesto puro en sí es incoloro, en la práctica la presencia de impurezas de óxido nítrico que quedan durante la producción tiende a darle un ligero tinte amarillento.
Debido a su alto punto de ebullición y la consiguiente baja presión de vapor (0,00026 mmHg a 20 °C), [5] la nitroglicerina pura prácticamente no tiene olor a temperatura ambiente, con un sabor dulce y ardiente cuando se ingiere. La detonación involuntaria puede ocurrir si se deja caer, se agita, se prende fuego, se calienta rápidamente, se expone a la luz solar y al ozono, se somete a chispas y descargas eléctricas o se manipula bruscamente. [7] Su sensibilidad a la explosión es responsable de numerosos accidentes industriales devastadores a lo largo de su historia. La reactividad característica de la sustancia química se puede reducir mediante la adición de agentes desensibilizadores, lo que hace que sea menos probable que explote. La arcilla ( tierra de diatomeas ) es un ejemplo de dicho agente, que forma dinamita , una composición mucho más fácil de manipular. La adición de otros agentes desensibilizadores da origen a las diversas formulaciones de dinamita.
La nitroglicerina se ha utilizado durante más de 130 años en medicina como un potente vasodilatador (que provoca la dilatación del sistema vascular) para tratar afecciones cardíacas , como la angina de pecho y la insuficiencia cardíaca crónica . Aunque anteriormente se sabía que estos efectos beneficiosos se deben a que la nitroglicerina se convierte en óxido nítrico , un potente venodilatador, recién en 2002 se descubrió que la enzima para esta conversión era la aldehído deshidrogenasa mitocondrial ( ALDH2 ) . [8] La nitroglicerina está disponible en comprimidos sublinguales , aerosoles, ungüentos y parches. [9]
La nitroglicerina fue el primer explosivo práctico que se produjo y que era más fuerte que la pólvora negra . Fue sintetizada por el químico italiano Ascanio Sobrero en 1846, trabajando con Théophile-Jules Pelouze en la Universidad de Turín . [10] Sobrero inicialmente llamó a su descubrimiento piroglicerina y advirtió enérgicamente contra su uso como explosivo. [11]
La nitroglicerina fue adoptada como un explosivo comercialmente útil por Alfred Nobel , quien experimentó con formas más seguras de manejar el peligroso compuesto después de que su hermano menor, Emil Oskar Nobel , y varios trabajadores de la fábrica murieran en una explosión en la fábrica de armamentos de los Nobel en 1864 en Heleneborg , Suecia. [12]

Un año después, Nobel fundó Alfred Nobel and Company en Alemania y construyó una fábrica aislada en las colinas Krümmel de Geesthacht, cerca de Hamburgo . Esta empresa exportaba una combinación líquida de nitroglicerina y pólvora llamada "Blasting Oil", pero era extremadamente inestable y difícil de manipular, como se evidenció en numerosas catástrofes. [13] Los edificios de la fábrica de Krümmel fueron destruidos dos veces. [14]
En abril de 1866, se enviaron varias cajas de nitroglicerina a California , tres de las cuales estaban destinadas al Ferrocarril Central del Pacífico , que planeaba experimentar con ella como explosivo explosivo para acelerar la construcción del túnel Summit de 506 m de largo a través de las montañas de Sierra Nevada . Una de las cajas restantes explotó, destruyendo una oficina de la compañía Wells Fargo en San Francisco y matando a 15 personas. Esto llevó a una prohibición total del transporte de nitroglicerina líquida en California. Por lo tanto, la fabricación in situ de nitroglicerina fue necesaria para la perforación y voladura de roca dura restante requerida para la finalización del primer ferrocarril transcontinental en América del Norte. [15]
El día de Navidad de 1867, un intento de deshacerse de nueve botes de aceite para detonación que se habían almacenado ilegalmente en el White Swan Inn, en el centro de Newcastle upon Tyne, dio lugar a una explosión en Town Moor que mató a ocho personas. En junio de 1869, dos carros de una tonelada cargados con nitroglicerina, conocida entonces localmente como Powder-Oil, explotaron en la carretera de la aldea de Cwm-y-glo , en el norte de Gales . La explosión provocó la pérdida de seis vidas, muchos heridos y muchos daños en la aldea. Se encontraron pocos rastros de los dos caballos. El gobierno del Reino Unido estaba tan alarmado por el daño causado y por lo que podría haber sucedido en una ubicación urbana (estas dos toneladas eran parte de una carga más grande que venía de Alemania vía Liverpool) que pronto aprobaron la Ley de Nitroglicerina de 1869. [16] La nitroglicerina líquida también estaba ampliamente prohibida en otros lugares, y estas restricciones legales llevaron a Alfred Nobel y su compañía a desarrollar la dinamita en 1867. Esta se hizo mezclando nitroglicerina con tierra de diatomeas (" Kieselguhr " en alemán) encontrada en las colinas de Krümmel. Mezclas similares, como "dualina" (1867), "lithofracteur" (1869) y " gelignita " (1875), se formaron mezclando nitroglicerina con otros absorbentes inertes, y otras compañías probaron muchas combinaciones en un intento de eludir las patentes estrictamente controladas de Nobel para la dinamita.
Las mezclas de dinamita que contienen nitrocelulosa , que aumenta la viscosidad de la mezcla, se conocen comúnmente como "gelatinas".
Tras el descubrimiento de que el nitrito de amilo ayudaba a aliviar el dolor de pecho, el médico William Murrell experimentó con el uso de nitroglicerina para aliviar la angina de pecho y reducir la presión arterial . Comenzó a tratar a sus pacientes con pequeñas dosis diluidas de nitroglicerina en 1878, y este tratamiento pronto se adoptó de forma generalizada después de que Murrell publicara sus resultados en la revista The Lancet en 1879. [17] [18] Unos meses antes de su muerte en 1896, a Alfred Nobel le recetaron nitroglicerina para esta afección cardíaca, y escribió a un amigo: "¿No es una ironía del destino que me hayan recetado nitroglicerina para tomar internamente? La llaman Trinitrin, para no asustar al químico y al público". [19] El establecimiento médico también utilizó el nombre "trinitrato de glicerilo" por la misma razón.
Durante la Primera y la Segunda Guerra Mundial se fabricaron grandes cantidades de nitroglicerina para su uso como propulsores militares y en trabajos de ingeniería militar . Durante la Primera Guerra Mundial, HM Factory, Gretna , la fábrica de propulsores más grande del Reino Unido , produjo alrededor de 800 toneladas de cordita RDB por semana. Esta cantidad requería al menos 336 toneladas de nitroglicerina por semana (suponiendo que no hubiera pérdidas en la producción). La Marina Real tenía su propia fábrica en la Royal Navy Cordite Factory, Holton Heath , en Dorset , Inglaterra. También se construyó una gran fábrica de cordita en Canadá durante la Primera Guerra Mundial. La fábrica de cordita de Canadian Explosives Limited en Nobel, Ontario , fue diseñada para producir 1.500.000 lb (680 t) de cordita por mes, lo que requiere alrededor de 286 toneladas de nitroglicerina por mes.
En su forma no diluida, la nitroglicerina es un explosivo de contacto , que explota por impacto físico. Si no se ha purificado adecuadamente durante la fabricación, puede degradarse con el tiempo a formas aún más inestables. Esto hace que la nitroglicerina sea muy peligrosa para transportar o usar. En su forma no diluida, es uno de los explosivos más potentes del mundo, comparable a los más recientes RDX y PETN .
En sus inicios, se descubrió que la nitroglicerina líquida se " desensibilizaba " congelándola a una temperatura inferior a 45 a 55 °F (7 a 13 °C) dependiendo de su pureza. [20] Su sensibilidad al impacto mientras está congelada es algo impredecible: "Es más insensible al impacto de un casquillo fulminante o una bala de rifle cuando está en esa condición, pero por otro lado parece ser más propensa a explotar al romperse, aplastarse, apisonarse, etc." [21] La nitroglicerina congelada es mucho menos energética que la líquida, por lo que debe descongelarse antes de su uso. [22] Descongelarla puede ser extremadamente sensibilizante, especialmente si hay impurezas presentes o el calentamiento es demasiado rápido. [23] Se puede agregar dinitrato de etilenglicol u otro polinitrato para reducir el punto de fusión y así evitar la necesidad de descongelar el explosivo congelado. [24]
Es posible "desensibilizar" químicamente la nitroglicerina hasta un punto en que pueda considerarse tan "segura" como los modernos explosivos de alta potencia , por ejemplo mediante la adición de etanol , acetona o dinitrotolueno . [25] Es posible que haya que extraer la nitroglicerina del desensibilizador químico para restaurar su eficacia antes de su uso, por ejemplo añadiendo agua para extraer el etanol utilizado como desensibilizador. [25]
Cuando la nitroglicerina explota, los productos después del enfriamiento se dan por:
El calor liberado se puede calcular a partir de los calores de formación. Si se utiliza −371 kJ/ mol para el calor de formación de la nitroglicerina en fase condensada [26], se obtienen 1414 kJ/mol liberados si se forma vapor de agua y 1524 si se forma agua líquida.
La velocidad de detonación de la nitroglicerina es de 7820 metros por segundo, que es aproximadamente el 113% de la velocidad del TNT . En consecuencia, la nitroglicerina se considera un explosivo de alta brisancia , es decir, tiene una excelente capacidad de fragmentación. El calor liberado durante la detonación eleva la temperatura de los subproductos gaseosos a aproximadamente 5000 °C (9000 °F). [24] Con una entalpía estándar de descomposición explosiva de −1414 kJ/ mol y un peso molecular de 227,0865 g/mol, la nitroglicerina tiene una densidad de energía explosiva específica de 1,488 kilocalorías por gramo, o 6,23 kJ/g, lo que hace que la nitroglicerina sea un 49% más energética en términos de masa que el valor de definición estándar asignado al TNT (precisamente 1 kcal/g).
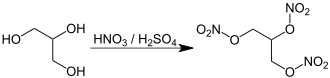
La nitroglicerina se puede producir mediante nitración catalizada por ácido del glicerol (glicerina). [30]
El proceso de fabricación industrial a menudo hace reaccionar el glicerol con una mezcla casi 1:1 de ácido sulfúrico concentrado y ácido nítrico concentrado . Esto se puede producir mezclando ácido nítrico fumante blanco (un ácido nítrico puro bastante caro en el que se han eliminado los óxidos de nitrógeno, a diferencia del ácido nítrico fumante rojo , que contiene óxidos de nitrógeno ) y ácido sulfúrico concentrado . Más a menudo, esta mezcla se obtiene mediante el método más económico de mezclar ácido sulfúrico fumante , también conocido como óleum ( ácido sulfúrico que contiene un exceso de trióxido de azufre ) y ácido nítrico azeotrópico (que consta de aproximadamente un 70 % de ácido nítrico y el resto es agua). [31]
El ácido sulfúrico produce especies de ácido nítrico protonadas , que son atacadas por los átomos de oxígeno nucleófilos del glicerol . El grupo nitro se añade así como un éster C−O−NO 2 y se produce agua. Esto es diferente de una reacción de sustitución aromática electrófila en la que los iones de nitronio son el electrófilo .
La adición de glicerol produce una reacción exotérmica (es decir, se produce calor), como es habitual en las nitraciones con ácidos mixtos. Si la mezcla se calienta demasiado, se produce una reacción descontrolada, un estado de nitración acelerada acompañado de la oxidación destructiva de los materiales orgánicos por el ácido nítrico caliente y la liberación de gas de dióxido de nitrógeno venenoso con un alto riesgo de explosión. Por tanto, la mezcla de glicerina se añade lentamente al recipiente de reacción que contiene el ácido mixto (no ácido a glicerina). El nitrador se enfría con agua fría o alguna otra mezcla refrigerante y se mantiene durante la adición de glicerina a unos 22 °C (72 °F), lo suficientemente caliente para que la esterificación se produzca a un ritmo rápido, pero lo suficientemente frío para evitar una reacción descontrolada. El recipiente del nitrador, a menudo construido de hierro o plomo y generalmente agitado con aire comprimido , tiene una trampilla de emergencia en su base, que cuelga sobre un gran estanque de agua muy fría y en el que se puede verter toda la mezcla de reacción (llamada carga) para evitar una explosión, un proceso conocido como ahogamiento. Si la temperatura de la carga supera los 30 °C (86 °F) aproximadamente (el valor real varía según el país) o se observan humos marrones en el respiradero del nitrador, entonces se ahoga inmediatamente.
La nitroglicerina es un líquido aceitoso que explota cuando se somete a calor, golpes o llamas. El principal uso de la nitroglicerina, por tonelaje , es en explosivos como la dinamita y en propelentes como ingrediente. Sin embargo, su sensibilidad ha limitado la utilidad de la nitroglicerina como explosivo militar; explosivos menos sensibles como el TNT , el RDX y el HMX la han reemplazado en gran medida en las municiones.
Alfred Nobel desarrolló el uso de nitroglicerina como explosivo detonante al mezclarla con absorbentes inertes , en particular " Kieselgur " o tierra de diatomeas . Llamó a este explosivo dinamita y lo patentó en 1867. [32] Se suministraba lista para usar en forma de barras, envueltas individualmente en papel impermeable engrasado. La dinamita y explosivos similares se adoptaron ampliamente para tareas de ingeniería civil , como en la perforación de túneles de carreteras y ferrocarriles , para la minería , para limpiar tierras de cultivo de tocones, en canteras y en trabajos de demolición . Del mismo modo, los ingenieros militares han utilizado dinamita para trabajos de construcción y demolición.
La nitroglicerina se ha utilizado en combinación con la fracturación hidráulica , un proceso utilizado para recuperar petróleo y gas de formaciones de esquisto . La técnica implica desplazar y detonar nitroglicerina en sistemas de fracturas naturales o inducidas hidráulicamente, o desplazar y detonar nitroglicerina en fracturas inducidas hidráulicamente, seguido de disparos en el pozo utilizando TNT granulado . [33]
La nitroglicerina tiene la ventaja sobre otros explosivos de gran potencia de que al detonar prácticamente no produce humo visible, por lo que resulta útil como ingrediente en la formulación de diversos tipos de pólvora sin humo . [34]
Alfred Nobel desarrolló la balistita , combinando nitroglicerina y algodón pólvora . La patentó en 1887. La balistita fue adoptada por varios gobiernos europeos como propulsor militar. Italia fue el primero en adoptarla. El gobierno británico y los gobiernos de la Commonwealth adoptaron en su lugar la cordita , que había sido desarrollada por Sir Frederick Abel y Sir James Dewar del Reino Unido en 1889. La Cordita Mk I original estaba compuesta por un 58 % de nitroglicerina, un 37 % de algodón pólvora y un 5,0 % de vaselina . La balistita y la cordita se fabricaban en forma de "cordones".
Las pólvoras sin humo se desarrollaron originalmente utilizando nitrocelulosa como único ingrediente explosivo. Por lo tanto, se conocían como propelentes de base simple. También se desarrolló una gama de pólvoras sin humo que contienen nitrocelulosa y nitroglicerina, conocidas como propelentes de base doble. Las pólvoras sin humo se suministraron originalmente solo para uso militar, pero pronto también se desarrollaron para uso civil y se adoptaron rápidamente para deportes. Algunas se conocen como pólvoras deportivas. Los propelentes de base triple contienen nitrocelulosa, nitroglicerina y nitroguanidina , pero se reservan principalmente para municiones de calibre extremadamente alto, como las utilizadas en los cañones de tanques y la artillería naval . La gelatina explosiva, también conocida como gelignita , fue inventada por Nobel en 1875, utilizando nitroglicerina, pulpa de madera y nitrato de sodio o potasio . Este fue un explosivo temprano, de bajo costo y flexible.
La nitroglicerina pertenece a un grupo de medicamentos llamados nitratos, que incluye muchos otros nitratos como el dinitrato de isosorbida (Isordil) y el mononitrato de isosorbida (Imdur, Ismo, Monoket). [35] Todos estos agentes ejercen su efecto al ser convertidos en óxido nítrico en el cuerpo por la aldehído deshidrogenasa mitocondrial ( ALDH2 ), [8] y el óxido nítrico es un potente vasodilatador natural.

En medicina , la nitroglicerina es probablemente la más comúnmente prescrita para la angina de pecho , un síntoma doloroso de la enfermedad cardíaca isquémica causada por un flujo inadecuado de sangre y oxígeno al corazón y como un potente agente antihipertensivo. La nitroglicerina corrige el desequilibrio entre el flujo de oxígeno y sangre al corazón y la demanda de energía del corazón. [35] Hay muchas formulaciones en el mercado en diferentes dosis. En dosis bajas, la nitroglicerina dilata las venas más que las arterias, reduciendo así la precarga (volumen de sangre en el corazón después del llenado); se cree que este es su principal mecanismo de acción. Al disminuir la precarga, el corazón tiene menos sangre para bombear, lo que disminuye el requerimiento de oxígeno ya que el corazón no tiene que trabajar tanto. Además, tener una precarga menor reduce la presión transmural ventricular (presión ejercida sobre las paredes del corazón), lo que disminuye la compresión de las arterias cardíacas para permitir que fluya más sangre a través del corazón. En dosis más altas, también dilata las arterias, reduciendo así la poscarga (disminuyendo la presión contra la que el corazón debe bombear). [35] Una mejor relación entre la demanda y el suministro de oxígeno del miocardio conduce a los siguientes efectos terapéuticos durante los episodios de angina de pecho: disminución del dolor torácico, disminución de la presión arterial , aumento de la frecuencia cardíaca e hipotensión ortostática . Los pacientes que experimentan angina al realizar ciertas actividades físicas a menudo pueden prevenir los síntomas tomando nitroglicerina de 5 a 10 minutos antes de la actividad. Las sobredosis pueden generar metahemoglobinemia . [36] [37]
La nitroglicerina está disponible en comprimidos, pomada, solución para uso intravenoso , parches transdérmicos o aerosoles administrados por vía sublingual . Algunas formas de nitroglicerina duran mucho más tiempo en el cuerpo que otras. La nitroglicerina, así como el inicio y la duración de la acción de cada forma, son diferentes. La nitroglicerina sublingual o en comprimidos en aerosol tiene un inicio de acción de dos minutos y una duración de acción de veinticinco minutos. La formulación oral de nitroglicerina tiene un inicio de acción de treinta y cinco minutos y una duración de acción de cuatro a ocho horas. El parche transdérmico tiene un inicio de acción de treinta minutos y una duración de acción de diez a doce horas. Se ha demostrado que la exposición continua a los nitratos hace que el cuerpo deje de responder normalmente a este medicamento. Los expertos recomiendan que los parches se retiren por la noche, lo que permite que el cuerpo tenga unas horas para recuperar su capacidad de respuesta a los nitratos. Las preparaciones de nitroglicerina de acción más corta se pueden utilizar varias veces al día con menos riesgo de desarrollar tolerancia. [38] La nitroglicerina fue utilizada por primera vez por William Murrell para tratar ataques de angina en 1878, y el descubrimiento se publicó ese mismo año. [18] [39]
La exposición poco frecuente a dosis altas de nitroglicerina puede causar fuertes dolores de cabeza, conocidos como "cabeza NG" o "cabeza de golpe". Estos dolores de cabeza pueden ser lo suficientemente fuertes como para incapacitar a algunas personas; sin embargo, los seres humanos desarrollan tolerancia y dependencia a la nitroglicerina después de una exposición prolongada. Aunque es poco frecuente, la abstinencia puede ser fatal; [40] los síntomas incluyen dolor en el pecho y otros problemas cardíacos. Estos síntomas pueden aliviarse con la reexposición a la nitroglicerina u otros nitratos orgánicos adecuados. [41]
En el caso de los trabajadores de las plantas de fabricación de nitroglicerina (NTG), los efectos de la abstinencia a veces incluyen "ataques cardíacos dominicales" en aquellos que experimentan una exposición regular a la nitroglicerina en el lugar de trabajo, lo que lleva al desarrollo de tolerancia a los efectos venodilatadores. Durante el fin de semana, los trabajadores pierden la tolerancia y, cuando se vuelven a exponer el lunes, la vasodilatación drástica produce una frecuencia cardíaca rápida , mareos y dolor de cabeza. Esto se conoce como "enfermedad del lunes". [42] [43]
Las personas pueden estar expuestas a la nitroglicerina en el lugar de trabajo al inhalarla, absorberla a través de la piel, ingerirla o por contacto con los ojos. La Administración de Seguridad y Salud Ocupacional ha establecido el límite legal ( límite de exposición permisible ) para la exposición a la nitroglicerina en el lugar de trabajo en 0,2 ppm (2 mg/m3 ) de exposición cutánea durante una jornada laboral de 8 horas. El Instituto Nacional de Seguridad y Salud Ocupacional ha establecido un límite de exposición recomendado de 0,1 mg/m3 de exposición cutánea durante una jornada laboral de 8 horas. En niveles de 75 mg/m3 , la nitroglicerina es inmediatamente peligrosa para la vida y la salud . [44]
{{cite book}}: CS1 maint: multiple names: authors list (link)