
La investigación sobre el trastorno mental de la esquizofrenia utiliza múltiples modelos animales como herramienta, incluso en la etapa preclínica del desarrollo de fármacos .
Varios modelos simulan los defectos de la esquizofrenia. Estos encajan en cuatro categorías básicas: modelos farmacológicos, modelos de desarrollo, modelos de lesión y modelos genéticos. Históricamente, los modelos farmacológicos o inducidos por fármacos fueron los más utilizados. Estos implican la manipulación de varios sistemas de neurotransmisores , incluidos la dopamina , el glutamato , la serotonina y el GABA . Los modelos de lesiones , en los que se daña un área del cerebro de un animal, surgieron de teorías de que la esquizofrenia implica neurodegeneración y que los problemas durante el desarrollo neurológico causan la enfermedad. Tradicionalmente, los modelos de esquizofrenia en roedores se centraban principalmente en síntomas análogos a los síntomas positivos de la esquizofrenia , y algunos modelos también tenían síntomas similares a los síntomas negativos . Sin embargo, avances recientes en la investigación de la esquizofrenia han apuntado a los síntomas cognitivos como algunos de los más debilitantes e influyentes en la vida diaria de los pacientes y, por lo tanto, se han convertido en un objetivo más amplio en los modelos animales de esquizofrenia. [1] Los animales utilizados como modelos para la esquizofrenia incluyen ratas , ratones y primates .
El modelado de la esquizofrenia en animales puede variar desde intentos de imitar la extensión completa de los síntomas encontrados en la esquizofrenia hasta modelos más específicos que investigan la eficacia de los fármacos antipsicóticos . Cada extremo tiene sus limitaciones, y el modelado del síndrome completo a menudo falla debido a la complejidad y la naturaleza heterogénea de la esquizofrenia, así como a la dificultad para traducir criterios de diagnóstico humanos específicos, como el habla desorganizada, a los animales. El modelado de antipsicóticos específicos enfrenta problemas similares, uno de los cuales es que no es útil para descubrir fármacos con mecanismos de acción únicos, mientras que los medicamentos tradicionales para la esquizofrenia tienen efectos generalizados (bloqueo de los receptores de dopamina) que dificultan atribuir resultados a la esquizofrenia específicamente. . Por lo tanto, desarrollar modelos basados en un signo o síntoma particular de esquizofrenia se ha convertido en un enfoque más común. Este enfoque tiene la ventaja de que es más probable que los resultados sean válidos a través de los límites de las especies. [2]
Para que un modelo animal sea útil en el desarrollo de tratamientos, los resultados del modelo animal deben traducirse en resultados en el paciente con esquizofrenia, esto se llama validez del modelo. [3] Los criterios para evaluar la validez de los modelos animales de esquizofrenia incluyen la validez aparente , la validez de constructo y la validez predictiva . [3] [4] Si bien ningún modelo animal puede abarcar completamente todos los aspectos de la esquizofrenia, se han logrado avances en el uso de animales para modelar la esquizofrenia y su relación con otros trastornos mentales, como la adicción . [5]
La validez de un modelo animal de esquizofrenia se puede medir utilizando varios rasgos conductuales, celulares y anatómicos (el fenotipo del modelo). [2]

En la hipótesis de la esquizofrenia sobre la dopamina , se planteó la hipótesis de que la esquizofrenia era causada por una alteración de la neurotransmisión de dopamina. La dopamina es un neurotransmisor monoamina que interviene en otras enfermedades, como la enfermedad de Parkinson . Hay evidencia de una mayor actividad de la vía mesolímbica , una vía dopaminérgica , en pacientes con esquizofrenia. Esto se debe al descubrimiento de niveles elevados de L-DOPA descarboxilasa en el cerebro de estos pacientes. La L-DOPA descarboxilasa es una enzima que convierte la L-DOPA en dopamina eliminando un grupo carboxilo . [8] Los modelos animales se produjeron por primera vez para la esquizofrenia alterando el sistema dopaminérgico mediante el uso de fármacos. [9]
El tratamiento persistente de roedores con modelos de anfetamina muestra síntomas de esquizofrenia que incluyen hiperactividad, anomalías duraderas de inhibición prepulso y anomalías cognitivas asociadas con la corteza prefrontal, incluidos déficits de atención. En los modelos de roedores anfetamínicos no se observan síntomas negativos, como problemas con la interacción social, o déficits relacionados con el hipocampo. Los antipsicóticos clozapina y haloperidol revierten los efectos de la anfetamina sobre la atención en ratas. [9]
El glutamato es el neurotransmisor excitador más abundante en el sistema nervioso de los vertebrados . La evidencia de la participación del glutamato en la esquizofrenia incluye síntomas análogos que son producidos por antagonistas del receptor NMDA de glutamato , como la fenciclidina (PCP) y la ketamina . El PCP es un antagonista no competitivo del receptor NMDA que produce alucinaciones y delirios en sujetos normales. En modelos de ratas, se observan alteraciones cognitivas, déficits en la interacción social, anomalías locomotoras y déficits de inhibición prepulso con la administración aguda de PCP. La evidencia de que el uso y abuso persistente de PCP en humanos produce déficits duraderos más allá del período de tratamiento ha llevado a sugerir que este régimen en roedores puede ser un modelo más preciso de esquizofrenia que la administración aguda. Se han desarrollado varios protocolos para modelos animales de PCP crónica, con diferentes efectos. Los efectos de algunos protocolos, pero no de todos, pueden revertirse mediante el tratamiento con antipsicóticos. En un modelo con primates , se descubrió que la PCP inducía deterioros cognitivos que se revertían con clozapina. [9]
La serotonina es un neurotransmisor monoamina que se ha asociado con la esquizofrenia. Las clases de drogas psicodélicas, las indolaminas y las fenetilaminas , pueden afectar a los receptores serotoninérgicos 5-HT 2A . El LSD , una indolamina, afecta la habituación al sobresalto y la inhibición del sobresalto antes del pulso, que son indicadores de la esquizofrenia humana. [8]
El ácido gamma-aminobutírico (GABA) es un importante neurotransmisor inhibidor. El sistema GABAérgico puede estar implicado en la esquizofrenia debido a sus interacciones con el sistema dopaminérgico. La picrotoxina , un antagonista del receptor GABA A , produce una inhibición prepulso del sobresalto en ratas. El haloperidol , un fármaco antipsicótico, reduce este efecto. [8]
Los estudios sobre los aspectos neurodegenerativos y de desarrollo neurológico de la esquizofrenia han llevado al uso de modelos de lesiones para investigar estos aspectos. Una lesión es un daño a un área de tejido por cualquier causa. La evidencia a favor de la teoría neurodegenerativa es una reducción en el volumen de la corteza cerebral y un aumento en el volumen de los ventrículos (cavidades en el cerebro que contienen líquido cefalorraquídeo ) asociados con la esquizofrenia. La mayoría de las enfermedades neurodegenerativas producen niveles elevados de células gliales como los astrocitos , esto no se encuentra en la esquizofrenia. La evidencia a favor de la teoría del desarrollo neurológico incluye la conexión de algunas anomalías físicas con la esquizofrenia. [8]
Las regiones del cerebro utilizadas en modelos de lesiones de esquizofrenia incluyen la corteza prefrontal, la formación del hipocampo y el tálamo . En modelos de ratas, las lesiones de la corteza prefrontal han producido una respuesta aumentada y prolongada al estrés y una menor inhibición del sobresalto prepulso cuando se tratan con apomorfina . [8]
Las lesiones neonatales de la parte ventral del hipocampo en ratas (ratas NVHL) son un modelo animal de esquizofrenia ampliamente estudiado. Las ratas NVHL imitan en detalle muchos de los síntomas de la esquizofrenia. [10] Los déficits de comportamiento causados por NVHL se observan después de la pubertad e incluyen agresión y anomalías en la interacción social. Los efectos precisos de la lesión dependen del día en que se administra. [9]
Existe evidencia de estudios epidemiológicos de que los factores ambientales durante la gestación o alrededor del parto pueden aumentar la probabilidad de que alguien desarrolle esquizofrenia. [9]
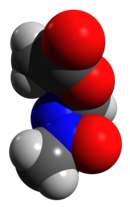
El acetato de metilazoximetanol (MAM) se usa durante la gestación para afectar aspectos del desarrollo neuronal . MAM se dirige selectivamente a los neuroblastos del sistema nervioso central . Como los neuroblastos son células que se convierten en neuronas, la interferencia con MAM inhibe las áreas del cerebro que se desarrollan más rápidamente. Por tanto, los efectos de MAM dependen de la etapa de desarrollo en la que se administra o de la edad gestacional del sujeto. En estudios con ratas, la administración de MAM en el día 17 de gestación (GD17) produce varios cambios cognitivos y anatómicos que son comunes en los pacientes con esquizofrenia. Se reduce el grosor del hipocampo y del tálamo , aumentan los efectos locomotores de las anfetaminas y la velocidad de activación espontánea de las neuronas dopominérgicas en el área tegmental ventral y se observan defectos en la memoria espacial de trabajo. [9] [11]
Las ratas tienen una organización social específica dentro de las colonias. En los modelos de aislamiento social, los cachorros que se colocan en jaulas separadas después de ser destetados muestran cambios de comportamiento en la edad adulta y un desarrollo neuronal alterado. Estos cambios permanecen después de ser reintroducidos en la colonia en la edad adulta. Los déficits conductuales causados incluyen neofobia , una mayor respuesta a nuevos estímulos, hiperactividad locomotora y aumento de la agresión. La incapacidad de las ratas en aislamiento social para habituarse a nuevos entornos puede deberse a un aumento de la actividad dopaminérgica mesolímbica . [9]
Los estudios con gemelos han demostrado que la esquizofrenia es una enfermedad hereditaria. Si bien ningún gen es responsable de la enfermedad, se ha identificado una gran cantidad de genes posibles. Los modelos animales genéticos de esquizofrenia a menudo incluyen ratones knockout , ratones modificados genéticamente en los que se elimina o altera uno o más de estos genes. [9]
Disrupted in schizophrenia 1 (DISC1) fue uno de los primeros genes descubiertos implicados en la esquizofrenia. Hasta 2011, se habían desarrollado siete cepas diferentes de modelos de ratón DISC1. Al igual que en los pacientes con esquizofrenia, los ratones DISC1 tienen un mayor tamaño del ventrículo lateral , un tamaño cortical reducido, cambios en el hipocampo y cambios en la inhibición prepulso del sobresalto que se revierten con el tratamiento con haloperidol y clozapina . [9]
"Un modelo de ratón DISC1 es inducido por la sustancia química mutagénica ENU" . ENU introduce mutaciones puntuales sin sentido ; La detección de mutaciones en un exón particular de DISC1 puede producir modelos de ratón con déficits de comportamiento similares a los de la esquizofrenia. [12]
El gen NRG1 codifica la neuregulina 1 , un factor de crecimiento crucial para el desarrollo del sistema nervioso y para la neurotransmisión y formación de sinapsis en adultos. NRG1 y el gen del receptor al que se une la neuregulina 1, ERBB4 , se han probado como posibles modelos animales de esquizofrenia. Si bien los ratones que tienen dos copias (son homocigotos para) una versión inactivada de NRG1 no sobreviven, se han desarrollado modelos animales viables utilizando inactivación heterocigótica o parcial. Uno de esos modelos de ratón es la eliminación heterocigota del dominio similar a EGF en la neuregulina 1; estos modelos se denominan ratones Nrg1(ΔEGF) +/− . Se ha demostrado que los ratones Nrg1(ΔEGF) +/− tienen problemas de interacción social, reducción del prepulso de inhibición y mayor locomoción espontánea. Otros modelos de neuregulina 1 incluyen la eliminación heterocigótica del dominio transmembrana (ratones Nrg1(ΔTM) +/− ) y el dominio de inmunoglobulina (ratones Nrg1(ΔIg) +/− ). Los ratones Nrg1(ΔTM) +/− muestran hiperactividad en diversas condiciones, un efecto que se reduce con el antipsicótico atípico clozapina . [9]
La disbindina es una proteína codificada por el gen DTNBP1, que se ha relacionado con la esquizofrenia. [3] La disbindina puede estar involucrada en los cambios en la neurotransmisión observados en pacientes con esquizofrenia. Según SA Jones et al , "actualmente se cree que DTNBP1 es uno de los genes candidatos más prometedores para la susceptibilidad a la esquizofrenia". [9] Un modelo animal natural que involucra disbindina, el ratón sdy (de arena), tiene una serie de cambios anatómicos en comparación con los ratones normales, incluidos cambios en el hipocampo. Los ratones Sdy tienen mutaciones homocigotas en DTNBP1 y carecen de la capacidad de producir disbindina; se pueden producir mutantes heterocigotos cruzando ratones sdy con una cepa de ratones normales. [9]
Reelina es una proteína que participa en la plasticidad sináptica y la sinaptogénesis en el cerebro. En la corteza frontal, el cerebelo y el hipocampo de los pacientes con esquizofrenia, la cantidad de proteína y su ARN mensajero están reducidas. Los ratones knockout en los que el gen reelina está alterado se denominan ratones reeler . En ratones carreteros homocigotos se observan cambios extremos en la marcha y otras anomalías de comportamiento ( ilustrados en vídeo ); Estos cambios van más allá de los asociados con la esquizofrenia. [9]
Los ratones carreteros heterocigotos muestran una dominancia social más baja en algunas pruebas, pero otros déficits sociales observados en la esquizofrenia están ausentes. [13] Los ratones Reeler también tienen defectos anatómicos similares a la esquizofrenia en la corteza frontal, pero tienen pocos defectos cognitivos asociados con esa área y que se encuentran en la esquizofrenia. Las pruebas realizadas en el laberinto acuático de Morris han demostrado que los ratones carreteros no presentan las anomalías en la memoria de referencia espacial que se encuentran en los pacientes con esquizofrenia. [9]
16p11.2 Duplicación
Las microduplicaciones de una región de 600 kb del cromosoma 16p11.2 se han asociado con un riesgo significativamente mayor de esquizofrenia. [14] [1] Esta es una región que se conserva en varias especies, incluidos ratones y ratas. Esto lo ha convertido en un sitio objetivo popular para la investigación actual sobre modelos de esquizofrenia en roedores.
22q11.2 Eliminación
Una deleción en el cromosoma 22q11.2 es el riesgo genético más fuerte conocido asociado con la esquizofrenia, y el 25% de las personas con esta deleción finalmente dan positivo en esquizofrenia. [15]
{{cite book}}: |last=tiene nombre genérico ( ayuda )