La química orgánica es una subdisciplina dentro de la química que implica el estudio científico de la estructura, propiedades y reacciones de compuestos orgánicos y materiales orgánicos , es decir, materia en sus diversas formas que contienen átomos de carbono . [1] El estudio de la estructura determina su fórmula estructural . El estudio de las propiedades incluye propiedades físicas y químicas , y la evaluación de la reactividad química para comprender su comportamiento. El estudio de las reacciones orgánicas incluye la síntesis química de productos naturales , fármacos y polímeros , y el estudio de moléculas orgánicas individuales en el laboratorio y mediante estudios teóricos ( in silico ).
La gama de productos químicos estudiados en la química orgánica incluye hidrocarburos (compuestos que contienen solo carbono e hidrógeno ), así como compuestos basados en carbono, pero que también contienen otros elementos, [1] [2] [3] especialmente oxígeno , nitrógeno , azufre , fósforo (incluido en muchos productos bioquímicos ) y los halógenos . La química organometálica es el estudio de compuestos que contienen enlaces carbono- metal .
Además, la investigación contemporánea se centra en la química orgánica que involucra otros organometálicos , incluidos los lantánidos , pero especialmente los metales de transición zinc, cobre, paladio , níquel, cobalto, titanio y cromo.
Los compuestos orgánicos forman la base de toda la vida terrestre y constituyen la mayoría de las sustancias químicas conocidas. Los patrones de enlace del carbono, con su valencia de cuatro (enlaces formales simples, dobles y triples, además de estructuras con electrones deslocalizados ) hacen que la variedad de compuestos orgánicos sea estructuralmente diversa y su gama de aplicaciones enorme. Forman la base o son componentes de muchos productos comerciales, incluidos los productos farmacéuticos , petroquímicos y agroquímicos , y los productos elaborados a partir de ellos, incluidos lubricantes , solventes , plásticos , combustibles y explosivos . El estudio de la química orgánica se superpone con la química organometálica y la bioquímica , pero también con la química médica , la química de polímeros y la ciencia de los materiales . [1]
La química orgánica se enseña generalmente en el nivel universitario. [4] Se considera una materia muy exigente, pero también se ha hecho accesible a los estudiantes. [5]

Antes del siglo XVIII, los químicos generalmente creían que los compuestos obtenidos de organismos vivos estaban dotados de una fuerza vital que los distinguía de los compuestos inorgánicos . Según el concepto de vitalismo (teoría de la fuerza vital), la materia orgánica estaba dotada de una "fuerza vital". [6] Durante la primera mitad del siglo XIX, se reportaron algunos de los primeros estudios sistemáticos de compuestos orgánicos. Alrededor de 1816 Michel Chevreul inició un estudio de jabones hechos de varias grasas y álcalis . Separó los ácidos que, en combinación con el álcali, producían el jabón. Como todos estos eran compuestos individuales, demostró que era posible realizar un cambio químico en varias grasas (que tradicionalmente provienen de fuentes orgánicas), produciendo nuevos compuestos, sin "fuerza vital". En 1828 Friedrich Wöhler produjo la sustancia química orgánica urea (carbamida), un constituyente de la orina , a partir de materiales de partida inorgánicos (las sales cianato de potasio y sulfato de amonio ), en lo que ahora se llama la síntesis de Wöhler . Aunque el propio Wöhler fue cauto al afirmar que había refutado el vitalismo, ésta fue la primera vez que una sustancia considerada orgánica se sintetizó en el laboratorio sin materiales de partida biológicos (orgánicos). Hoy en día se acepta generalmente que el hecho efectivamente refuta la doctrina del vitalismo. [7]
Después de Wöhler, Justus von Liebig trabajó en la organización de la química orgánica, siendo considerado uno de sus principales fundadores. [8]
En 1856, William Henry Perkin , mientras intentaba fabricar quinina , produjo accidentalmente el tinte orgánico que hoy se conoce como malva de Perkin . Su descubrimiento, que se hizo ampliamente conocido gracias a su éxito financiero, aumentó enormemente el interés por la química orgánica. [9]
Un avance crucial para la química orgánica fue el concepto de estructura química, desarrollado independientemente en 1858 por Friedrich August Kekulé y Archibald Scott Couper . [10] Ambos investigadores sugirieron que los átomos de carbono tetravalentes podían unirse entre sí para formar una red de carbono, y que los patrones detallados de los enlaces atómicos podían discernirse mediante interpretaciones hábiles de las reacciones químicas apropiadas. [11]
La era de la industria farmacéutica comenzó en la última década del siglo XIX cuando la compañía alemana Bayer fabricó por primera vez ácido acetilsalicílico, más comúnmente conocido como aspirina . [12] En 1910, Paul Ehrlich y su grupo de laboratorio comenzaron a desarrollar la arsfenamina basada en arsénico (Salvarsan), como el primer tratamiento medicinal eficaz para la sífilis , y de ese modo iniciaron la práctica médica de la quimioterapia . Ehrlich popularizó los conceptos de los medicamentos "bala mágica" y de mejorar sistemáticamente las terapias farmacológicas. [13] [14] Su laboratorio hizo contribuciones decisivas al desarrollo de antisueros para la difteria y a la estandarización de los sueros terapéuticos. [15]

Los primeros ejemplos de reacciones y aplicaciones orgánicas se encontraron a menudo gracias a una combinación de suerte y preparación para observaciones inesperadas. Sin embargo, la segunda mitad del siglo XIX fue testigo de estudios sistemáticos de compuestos orgánicos. El desarrollo del índigo sintético es ilustrativo. La producción de índigo a partir de fuentes vegetales se redujo de 19.000 toneladas en 1897 a 1.000 toneladas en 1914 gracias a los métodos sintéticos desarrollados por Adolf von Baeyer . En 2002, se produjeron 17.000 toneladas de índigo sintético a partir de productos petroquímicos . [17]
A principios del siglo XX, se demostró que los polímeros y las enzimas eran moléculas orgánicas grandes y que el petróleo era de origen biológico.
La síntesis de compuestos orgánicos complejos en múltiples etapas se denomina síntesis total. La síntesis total de compuestos naturales complejos aumentó en complejidad hasta llegar a la glucosa y al terpineol . Por ejemplo, los compuestos relacionados con el colesterol han abierto caminos para sintetizar hormonas humanas complejas y sus derivados modificados. Desde principios del siglo XX, la complejidad de las síntesis totales se ha incrementado para incluir moléculas de alta complejidad como el ácido lisérgico y la vitamina B 12 . [18]

El descubrimiento del petróleo y el desarrollo de la industria petroquímica impulsaron el desarrollo de la química orgánica. La conversión de compuestos individuales del petróleo en tipos de compuestos mediante diversos procesos químicos condujo a reacciones orgánicas que permitieron una amplia gama de productos industriales y comerciales, incluidos, entre otros (muchos): plásticos , caucho sintético , adhesivos orgánicos y varios aditivos y catalizadores modificadores de propiedades del petróleo .
La mayoría de los compuestos químicos presentes en los organismos biológicos son compuestos de carbono, por lo que la asociación entre la química orgánica y la bioquímica es tan estrecha que la bioquímica podría considerarse en esencia una rama de la química orgánica. Aunque la historia de la bioquímica podría abarcar unos cuatro siglos, la comprensión fundamental del campo recién comenzó a desarrollarse a fines del siglo XIX y el término bioquímica real se acuñó a principios del siglo XX. La investigación en el campo aumentó a lo largo del siglo XX, sin ninguna indicación de desaceleración en la tasa de aumento, como puede verificarse mediante la inspección de servicios de abstracción e indexación como BIOSIS Previews y Biological Abstracts , que comenzó en la década de 1920 como un solo volumen anual, pero ha crecido tan drásticamente que a fines del siglo XX solo estaba disponible para el usuario cotidiano como una base de datos electrónica en línea . [19]
Dado que los compuestos orgánicos suelen existir como mezclas , también se han desarrollado diversas técnicas para evaluar la pureza; las técnicas cromatográficas son especialmente importantes para esta aplicación, e incluyen la cromatografía líquida de alto rendimiento (HPLC) y la cromatografía de gases . Los métodos tradicionales de separación incluyen la destilación , la cristalización , la evaporación , la separación magnética y la extracción con disolventes .
Los compuestos orgánicos se caracterizaban tradicionalmente mediante una variedad de pruebas químicas, llamadas "métodos húmedos", pero dichas pruebas han sido desplazadas en gran medida por métodos de análisis espectroscópicos u otros métodos informáticos intensivos. [20] Enumerados en orden aproximado de utilidad, los principales métodos analíticos son:
Los métodos espectroscópicos tradicionales, como la espectroscopia infrarroja , la rotación óptica y la espectroscopia UV/VIS, brindan información estructural relativamente inespecífica, pero siguen utilizándose para aplicaciones específicas. El índice de refracción y la densidad también pueden ser importantes para la identificación de sustancias.
Las propiedades físicas de los compuestos orgánicos que suelen ser de interés incluyen características tanto cuantitativas como cualitativas. La información cuantitativa incluye el punto de fusión, el punto de ebullición, la solubilidad y el índice de refracción. Las propiedades cualitativas incluyen el olor, la consistencia y el color.
Los compuestos orgánicos suelen fundirse y muchos hierven. Por el contrario, aunque los materiales inorgánicos generalmente se pueden fundir, muchos no hierven y, en cambio, tienden a degradarse. En épocas anteriores, el punto de fusión (pf) y el punto de ebullición (pb) proporcionaban información crucial sobre la pureza e identidad de los compuestos orgánicos. Los puntos de fusión y ebullición se correlacionan con la polaridad de las moléculas y su peso molecular. Algunos compuestos orgánicos, especialmente los simétricos, subliman . Un ejemplo bien conocido de un compuesto orgánico sublimable es el para-diclorobenceno , el componente oloroso de las bolas de naftalina modernas. Los compuestos orgánicos no suelen ser muy estables a temperaturas superiores a 300 °C, aunque existen algunas excepciones.
Los compuestos orgánicos neutros tienden a ser hidrófobos , es decir, son menos solubles en agua que los disolventes inorgánicos. Las excepciones incluyen compuestos orgánicos que contienen grupos ionizables , así como alcoholes , aminas y ácidos carboxílicos de bajo peso molecular en los que se produce la unión de hidrógeno . De lo contrario, los compuestos orgánicos tienden a disolverse en disolventes orgánicos . La solubilidad varía ampliamente con el soluto orgánico y con el disolvente orgánico.
Varias propiedades especializadas de los cristales moleculares y polímeros orgánicos con sistemas conjugados son de interés según las aplicaciones, por ejemplo, propiedades termomecánicas y electromecánicas como la piezoelectricidad , la conductividad eléctrica (ver polímeros conductores y semiconductores orgánicos ) y las propiedades electroópticas (por ejemplo, la óptica no lineal ). Por razones históricas, dichas propiedades son principalmente objeto de las áreas de ciencia de polímeros y ciencia de materiales .

Los nombres de los compuestos orgánicos pueden ser sistemáticos, siguiendo lógicamente un conjunto de reglas, o no sistemáticos, siguiendo diversas tradiciones. La nomenclatura sistemática está estipulada por especificaciones de la IUPAC (Unión Internacional de Química Pura y Aplicada). La nomenclatura sistemática comienza con el nombre de una estructura madre dentro de la molécula de interés. Este nombre madre se modifica luego con prefijos, sufijos y números para transmitir de forma inequívoca la estructura. Dado que se conocen millones de compuestos orgánicos, el uso riguroso de nombres sistemáticos puede resultar engorroso. Por lo tanto, las recomendaciones de la IUPAC se siguen más de cerca para los compuestos simples, pero no para las moléculas complejas. Para utilizar la nomenclatura sistemática, uno debe conocer las estructuras y los nombres de las estructuras madre. Las estructuras madre incluyen hidrocarburos no sustituidos, heterociclos y derivados monofuncionalizados de los mismos.
La nomenclatura no sistemática es más sencilla e inequívoca, al menos para los químicos orgánicos. Los nombres no sistemáticos no indican la estructura del compuesto. Son comunes para moléculas complejas, que incluyen la mayoría de los productos naturales. Así, la dietilamida del ácido lisérgico , cuyo nombre informal se denomina sistemáticamente (6a R ,9 R )- N , N -dietil-7-metil-4,6,6a,7,8,9-hexahidroindolo-[4,3- fg ] quinolina-9-carboxamida.
Con el aumento del uso de la informática, han surgido otros métodos de denominación que están pensados para que los interpreten las máquinas. Dos formatos populares son SMILES e InChI .
Las moléculas orgánicas se describen más comúnmente mediante dibujos o fórmulas estructurales , combinaciones de dibujos y símbolos químicos. La fórmula de línea-ángulo es simple e inequívoca. En este sistema, los puntos finales y las intersecciones de cada línea representan un carbono, y los átomos de hidrógeno pueden anotarse explícitamente o asumirse como presentes, como lo implica el carbono tetravalente .

En 1880 se produjo una explosión en el número de descubrimientos de compuestos químicos, con la ayuda de nuevas técnicas analíticas y sintéticas. Grignard describió la situación como "chaos le plus complet" (caos total), ya que, debido a la falta de convenciones, era posible tener varios nombres para el mismo compuesto. Esto llevó a la creación de las reglas de Ginebra en 1892. [21]
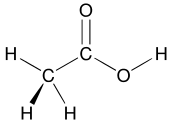
El concepto de grupos funcionales es central en la química orgánica, tanto como un medio para clasificar estructuras como para predecir propiedades. Un grupo funcional es un módulo molecular, y se supone que la reactividad de ese grupo funcional, dentro de ciertos límites, es la misma en una variedad de moléculas. Los grupos funcionales pueden tener una influencia decisiva en las propiedades químicas y físicas de los compuestos orgánicos. Las moléculas se clasifican según sus grupos funcionales. Los alcoholes, por ejemplo, todos tienen la subunidad COH. Todos los alcoholes tienden a ser algo hidrófilos , generalmente forman ésteres y generalmente se pueden convertir en los haluros correspondientes . La mayoría de los grupos funcionales presentan heteroátomos (átomos distintos de C y H). Los compuestos orgánicos se clasifican según grupos funcionales, alcoholes, ácidos carboxílicos, aminas, etc. [22] Los grupos funcionales hacen que la molécula sea más ácida o básica debido a su influencia electrónica en las partes circundantes de la molécula.
A medida que aumenta el p K a (también conocido como basicidad ) del grupo funcional/de adición molecular, se produce un dipolo correspondiente que , cuando se mide, aumenta su fuerza. Un dipolo dirigido hacia el grupo funcional (p K a más alto , por lo tanto, naturaleza básica del grupo) apunta hacia él y disminuye su fuerza a medida que aumenta la distancia. La distancia dipolar (medida en angstroms ) y el impedimento estérico hacia el grupo funcional tienen un efecto intermolecular e intramolecular en el entorno circundante y el nivel de pH .
Diferentes grupos funcionales tienen diferentes valores de p K a y fortalezas de enlace (simple, doble, triple) lo que lleva a una mayor electrofilia con un p K a menor y una mayor fuerza nucleófila con un p K a mayor . Los grupos funcionales más básicos/nucleofílicos desean atacar a un grupo funcional electrofílico con un p K a menor en otra molécula (intermolecular) o dentro de la misma molécula (intramolecular). Cualquier grupo con un p K a ácido neto que se encuentre dentro del rango, como un grupo acilo o carbonilo, es un blanco legítimo. Dado que la probabilidad de ser atacado disminuye con un aumento en p K a , los componentes de cloruro de acilo con los valores de p K a medidos más bajos son los más propensos a ser atacados, seguidos de los ácidos carboxílicos (p K a = 4), tioles (13), malonatos (13), alcoholes (17), aldehídos (20), nitrilos (25), ésteres (25), luego aminas (35). [23] Las aminas son muy básicas y son grandes nucleófilos/atacantes.
Los hidrocarburos alifáticos se subdividen en tres grupos de series homólogas según su estado de saturación :
El resto del grupo se clasifica según los grupos funcionales presentes. Dichos compuestos pueden ser de cadena lineal, ramificados o cíclicos. El grado de ramificación afecta a características como el índice de octano o el índice de cetano en la química del petróleo.
Tanto los compuestos saturados ( alicíclicos ) como los insaturados existen como derivados cíclicos. Los anillos más estables contienen cinco o seis átomos de carbono, pero son comunes los anillos grandes (macrociclos) y los anillos más pequeños. La familia de cicloalcanos más pequeña es el ciclopropano de tres miembros ((CH 2 ) 3 ). Los compuestos cíclicos saturados contienen solo enlaces simples, mientras que los anillos aromáticos tienen un doble enlace alterno (o conjugado). Los cicloalcanos no contienen enlaces múltiples, mientras que los cicloalquenos y los cicloalquinos sí.
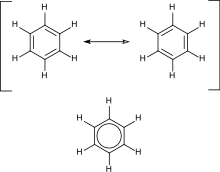
Los hidrocarburos aromáticos contienen enlaces dobles conjugados . Esto significa que cada átomo de carbono en el anillo tiene hibridación sp2, lo que permite una mayor estabilidad. El ejemplo más importante es el benceno , cuya estructura fue formulada por Kekulé , quien fue el primero en proponer el principio de deslocalización o resonancia para explicar su estructura. Para los compuestos cíclicos "convencionales", la aromaticidad se confiere por la presencia de 4n + 2 electrones pi deslocalizados, donde n es un número entero. La inestabilidad particular ( antiaromaticidad ) se confiere por la presencia de 4n electrones pi conjugados.
Las características de los hidrocarburos cíclicos se alteran nuevamente si están presentes heteroátomos, que pueden existir como sustituyentes unidos externamente al anillo (exocíclicos) o como un miembro del anillo mismo (endocíclicos). En el caso de este último, el anillo se denomina heterociclo . La piridina y el furano son ejemplos de heterociclos aromáticos, mientras que la piperidina y el tetrahidrofurano son los heterociclos alicíclicos correspondientes . El heteroátomo de las moléculas heterocíclicas es generalmente oxígeno, azufre o nitrógeno, siendo este último particularmente común en los sistemas bioquímicos.
Los heterociclos se encuentran comúnmente en una amplia gama de productos, incluidos los tintes de anilina y los medicamentos. Además, son frecuentes en una amplia gama de compuestos bioquímicos, como alcaloides , vitaminas, esteroides y ácidos nucleicos (por ejemplo, ADN, ARN).
Los anillos pueden fusionarse con otros anillos en un borde para formar compuestos policíclicos . Las bases nucleosídicas de purina son heterociclos aromáticos policíclicos notables. Los anillos también pueden fusionarse en una "esquina" de modo que un átomo (casi siempre carbono) tenga dos enlaces que vayan a un anillo y dos a otro. Estos compuestos se denominan espiro y son importantes en varios productos naturales .

Una propiedad importante del carbono es que forma fácilmente cadenas o redes que se unen mediante enlaces carbono-carbono (carbono a carbono). El proceso de unión se denomina polimerización , mientras que las cadenas o redes se denominan polímeros . El compuesto fuente se denomina monómero .
Existen dos grupos principales de polímeros : polímeros sintéticos y biopolímeros . Los polímeros sintéticos se fabrican artificialmente y se denominan comúnmente polímeros industriales . [24] Los biopolímeros se producen en un entorno natural respetuoso o sin intervención humana.
La química biomolecular es una categoría importante dentro de la química orgánica que los bioquímicos estudian con frecuencia . Muchas moléculas complejas de grupos multifuncionales son importantes en los organismos vivos. Algunas son biopolímeros de cadena larga , y estos incluyen péptidos , ADN , ARN y polisacáridos como almidones en animales y celulosas en plantas. Las otras clases principales son los aminoácidos (bloques de construcción monómeros de péptidos y proteínas), carbohidratos (que incluyen los polisacáridos), los ácidos nucleicos (que incluyen ADN y ARN como polímeros) y los lípidos . Además, la bioquímica animal contiene muchos intermediarios de moléculas pequeñas que ayudan en la producción de energía a través del ciclo de Krebs y produce isopreno , el hidrocarburo más común en los animales. Los isoprenos en animales forman los importantes compuestos estructurales esteroides ( colesterol ) y hormonas esteroides; y en las plantas forman terpenos , terpenoides , algunos alcaloides y una clase de hidrocarburos llamados poliisoprenoides biopoliméricos presentes en el látex de varias especies de plantas, que es la base para fabricar caucho . Los biólogos suelen clasificar las biomoléculas antes mencionadas en cuatro grupos principales, es decir, proteínas, lípidos, carbohidratos y ácidos nucleicos. El petróleo y sus derivados se consideran moléculas orgánicas, lo que es congruente con el hecho de que este aceite proviene de la fosilización de seres vivos, es decir, biomoléculas. [25] Véase también: síntesis de péptidos , síntesis de oligonucleótidos y síntesis de carbohidratos .

En farmacología, un grupo importante de compuestos orgánicos son las moléculas pequeñas , también denominadas "compuestos orgánicos pequeños". En este contexto, una molécula pequeña es un compuesto orgánico pequeño que es biológicamente activo pero no es un polímero . En la práctica, las moléculas pequeñas tienen una masa molar inferior a aproximadamente 1000 g/mol.
Los fulerenos y los nanotubos de carbono , compuestos de carbono con estructuras esferoidales y tubulares, han estimulado mucha investigación en el campo relacionado de la ciencia de los materiales . El primer fulereno fue descubierto en 1985 por Sir Harold W. Kroto, del Reino Unido, y por Richard E. Smalley y Robert F. Curl Jr., de los Estados Unidos. Utilizando un láser para vaporizar barras de grafito en una atmósfera de gas helio, estos químicos y sus ayudantes obtuvieron moléculas con forma de jaula compuestas de 60 átomos de carbono (C60) unidos por enlaces simples y dobles para formar una esfera hueca con 12 caras pentagonales y 20 hexagonales, un diseño que se asemeja a un balón de fútbol. En 1996, el trío recibió el Premio Nobel por sus esfuerzos pioneros. La molécula de C60 recibió el nombre de buckminsterfullereno (o, más simplemente, buckyball) en honor al arquitecto estadounidense R. Buckminster Fuller, cuya cúpula geodésica está construida sobre los mismos principios estructurales.
Los compuestos orgánicos que contienen enlaces de carbono con nitrógeno, oxígeno y halógenos normalmente no se agrupan por separado. Otros a veces se colocan en grupos principales dentro de la química orgánica y se analizan bajo títulos como química de organoazufre , química organometálica , química de organofosforados y química de organosilicio .
Las reacciones orgánicas son reacciones químicas que involucran compuestos orgánicos . Muchas de estas reacciones están asociadas con grupos funcionales. La teoría general de estas reacciones implica un análisis cuidadoso de propiedades tales como la afinidad electrónica de los átomos clave, la fuerza de los enlaces y el impedimento estérico . Estos factores pueden determinar la estabilidad relativa de los intermediarios reactivos de vida corta , que generalmente determinan directamente la ruta de la reacción.
Los tipos básicos de reacciones son: reacciones de adición , reacciones de eliminación , reacciones de sustitución , reacciones pericíclicas , reacciones de reordenamiento y reacciones redox . Un ejemplo de una reacción común es una reacción de sustitución escrita como:
donde X es algún grupo funcional y Nu es un nucleófilo .
El número de reacciones orgánicas posibles es infinito. Sin embargo, se observan ciertos patrones generales que se pueden utilizar para describir muchas reacciones comunes o útiles. Cada reacción tiene un mecanismo de reacción por pasos que explica cómo sucede en secuencia, aunque la descripción detallada de los pasos no siempre resulta clara a partir de una lista de reactivos únicamente.
El curso paso a paso de cualquier mecanismo de reacción dado se puede representar utilizando técnicas de empuje de flechas en las que se utilizan flechas curvas para rastrear el movimiento de los electrones a medida que los materiales de partida pasan a través de intermediarios hasta los productos finales.

La química orgánica sintética es una ciencia aplicada que se relaciona con la ingeniería , es decir, el "diseño, análisis y/o construcción de obras para fines prácticos". La síntesis orgánica de un compuesto nuevo es una tarea de resolución de problemas, en la que se diseña una síntesis para una molécula objetivo mediante la selección de reacciones óptimas a partir de materiales de partida óptimos. Los compuestos complejos pueden tener decenas de pasos de reacción que construyen secuencialmente la molécula deseada. La síntesis se lleva a cabo utilizando la reactividad de los grupos funcionales de la molécula. Por ejemplo, un compuesto carbonílico se puede utilizar como nucleófilo al convertirlo en un enolato o como electrófilo ; la combinación de ambos se denomina reacción aldólica . El diseño de síntesis prácticamente útiles siempre requiere la realización de la síntesis real en el laboratorio. La práctica científica de crear nuevas rutas sintéticas para moléculas complejas se denomina síntesis total .
Las estrategias para diseñar una síntesis incluyen la retrosíntesis , popularizada por EJ Corey , que comienza con la molécula objetivo y la empalma en pedazos según reacciones conocidas. Los pedazos, o los precursores propuestos, reciben el mismo tratamiento, hasta que se alcanzan materiales de partida disponibles e idealmente económicos. Luego, la retrosíntesis se escribe en la dirección opuesta para dar la síntesis. Se puede construir un "árbol sintético" porque cada compuesto y también cada precursor tiene múltiples síntesis.
{{cite web}}: CS1 maint: numeric names: authors list (link)