El empuje de flechas o empuje de electrones es una técnica utilizada para describir la progresión de los mecanismos de reacción de la química orgánica . [1] Fue desarrollado por primera vez por Sir Robert Robinson . Al utilizar el empuje de flechas, se dibujan "flechas curvas" o "flechas rizadas" en las fórmulas estructurales de los reactivos en una ecuación química para mostrar el mecanismo de reacción . Las flechas ilustran el movimiento de los electrones a medida que se rompen y se forman enlaces entre átomos . El empuje de flechas nunca muestra directamente el movimiento de los átomos; se utiliza para mostrar el movimiento de la densidad electrónica, que indirectamente muestra el movimiento de los átomos mismos. El empuje de flechas también se utiliza para describir cómo se distribuyen las cargas positivas y negativas alrededor de las moléculas orgánicas a través de la resonancia . Sin embargo, es importante recordar que el empuje de flechas es un formalismo y que los electrones (o más bien, la densidad electrónica) no se mueven de manera tan ordenada y discreta en la realidad.
El empuje de flechas se ha extendido a la química inorgánica , especialmente a la química de los elementos de los bloques s y p . Se ha demostrado que funciona bien para los compuestos hipervalentes . [2]

La representación de los mecanismos de reacción mediante flechas curvas para indicar el flujo de electrones fue desarrollada por Sir Robert Robinson en 1922. [3] [4] [5] Los químicos orgánicos utilizan dos tipos de flechas dentro de las estructuras moleculares para describir los movimientos de los electrones. Las trayectorias de los electrones individuales se designan con flechas de una sola púa, mientras que las flechas de doble púa muestran el movimiento de pares de electrones. La cola de la flecha se dibuja en un par solitario de electrones en un átomo o en un enlace entre átomos, una fuente de electrones o un área donde hay una densidad de electrones relativamente alta. Su punta apunta hacia sumideros de electrones o áreas de densidad de electrones relativamente baja. [6]


Cuando se rompe un enlace, los electrones abandonan el lugar donde se encontraba el enlace; esto se representa con una flecha curva que apunta en dirección opuesta al enlace y termina con la flecha que apunta hacia el siguiente orbital molecular desocupado. Los electrones pueden transferirse a un átomo específico o pueden transferirse a un enlace simple (sigma), lo que lo convierte en un enlace doble (pi), pero la flecha siempre apunta hacia un átomo específico, porque los electrones siempre se mueven a un nuevo átomo cuando son "empujados". Los químicos orgánicos representan la formación de un enlace con una flecha curva que apunta entre dos especies. [7]
Para mayor claridad, al empujar las flechas, es mejor dibujar las flechas comenzando desde un par solitario de electrones o un enlace σ o π y terminando en una posición que pueda aceptar un par de electrones, lo que permite al lector saber exactamente qué electrones se están moviendo y dónde están terminando. Los enlaces se rompen en lugares donde se llena un orbital antienlazante correspondiente. Algunas autoridades [1] permiten la simplificación de que una flecha puede originarse en una carga negativa formal que corresponde a un par solitario. Sin embargo, no todas las cargas negativas formales corresponden a la presencia de un par solitario (por ejemplo, la B en F 4 B − ), y se debe tener cuidado con este uso.
Un enlace covalente que une átomos en una molécula orgánica consiste en un grupo de dos electrones. A este grupo se lo denomina par de electrones. Las reacciones en química orgánica se producen mediante la ruptura y formación secuencial de estos enlaces. Los químicos orgánicos reconocen dos procesos para la ruptura de un enlace químico. Estos procesos se conocen como escisión homolítica y escisión heterolítica. [8]
La ruptura homolítica de un enlace es un proceso en el que el par de electrones que componen un enlace se divide, lo que provoca la ruptura del enlace. Esto se indica mediante dos flechas curvas con púas simples que apuntan en dirección opuesta al enlace. La consecuencia de este proceso es la retención de un solo electrón desapareado indicado por un punto en cada uno de los átomos que anteriormente estaban unidos por un enlace. El movimiento de un solo electrón se puede indicar mediante una flecha curva comúnmente denominada anzuelo. [9] Estas especies de un solo electrón se conocen como radicales libres . Se requiere calor o luz para proporcionar suficiente energía para que se produzca este proceso. [10]

Por ejemplo, la luz ultravioleta hace que el enlace cloro -cloro se rompa homolíticamente. El par de electrones se divide, lo que se indica mediante las dos flechas en forma de anzuelo entre ambos átomos que apuntan a ambos átomos de cloro. Una vez que se produce la reacción, ambas moléculas de cloro quedan con un solo electrón desapareado. Esta es la etapa de iniciación de la halogenación por radicales libres .

La ruptura de un enlace heterolítico es un proceso en el que el par de electrones que formaba parte de un enlace se desplaza hacia uno de los átomos que anteriormente estaban unidos por un enlace. El enlace se rompe y forma una especie con carga negativa (un anión ) y una especie con carga positiva (un catión ). El anión es la especie que retiene los electrones del enlace, mientras que el catión pierde los electrones del enlace. El anión suele formarse en el átomo más electronegativo , en este ejemplo el átomo A. Esto se debe a que el átomo más electronegativo atraerá naturalmente electrones hacia sí mismo con más fuerza, lo que da lugar a su carga negativa.
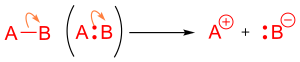
Una reacción ácido-base de Lewis ocurre cuando una molécula con un par de electrones solitario, o una base, dona sus electrones a un aceptor de pares de electrones, también conocido como ácido. [11] Esto se puede mostrar en una reacción con una flecha curva que apunta desde el par de electrones no enlazante al aceptor de electrones. En una reacción que involucra ácidos y bases de Brønsted-Lowry, las flechas se usan de la misma manera y ayudan a indicar el protón atacante. [12] En una reacción ácido-base de Brønsted-Lowry, la flecha comenzará desde el ácido, el aceptor de protones, hacia la base, el donante de protones. [13]
Una reacción S N 1 ocurre cuando una molécula se separa en un componente con carga positiva y un componente con carga negativa. Esto ocurre generalmente en solventes altamente polares a través de un proceso llamado solvólisis . El componente con carga positiva reacciona luego con un nucleófilo formando un nuevo compuesto. Las reacciones S N 1 son reacciones cuya velocidad depende únicamente de la concentración de haloalcano.

En la primera etapa de esta reacción (solvólisis), el enlace CL se rompe y ambos electrones de ese enlace se unen a LG (el grupo saliente ) para formar los iones LG − y R 3 C + . Esto está representado por la flecha curva que apunta en dirección opuesta al enlace C-LG y hacia LG. El nucleófilo Nu − , al ser atraído por el R 3 C + , dona entonces un par de electrones formando un nuevo enlace C-Nu.
Debido a que una reacción S N 1 procede con la sustitución de un grupo saliente con un nucleófilo , se utiliza la designación S N . Debido a que el paso de solvólisis inicial en esta reacción implica una sola molécula que se disocia de su grupo saliente, la etapa inicial de este proceso se considera una reacción unimolecular. La participación de solo 1 especie en la fase inicial de la reacción mejora la designación mecanicista a S N 1 . [14] Una reacción S N 1 tiene dos pasos.
Una reacción S N 2 ocurre cuando un nucleófilo desplaza un grupo saliente que reside en una molécula desde la parte posterior del grupo saliente. Este desplazamiento o sustitución da como resultado la formación de un producto de sustitución con inversión de la configuración estereoquímica. El nucleófilo forma un enlace con su par solitario como fuente de electrones. El sumidero de electrones que finalmente acepta la densidad electrónica es el nucleófugo (grupo saliente), y la formación y la ruptura del enlace ocurren simultáneamente en el estado de transición (marcado con una doble daga). Las velocidades de las reacciones S N 2 dependen de la concentración del haloalcano y del nucleófilo.

Debido a que una reacción SN2 se produce con la sustitución de un grupo saliente por un nucleófilo , se utiliza la designación SN . Debido a que este mecanismo se produce con la interacción de dos especies en el estado de transición, se lo conoce como un proceso biomolecular , lo que da como resultado la designación SN2 . [15] Una reacción SN2 es un proceso concertado, lo que significa que los enlaces se rompen y se forman simultáneamente . Por lo tanto, el movimiento de electrones que se muestra con la flecha que empuja está sucediendo simultáneamente. [16] Una reacción SN2 tiene un paso.
Una eliminación E1 ocurre cuando un protón adyacente a una carga positiva sale y genera un doble enlace .

Debido a que la formación inicial de un catión es necesaria para que se produzcan las reacciones E1, las reacciones E1 a menudo se observan como reacciones secundarias a los mecanismos S N 1.
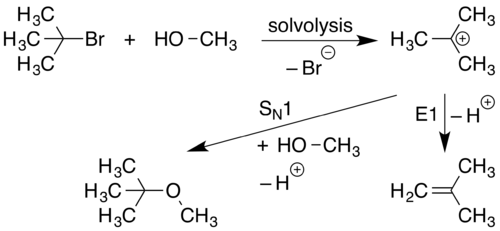
Las eliminaciones de E1 se producen con la eliminación de un grupo saliente, lo que da lugar a la designación E. Debido a que este mecanismo se produce con la disociación inicial de un único material de partida que forma un carbocatión, este proceso se considera una reacción unimolecular. La participación de solo una especie en la fase inicial de la reacción mejora la designación mecanicista de E1 .
Una eliminación E2 ocurre cuando un protón adyacente a un grupo saliente es extraído por una base con eliminación simultánea de un grupo saliente y generación de un doble enlace.

De manera similar a la relación entre las eliminaciones de E1 y los mecanismos de S N 1, las eliminaciones de E2 a menudo ocurren en competencia con las reacciones de S N 2. Esta observación se observa con mayor frecuencia cuando la base también es un nucleófilo. Para minimizar esta competencia, se utilizan comúnmente bases no nucleófilas para efectuar eliminaciones de E2.

Las eliminaciones de E2 se producen mediante la extracción inicial de un protón por una base o un nucleófilo, lo que lleva a la eliminación de un grupo saliente, lo que justifica la designación E. Debido a que este mecanismo se produce mediante la interacción de dos especies (sustrato y base/nucleófilo), las reacciones E2 se reconocen como bimoleculares. Por lo tanto, la participación de dos especies en la fase inicial de la reacción mejora la designación mecanicista de E2 .
Las reacciones de adición ocurren cuando los nucleófilos reaccionan con carbonilos . Cuando un nucleófilo se agrega a un aldehído o cetona simple , el resultado es una adición 1,2. Cuando un nucleófilo se agrega a un sistema carbonílico conjugado, el resultado es una adición 1,4. Las designaciones 1,2 y 1,4 se derivan de la numeración de los átomos del compuesto de partida donde el oxígeno está etiquetado como "1" y cada átomo adyacente al oxígeno se numera secuencialmente hasta el sitio de la adición nucleofílica. Una adición 1,2 ocurre con la adición nucleofílica a la posición 2, mientras que una adición 1,4 ocurre con la adición nucleofílica a la posición 4.
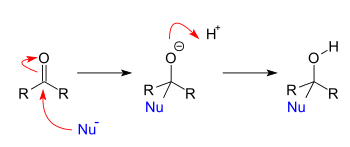

Las reacciones de adición-eliminación son reacciones de adición seguidas inmediatamente por reacciones de eliminación. En general, estas reacciones tienen lugar cuando los ésteres (o grupos funcionales relacionados) reaccionan con nucleófilos. De hecho, el único requisito para que se produzca una reacción de adición-eliminación es que el grupo que se está eliminando sea un grupo saliente mejor que el nucleófilo entrante.

{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )