
Un tipo de sangre (también conocido como grupo sanguíneo ) es una clasificación de la sangre , basada en la presencia y ausencia de anticuerpos y sustancias antigénicas heredadas en la superficie de los glóbulos rojos (RBC). Estos antígenos pueden ser proteínas , carbohidratos , glicoproteínas o glicolípidos , dependiendo del sistema de grupo sanguíneo. Algunos de estos antígenos también están presentes en la superficie de otros tipos de células de varios tejidos . Varios de estos antígenos de superficie de los glóbulos rojos pueden provenir de un alelo (o una versión alternativa de un gen) y formar colectivamente un sistema de grupo sanguíneo. [1]
Los tipos de sangre se heredan y representan contribuciones de ambos padres de un individuo. Al 31 de diciembre de 2023, la Sociedad Internacional de Transfusión de Sangre (ISBT) reconoce [actualizar]un total de 45 [2] sistemas de grupos sanguíneos humanos . [3] Los dos sistemas de grupos sanguíneos más importantes son ABO y Rh ; determinan el tipo de sangre de una persona (A, B, AB y O, donde + o − denotan el estado RhD ) para la idoneidad en la transfusión de sangre .
Un tipo de sangre completo describiría cada uno de los 45 grupos sanguíneos, y el tipo de sangre de un individuo es una de las muchas combinaciones posibles de antígenos del grupo sanguíneo. [3] Casi siempre, un individuo tiene el mismo grupo sanguíneo de por vida, pero muy raramente el tipo de sangre de un individuo cambia a través de la adición o supresión de un antígeno en una infección , malignidad o enfermedad autoinmune . [4] [5] [6] [7] Otra causa más común de cambio de tipo sanguíneo es un trasplante de médula ósea . Los trasplantes de médula ósea se realizan para muchas leucemias y linfomas , entre otras enfermedades. Si una persona recibe médula ósea de alguien de un tipo ABO diferente (p. ej., un paciente tipo O recibe médula ósea tipo A), el tipo de sangre del paciente eventualmente debería convertirse en el tipo del donante, ya que las células madre hematopoyéticas (HSC) del paciente se destruyen, ya sea por ablación de la médula ósea o por las células T del donante. Una vez que todos los glóbulos rojos originales del paciente hayan muerto, habrán sido reemplazados completamente por nuevas células derivadas de las células madre hematopoyéticas del donante. Si el donante tenía un tipo ABO diferente, los antígenos de superficie de las nuevas células serán diferentes de los que se encuentran en la superficie de los glóbulos rojos originales del paciente. [8]
Algunos tipos de sangre están asociados con la herencia de otras enfermedades; por ejemplo, el antígeno Kell a veces se asocia con el síndrome de McLeod . [9] Otro ejemplo, la enfermedad de Von Willebrand puede ser más grave o evidente en personas con tipo de sangre O. Ciertos tipos de sangre pueden afectar la susceptibilidad a las infecciones. Por ejemplo, las personas con tipo de sangre O pueden ser menos susceptibles a eventos protrombóticos inducidos por COVID-19 o COVID prolongado . [10] [11] Otro ejemplo es la resistencia a especies específicas de malaria observada en individuos que carecen del antígeno Duffy . [12] El antígeno Duffy, presumiblemente como resultado de la selección natural , es menos común en grupos de población de áreas que tienen una alta incidencia de malaria. [13]


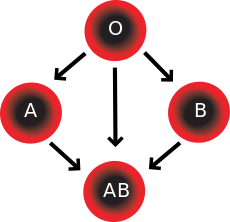
El sistema de grupos sanguíneos ABO incluye dos antígenos y dos anticuerpos presentes en la sangre humana. Los dos antígenos son el antígeno A y el antígeno B. Los dos anticuerpos son el anticuerpo A y el anticuerpo B. Los antígenos están presentes en los glóbulos rojos y los anticuerpos en el suero . En cuanto a la propiedad antigénica de la sangre, todos los seres humanos pueden clasificarse en cuatro grupos: los que tienen el antígeno A (grupo A), los que tienen el antígeno B (grupo B), los que tienen tanto el antígeno A como el B (grupo AB) y los que no tienen ninguno de los antígenos (grupo O). Los anticuerpos presentes junto con los antígenos se encuentran de la siguiente manera: [ cita requerida ]
Existe una reacción de aglutinación entre un antígeno y un anticuerpo similares (por ejemplo, el antígeno A aglutina el anticuerpo A y el antígeno B aglutina el anticuerpo B). Por lo tanto, la transfusión puede considerarse segura siempre que el suero del receptor no contenga anticuerpos contra los antígenos de las células sanguíneas del donante. [ cita requerida ]
El sistema ABO es el sistema de grupo sanguíneo más importante en la transfusión de sangre humana. Los anticuerpos anti-A y anti-B asociados suelen ser anticuerpos de inmunoglobulina M , abreviados como IgM . Se ha planteado la hipótesis de que los anticuerpos IgM ABO se producen en los primeros años de vida por sensibilización a sustancias ambientales como alimentos, bacterias y virus , aunque las reglas de compatibilidad de grupos sanguíneos se aplican a los recién nacidos y los bebés como una cuestión de práctica. [14] La terminología original utilizada por Karl Landsteiner en 1901 para la clasificación fue A/B/C; en publicaciones posteriores "C" se convirtió en "O". [15] El tipo O a menudo se llama 0 ( cero o nulo ) en otros idiomas. [15] [16]
El sistema Rh (Rh significa Rhesus ) es el segundo sistema de grupo sanguíneo más importante en la transfusión de sangre humana con actualmente 50 antígenos. El antígeno Rh más importante es el antígeno D, porque es el que tiene más probabilidades de provocar una respuesta del sistema inmunológico de los cinco antígenos Rh principales. Es común que los individuos D-negativos no tengan ningún anticuerpo IgG o IgM anti-D, porque los anticuerpos anti-D no suelen producirse por sensibilización contra sustancias ambientales. Sin embargo, los individuos D-negativos pueden producir anticuerpos IgG anti-D después de un evento sensibilizante: posiblemente una transfusión fetomaterna de sangre de un feto en el embarazo u ocasionalmente una transfusión de sangre con glóbulos rojos D positivos . [17] La enfermedad Rh puede desarrollarse en estos casos. [18] Los tipos de sangre Rh negativos son mucho menos comunes en las poblaciones asiáticas (0,3%) que en las poblaciones europeas (15%). [19]
La presencia o ausencia del antígeno Rh(D) se indica mediante el signo + o −, de modo que, por ejemplo, el grupo A− es ABO tipo A y no tiene el antígeno Rh(D). [20]
Al igual que con muchos otros rasgos genéticos, la distribución de los grupos sanguíneos ABO y Rh varía significativamente entre poblaciones. [ cita requerida ] [21] Si bien las teorías aún se debaten en la comunidad científica sobre por qué los tipos de sangre varían geográficamente y por qué surgieron en primer lugar, la evidencia sugiere que la evolución de los tipos de sangre puede estar impulsada por la selección genética de aquellos tipos cuyos antígenos confieren resistencia a enfermedades particulares en ciertas regiones, como la prevalencia del tipo de sangre O en países endémicos de malaria donde los individuos de tipo de sangre O exhiben las tasas más altas de supervivencia. [22]
Al 31 de diciembre de 2022, [actualizar]la Sociedad Internacional de Transfusión de Sangre ha identificado 42 sistemas de grupos sanguíneos además de los sistemas ABO y Rh. [3] Por lo tanto, además de los antígenos ABO y Rh, muchos otros antígenos se expresan en la membrana de la superficie de los glóbulos rojos. Por ejemplo, un individuo puede ser AB, D positivo y al mismo tiempo M y N positivo ( sistema MNS ), K positivo ( sistema Kell ), Le a o Le b negativo ( sistema Lewis ), etc., siendo positivo o negativo para cada antígeno del sistema de grupo sanguíneo. Muchos de los sistemas de grupos sanguíneos recibieron el nombre de los pacientes en los que se encontraron inicialmente los anticuerpos correspondientes. Los sistemas de grupos sanguíneos distintos de ABO y Rh plantean un riesgo potencial, aunque relativamente bajo, de complicaciones al mezclar sangre de diferentes personas. [23]
A continuación se presenta una comparación de las características clínicamente relevantes de los anticuerpos contra los principales sistemas de grupos sanguíneos humanos: [24]
La medicina transfusional es una rama especializada de la hematología que se ocupa del estudio de los grupos sanguíneos, junto con el trabajo de un banco de sangre para proporcionar un servicio de transfusión de sangre y otros productos sanguíneos. En todo el mundo, los productos sanguíneos deben ser recetados por un médico ( médico o cirujano autorizado ) de manera similar a los medicamentos. [ cita requerida ]

Gran parte del trabajo rutinario de un banco de sangre implica analizar la sangre de donantes y receptores para garantizar que cada receptor individual reciba sangre compatible y lo más segura posible. Si se transfunde una unidad de sangre incompatible entre un donante y un receptor, es probable que se produzca una reacción hemolítica aguda grave con hemólisis (destrucción de glóbulos rojos), insuficiencia renal y shock , y es posible la muerte. [27] Los anticuerpos pueden ser muy activos y pueden atacar a los glóbulos rojos y unirse a los componentes del sistema del complemento para provocar una hemólisis masiva de la sangre transfundida. [28]
Lo ideal es que los pacientes reciban su propia sangre o productos sanguíneos específicos de su tipo para minimizar la posibilidad de una reacción a la transfusión . También es posible utilizar la propia sangre del paciente para la transfusión. Esto se llama autotransfusión , que siempre es compatible con el paciente. El procedimiento de lavado de los glóbulos rojos de un paciente es el siguiente: se recoge la sangre perdida del paciente y se lava con una solución salina. El procedimiento de lavado produce glóbulos rojos lavados concentrados. El último paso es reinfundir los glóbulos rojos concentrados en el paciente. Hay varias formas de lavar los glóbulos rojos. Las dos formas principales son los métodos de centrifugación y filtración. Este procedimiento se puede realizar con dispositivos de microfiltración como el filtro Hemoclear. Los riesgos se pueden reducir aún más mediante la prueba cruzada de sangre, pero esto se puede omitir cuando se necesita sangre para una emergencia. La prueba cruzada implica mezclar una muestra del suero del receptor con una muestra de glóbulos rojos del donante y verificar si la mezcla se aglutina o forma grumos. Si la aglutinación no es evidente con la visión directa, el técnico del banco de sangre suele comprobarla con un microscopio . Si se produce aglutinación, la sangre de ese donante en particular no puede transfundirse a ese receptor en particular. En un banco de sangre es fundamental que todas las muestras de sangre estén correctamente identificadas, por lo que el etiquetado se ha estandarizado mediante un sistema de código de barras conocido como ISBT 128 .
El grupo sanguíneo puede estar incluido en las etiquetas de identificación o en los tatuajes que lleva el personal militar, en caso de que necesiten una transfusión sanguínea de emergencia. Los soldados de primera línea de las Waffen-SS alemanas tenían tatuajes de grupos sanguíneos durante la Segunda Guerra Mundial .
Los tipos de sangre raros pueden causar problemas de suministro a los bancos de sangre y hospitales. Por ejemplo, la sangre Duffy -negativa se da con mucha más frecuencia en personas de origen africano, [29] y la rareza de este tipo de sangre en el resto de la población puede resultar en una escasez de sangre Duffy-negativa para estos pacientes. De manera similar, para las personas RhD negativas existe un riesgo asociado con viajar a partes del mundo donde los suministros de sangre RhD negativa son raros, particularmente el este de Asia , donde los servicios de sangre pueden tratar de alentar a los occidentales a donar sangre. [30]
Una mujer embarazada puede llevar un feto con un tipo de sangre diferente al suyo. Por lo general, esto es un problema si una madre Rh- tiene un hijo con un padre Rh+ y el feto termina siendo Rh+ como el padre. [31] En esos casos, la madre puede producir anticuerpos del grupo sanguíneo IgG . Esto puede suceder si algunas de las células sanguíneas del feto pasan a la circulación sanguínea de la madre (por ejemplo, una pequeña hemorragia fetomaterna en el momento del parto o una intervención obstétrica), o algunas veces después de una transfusión sanguínea terapéutica . Esto puede causar enfermedad Rh u otras formas de enfermedad hemolítica del recién nacido (HDN) en el embarazo actual y/o embarazos posteriores. A veces esto es letal para el feto; en estos casos se llama hidropesía fetal . [32] Si se sabe que una mujer embarazada tiene anticuerpos anti-D, el tipo de sangre Rh de un feto se puede probar mediante el análisis del ADN fetal en el plasma materno para evaluar el riesgo de enfermedad Rh para el feto. [33] Uno de los mayores avances de la medicina del siglo XX fue prevenir esta enfermedad deteniendo la formación de anticuerpos anti-D por parte de madres D negativas con un medicamento inyectable llamado inmunoglobulina Rho(D) . [34] [35] Los anticuerpos asociados con algunos grupos sanguíneos pueden causar HDN grave, otros solo pueden causar HDN leve y no se sabe que otros causen HDN. [32]
Para obtener el máximo beneficio de cada donación de sangre y extender su vida útil, los bancos de sangre fraccionan parte de la sangre entera en varios productos. Los más comunes de estos productos son los glóbulos rojos concentrados, el plasma , las plaquetas , el crioprecipitado y el plasma fresco congelado (PFC). El FFP se congela rápidamente para retener los factores de coagulación lábiles V y VIII , que generalmente se administran a pacientes que tienen un problema de coagulación potencialmente fatal causado por una afección como una enfermedad hepática avanzada , una sobredosis de anticoagulantes o una coagulación intravascular diseminada (CID). [ cita requerida ]
Las unidades de glóbulos rojos concentrados se obtienen extrayendo la mayor cantidad posible de plasma de unidades de sangre completa.
Los factores de coagulación sintetizados mediante métodos recombinantes modernos se utilizan ahora de forma rutinaria en la clínica para la hemofilia , ya que se evitan los riesgos de transmisión de infecciones que ocurren con los productos sanguíneos mezclados.
Nota de tabla
1. Supone la ausencia de anticuerpos atípicos que causarían una incompatibilidad entre la sangre del donante y del receptor, como es habitual en el caso de la sangre seleccionada mediante pruebas cruzadas.
Un paciente Rh D-negativo que no tenga anticuerpos anti-D (nunca haya sido sensibilizado previamente a los glóbulos rojos D-positivos) puede recibir una transfusión de sangre D-positiva una vez, pero esto causaría sensibilización al antígeno D, y una paciente femenina correría riesgo de enfermedad hemolítica del recién nacido . Si un paciente D-negativo ha desarrollado anticuerpos anti-D, una exposición posterior a sangre D-positiva conduciría a una reacción transfusional potencialmente peligrosa. La sangre Rh D-positiva nunca debe administrarse a mujeres D-negativas en edad fértil o a pacientes con anticuerpos D, por lo que los bancos de sangre deben conservar sangre Rh-negativa para estos pacientes. En circunstancias extremas, como en el caso de una hemorragia importante cuando las existencias de unidades de sangre D-negativas son muy bajas en el banco de sangre, se puede administrar sangre D-positiva a mujeres D-negativas que hayan superado la edad fértil o a hombres Rh-negativos, siempre que no tengan anticuerpos anti-D, para conservar la reserva de sangre D-negativa en el banco de sangre. Lo inverso no es cierto; los pacientes Rh D positivo no reaccionan a la sangre D negativa.
Esta misma correspondencia se realiza para otros antígenos del sistema Rh como C, c, E y e y para otros sistemas de grupos sanguíneos con un riesgo conocido para la inmunización como el sistema Kell en particular para mujeres en edad fértil o pacientes con necesidad conocida de muchas transfusiones.
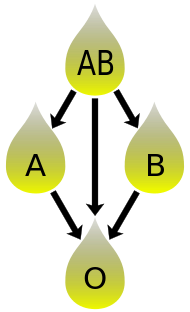
La compatibilidad del plasma sanguíneo es inversa a la compatibilidad de los glóbulos rojos. [39] El plasma de tipo AB no contiene anticuerpos anti-A ni anti-B y puede ser transfundido a individuos de cualquier grupo sanguíneo; pero los pacientes de tipo AB solo pueden recibir plasma de tipo AB. El tipo O contiene ambos anticuerpos, por lo que los individuos del grupo sanguíneo O pueden recibir plasma de cualquier grupo sanguíneo, pero el plasma de tipo O solo puede ser utilizado por receptores de tipo O.
Nota de tabla
1. Suponiendo la ausencia de anticuerpos atípicos fuertes en el plasma del donante
Los anticuerpos Rh D son poco comunes, por lo que, en general, ni la sangre D negativa ni la D positiva contienen anticuerpos anti-D. Si se descubre que un donante potencial tiene anticuerpos anti-D o cualquier anticuerpo atípico fuerte de grupo sanguíneo mediante un análisis de anticuerpos en el banco de sangre, no se lo aceptará como donante (o en algunos bancos de sangre se extraerá la sangre, pero el producto deberá estar etiquetado adecuadamente); por lo tanto, el plasma sanguíneo de donante emitido por un banco de sangre puede seleccionarse para que esté libre de anticuerpos D y libre de otros anticuerpos atípicos, y dicho plasma de donante emitido por un banco de sangre sería adecuado para un receptor que puede ser D positivo o D negativo, siempre que el plasma sanguíneo y el receptor sean compatibles con ABO. [ cita requerida ]
En las transfusiones de glóbulos rojos concentrados, los individuos con sangre tipo O Rh D negativo suelen ser llamados donantes universales. Aquellos con sangre tipo AB Rh D positivo son llamados receptores universales. Sin embargo, estos términos solo son generalmente ciertos con respecto a las posibles reacciones de los anticuerpos anti-A y anti-B del receptor a los glóbulos rojos transfundidos, y también a la posible sensibilización a los antígenos Rh D. Una excepción son los individuos con sistema de antígeno hh (también conocido como fenotipo Bombay) que solo pueden recibir sangre de forma segura de otros donantes hh, porque forman anticuerpos contra el antígeno H presente en todos los glóbulos rojos. [41] [42]
Los donantes de sangre con anticuerpos anti-A, anti-B o cualquier otro grupo sanguíneo atípico excepcionalmente fuertes pueden ser excluidos de la donación de sangre. En general, si bien la fracción de plasma de una transfusión de sangre puede contener anticuerpos del donante que no se encuentran en el receptor, es poco probable que se produzca una reacción significativa debido a la dilución.
Además, los antígenos de superficie de los glóbulos rojos distintos de A, B y Rh D pueden causar reacciones adversas y sensibilización si pueden unirse a los anticuerpos correspondientes para generar una respuesta inmunitaria. Las transfusiones son más complicadas porque las plaquetas y los glóbulos blancos tienen sus propios sistemas de antígenos de superficie y la sensibilización a los antígenos de las plaquetas o los glóbulos blancos puede producirse como resultado de la transfusión.
En el caso de las transfusiones de plasma , la situación es la contraria. El plasma de tipo O, que contiene anticuerpos anti-A y anti-B, sólo se puede administrar a los receptores de tipo O. Los anticuerpos atacarán a los antígenos de cualquier otro tipo de sangre. Por el contrario, el plasma AB se puede administrar a pacientes de cualquier grupo sanguíneo ABO, porque no contiene anticuerpos anti-A ni anti-B.
Por lo general, las pruebas de determinación del tipo de sangre se realizan añadiendo una muestra de sangre a una solución que contiene anticuerpos correspondientes a cada antígeno. La presencia de un antígeno en la superficie de las células sanguíneas se indica mediante aglutinación .
Además de la práctica actual de las pruebas serológicas de los tipos de sangre, el progreso en el diagnóstico molecular permite el uso creciente de la genotipificación del grupo sanguíneo. A diferencia de las pruebas serológicas que informan un fenotipo directo del tipo de sangre, la genotipificación permite la predicción de un fenotipo basado en el conocimiento de la base molecular de los antígenos conocidos actualmente. Esto permite una determinación más detallada del tipo de sangre y, por lo tanto, una mejor compatibilidad para la transfusión, lo que puede ser crucial en particular para los pacientes que necesitan muchas transfusiones para prevenir la aloinmunización. [43] [44]
Los tipos de sangre fueron descubiertos por primera vez por un médico austríaco, Karl Landsteiner , que trabajaba en el Instituto Anatómico Patológico de la Universidad de Viena (ahora Universidad Médica de Viena ). En 1900, descubrió que los sueros sanguíneos de diferentes personas se aglutinaban cuando se mezclaban en tubos de ensayo y, no solo eso, sino que también se aglutinaba algo de sangre humana con sangre animal. [45] Escribió una nota a pie de página de dos oraciones:
El suero de seres humanos sanos no sólo aglutina glóbulos rojos animales, sino también, a menudo, los de origen humano, de otros individuos. Queda por ver si esta apariencia está relacionada con diferencias innatas entre individuos o es el resultado de algún daño de tipo bacteriano. [46]
Esta fue la primera evidencia de que existe variación sanguínea en humanos. Al año siguiente, en 1901, hizo una observación definitiva de que el suero sanguíneo de un individuo se aglutinaría solo con los de ciertos individuos. Basándose en esto, clasificó la sangre humana en tres grupos, a saber, grupo A, grupo B y grupo C. Definió que la sangre del grupo A se aglutina con el grupo B, pero nunca con su propio tipo. De manera similar, la sangre del grupo B se aglutina con el grupo A. La sangre del grupo C es diferente en que aglutina tanto con A como con B. [47] Este fue el descubrimiento de los grupos sanguíneos por el que Landsteiner recibió el Premio Nobel de Fisiología o Medicina en 1930. (C fue posteriormente renombrado a O por el alemán Ohne , que significa sin, o cero, o nulo. [48] ) Otro grupo (más tarde llamado AB) fue descubierto un año después por los estudiantes de Landsteiner Adriano Sturli y Alfred von Decastello sin designar el nombre (simplemente refiriéndose a él como "ningún tipo en particular"). [49] [50] Así, después de Landsteiner, se reconocieron inicialmente tres tipos de sangre, a saber, A, B y C. [50]
El serólogo checo Jan Janský fue el primero en reconocer y designar cuatro tipos de sangre en 1907, lo que publicó en una revista local, [51] utilizando los números romanos I, II, III y IV (que corresponden a los modernos O, A, B y AB respectivamente). [52] Sin que Janský lo supiera, el médico estadounidense William L. Moss introdujo una clasificación casi idéntica en 1910, [53] pero con los tipos I y IV de Moss correspondientes a los tipos IV y I de Janský. [54] Por lo tanto, la existencia de dos sistemas creó inmediatamente confusión y un peligro potencial en la práctica médica. El sistema de Moss fue adoptado en Gran Bretaña, Francia y los EE. UU., mientras que el de Janský fue preferido en la mayoría de los demás países europeos y algunas partes de los EE. UU. Se informó que "el uso prácticamente universal de la clasificación de Moss en ese momento fue completamente y deliberadamente abandonado. Por lo tanto, en lugar de poner orden en el caos, se incrementó el caos en las ciudades más grandes". [55] Para resolver la confusión, la Asociación Estadounidense de Inmunólogos , la Sociedad de Bacteriólogos Estadounidenses y la Asociación de Patólogos y Bacteriólogos hicieron una recomendación conjunta en 1921 de que se adoptara la clasificación de Jansky en función de la prioridad. [56] Pero no se siguió particularmente donde se había utilizado el sistema de Moss. [57]
En 1927, Landsteiner, que se había trasladado al Instituto Rockefeller de Investigación Médica en Nueva York, y como miembro de un comité del Consejo Nacional de Investigación preocupado por la agrupación sanguínea, sugirió sustituir los sistemas de Janský y Moss por las letras O, A, B y AB, introducidas por primera vez por el médico polaco Ludwik Hirszfeld y el médico alemán Emil von Dungern . [58] Hubo otra confusión sobre el uso de O que se introdujo en 1910. [59] Nunca estuvo claro si se refería a la cifra 0, la palabra alemana null para cero o la letra mayúscula O para ohne , que significa sin; Landsteiner eligió esta última. [60]
En 1928, la Comisión Permanente de Normalización Biológica adoptó la propuesta de Landsteiner y declaró:
La Comisión se ha enterado con satisfacción de que, por iniciativa de la Organización de la Salud de la Sociedad de las Naciones, la nomenclatura propuesta por von Dungern y Hirszfeld para la clasificación de los grupos sanguíneos ha sido generalmente aceptada, y recomienda que esta nomenclatura se adopte para uso internacional de la siguiente manera: 0 AB AB. Para facilitar el cambio de la nomenclatura empleada hasta ahora, se sugiere lo siguiente:
- Jansky ....0(I) A(II) B(III) AB(IV)
- Musgo... O(IV) A(II) B(III) AB(I) [61]
Esta clasificación fue ampliamente aceptada y después de principios de la década de 1950 fue seguida universalmente. [62]
Hirszfeld y Dungern descubrieron la herencia de los tipos de sangre como genética mendeliana en 1910 y la existencia de subtipos de A en 1911. [59] [63] En 1927, Landsteiner, con Philip Levine , descubrió el sistema de grupos sanguíneos MN , [64] y el sistema P. [ 65] El desarrollo de la prueba de Coombs en 1945, [66] el advenimiento de la medicina transfusional y la comprensión de la enfermedad hemolítica ABO del recién nacido llevaron al descubrimiento de más grupos sanguíneos. A partir de octubre de 2024 [actualizar], la Sociedad Internacional de Transfusión de Sangre (ISBT) reconoce 47 grupos sanguíneos. [3]
Una creencia pseudocientífica popular en los países del este de Asia (especialmente en Japón y Corea del Sur [67] ) conocida como 血液型ketsuekigata / hyeoraekhyeong es que el tipo de sangre ABO de una persona predice su personalidad , carácter y compatibilidad con otros . [68] Los investigadores han establecido que no existe una base científica para la categorización de la personalidad según el tipo de sangre, y los estudios no han encontrado "una relación significativa entre la personalidad y el tipo de sangre, lo que hace que la teoría sea 'obsoleta' y concluye que no existe ninguna base para asumir que la personalidad es algo más que una asociación aleatoria con el tipo de sangre". [67]
Las diferentes distribuciones geográficas de la talasemia α, la deficiencia de G6PD, la ovalocitosis y el grupo sanguíneo Duffy-negativo son otros ejemplos del principio general de que diferentes poblaciones han desarrollado diferentes variantes genéticas para protegerse contra la malaria.
Como la sangre Rh negativa es poco común entre los nacionales locales, este Acuerdo será de particular valor para los expatriados y viajeros Rh negativos.