
La síntesis enantioselectiva , también llamada síntesis asimétrica , [1] es una forma de síntesis química . La IUPAC la define como "una reacción química (o secuencia de reacciones) en la que se forman uno o más elementos nuevos de quiralidad en una molécula de sustrato y que produce los productos estereoisoméricos ( enantioméricos o diastereoméricos ) en cantidades desiguales ". [2]
En términos más simples: es la síntesis de un compuesto mediante un método que favorece la formación de un enantiómero o diastereómero específico. Los enantiómeros son estereoisómeros que tienen configuraciones opuestas en cada centro quiral. Los diastereoisómeros son estereoisómeros que difieren en uno o más centros quirales.
La síntesis enantioselectiva es un proceso clave en la química moderna y es particularmente importante en el campo de los productos farmacéuticos , ya que los diferentes enantiómeros o diastereómeros de una molécula a menudo tienen diferente actividad biológica .
Muchos de los componentes básicos de los sistemas biológicos, como los azúcares y los aminoácidos , se producen exclusivamente como un enantiómero . Como resultado, los sistemas vivos poseen un alto grado de quiralidad química y, a menudo, reaccionan de manera diferente con los diversos enantiómeros de un compuesto determinado. Algunos ejemplos de esta selectividad incluyen:
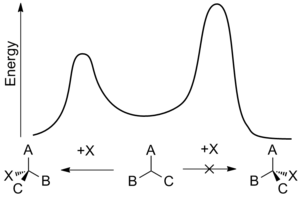
Como tal, la síntesis enantioselectiva es de gran importancia, pero también puede ser difícil de lograr. Los enantiómeros poseen entalpías y entropías idénticas y, por lo tanto, deben producirse en cantidades iguales mediante un proceso no dirigido, lo que conduce a una mezcla racémica . La síntesis enantioselectiva se puede lograr utilizando una característica quiral que favorece la formación de un enantiómero sobre otro a través de interacciones en el estado de transición . Este sesgo se conoce como inducción asimétrica y puede involucrar características quirales en el sustrato , reactivo , catalizador o entorno [9] y funciona haciendo que la energía de activación requerida para formar un enantiómero sea menor que la del enantiómero opuesto. [10]
La enantioselectividad suele estar determinada por las velocidades relativas de un paso de enantiodiferenciación, es decir, el punto en el que un reactivo puede convertirse en cualquiera de los dos productos enantioméricos. La constante de velocidad , k , de una reacción es función de la energía de activación de la reacción, a veces denominada barrera de energía , y depende de la temperatura. Si se utiliza la energía libre de Gibbs de la barrera de energía, Δ G *, se obtiene que las velocidades relativas de resultados estereoquímicos opuestos a una temperatura dada, T , son:
Esta dependencia de la temperatura significa que la diferencia de velocidad y, por lo tanto, la enantioselectividad, es mayor a temperaturas más bajas. Como resultado, incluso pequeñas diferencias en la barrera de energía pueden producir un efecto notable.
La catálisis enantioselectiva (conocida tradicionalmente como "catálisis asimétrica") se realiza utilizando catalizadores quirales, que normalmente son complejos de coordinación quirales . La catálisis es eficaz para una gama más amplia de transformaciones que cualquier otro método de síntesis enantioselectiva. Los catalizadores metálicos quirales se vuelven casi invariablemente quirales mediante el uso de ligandos quirales , pero es posible generar complejos quirales-en-metal compuestos enteramente de ligandos aquirales . [11] [12] [13] La mayoría de los catalizadores enantioselectivos son eficaces en proporciones bajas de sustrato/catalizador. [14] [15] Dadas sus altas eficiencias, a menudo son adecuados para la síntesis a escala industrial, incluso con catalizadores costosos. [16] Un ejemplo versátil de síntesis enantioselectiva es la hidrogenación asimétrica , que se utiliza para reducir una amplia variedad de grupos funcionales .

El diseño de nuevos catalizadores está dominado por el desarrollo de nuevas clases de ligandos . Ciertos ligandos, a menudo denominados " ligandos privilegiados ", son eficaces en una amplia gama de reacciones; algunos ejemplos son BINOL , Salen y BOX . La mayoría de los catalizadores son eficaces solo para un tipo de reacción asimétrica. Por ejemplo, la hidrogenación asimétrica de Noyori con BINAP/Ru requiere una β-cetona, aunque otro catalizador, BINAP/diamina-Ru, amplía el alcance a α,β- alquenos y productos químicos aromáticos .
Un auxiliar quiral es un compuesto orgánico que se acopla al material de partida para formar un nuevo compuesto que luego puede experimentar reacciones diastereoselectivas a través de inducción asimétrica intramolecular. [17] [18] Al final de la reacción, el auxiliar se elimina, en condiciones que no causarán la racemización del producto. [19] Luego, normalmente se recupera para uso futuro.

Los auxiliares quirales deben utilizarse en cantidades estequiométricas para ser eficaces y requieren pasos sintéticos adicionales para añadir y eliminar el auxiliar. Sin embargo, en algunos casos la única metodología estereoselectiva disponible se basa en auxiliares quirales y estas reacciones tienden a ser versátiles y muy bien estudiadas, lo que permite el acceso más eficiente en términos de tiempo a productos enantioméricamente puros. [18] Además, los productos de las reacciones dirigidas por auxiliares son diastereómeros , lo que permite su fácil separación mediante métodos como la cromatografía en columna o la cristalización.
La biocatálisis hace uso de compuestos biológicos, que van desde enzimas aisladas hasta células vivas, para realizar transformaciones químicas. [20] [21] Las ventajas de estos reactivos incluyen ees muy altos y especificidad del reactivo, así como condiciones de operación suaves y bajo impacto ambiental . Los biocatalizadores se utilizan más comúnmente en la industria que en la investigación académica; [22] por ejemplo en la producción de estatinas . [23] Sin embargo, la alta especificidad del reactivo puede ser un problema, ya que a menudo requiere que se examine una amplia gama de biocatalizadores antes de encontrar un reactivo efectivo.
La organocatálisis se refiere a una forma de catálisis , donde la velocidad de una reacción química se incrementa por un compuesto orgánico que consiste en carbono , hidrógeno , azufre y otros elementos no metálicos. [24] [25] Cuando el organocatalizador es quiral , entonces se puede lograr una síntesis enantioselectiva; [26] [27] por ejemplo, varias reacciones de formación de enlaces carbono-carbono se vuelven enantioselectivas en presencia de prolina , siendo la reacción aldólica un excelente ejemplo. [28] La organocatálisis a menudo emplea compuestos naturales y aminas secundarias como catalizadores quirales; [29] estos son económicos y respetuosos con el medio ambiente , ya que no intervienen metales.
La síntesis de grupos quirales es uno de los métodos más simples y antiguos para la síntesis enantioselectiva. Un material de partida quiral fácilmente disponible se manipula mediante reacciones sucesivas, a menudo utilizando reactivos aquirales, para obtener la molécula objetivo deseada. Esto puede cumplir los criterios para la síntesis enantioselectiva cuando se crea una nueva especie quiral, como en una reacción S N 2 .

La síntesis de grupos quirales es especialmente atractiva para moléculas objetivo que tienen una quiralidad similar a la de un bloque de construcción de origen natural relativamente económico, como un azúcar o un aminoácido . Sin embargo, el número de reacciones posibles que puede experimentar la molécula es limitado y pueden requerirse rutas sintéticas tortuosas (por ejemplo, la síntesis total de oseltamivir ). Este enfoque también requiere una cantidad estequiométrica del material de partida enantiopuro , que puede ser costoso si no se encuentra en la naturaleza.
Los dos enantiómeros de una molécula poseen muchas de las mismas propiedades físicas (por ejemplo, punto de fusión , punto de ebullición , polaridad , etc.) y, por lo tanto, se comportan de manera idéntica entre sí. Como resultado, migrarán con un R f idéntico en cromatografía de capa fina y tendrán tiempos de retención idénticos en HPLC y GC . Sus espectros de RMN e IR son idénticos.
Esto puede dificultar mucho la determinación de si un proceso ha producido un único enantiómero (y, fundamentalmente, de qué enantiómero se trata), así como la separación de enantiómeros de una reacción que no ha sido 100 % enantioselectiva. Afortunadamente, los enantiómeros se comportan de manera diferente en presencia de otros materiales quirales y esto se puede aprovechar para permitir su separación y análisis.
Los enantiómeros no migran de forma idéntica en medios cromatográficos quirales, como cuarzo o medios estándar que han sido modificados quiralmente. Esto forma la base de la cromatografía en columna quiral , que se puede utilizar a pequeña escala para permitir el análisis mediante GC y HPLC , o a gran escala para separar materiales quiralmente impuros. Sin embargo, este proceso puede requerir una gran cantidad de material de empaquetamiento quiral, lo que puede resultar caro. Una alternativa común es utilizar un agente derivatizante quiral para convertir los enantiómeros en diastereómeros, de forma muy similar a los auxiliares quirales. Estos tienen diferentes propiedades físicas y, por lo tanto, se pueden separar y analizar utilizando métodos convencionales. En la espectroscopia de RMN de estereoisómeros se utilizan agentes derivatizantes quirales especiales conocidos como "agentes de resolución quiral" , que normalmente implican la coordinación con complejos de europio quirales como Eu(fod) 3 y Eu(hfc) 3 .
La separación y el análisis de los enantiómeros componentes de un fármaco racémico o de una sustancia farmacéutica se denominan análisis quiral [30] o análisis enantioselectivo . La técnica más frecuentemente empleada para llevar a cabo el análisis quiral implica procedimientos científicos de separación, específicamente métodos cromatográficos quirales [31] .
El exceso enantiomérico de una sustancia también se puede determinar mediante ciertos métodos ópticos. El método más antiguo para hacerlo es utilizar un polarímetro para comparar el nivel de rotación óptica del producto con un "estándar" de composición conocida. También es posible realizar espectroscopia ultravioleta-visible de estereoisómeros aprovechando el efecto Cotton .
Una de las formas más precisas de determinar la quiralidad de un compuesto es determinar su configuración absoluta mediante cristalografía de rayos X. Sin embargo, se trata de un proceso laborioso que requiere el cultivo de un monocristal adecuado.
En 1815, el físico francés Jean-Baptiste Biot demostró que ciertas sustancias químicas podían rotar el plano de un haz de luz polarizada, una propiedad llamada actividad óptica . [32] La naturaleza de esta propiedad siguió siendo un misterio hasta 1848, cuando Louis Pasteur propuso que tenía una base molecular originada a partir de alguna forma de disimetría , [33] [34] y el término quiralidad fue acuñado por Lord Kelvin un año después. [35] El origen de la quiralidad en sí fue finalmente descrito en 1874, cuando Jacobus Henricus van 't Hoff y Joseph Le Bel propusieron independientemente la geometría tetraédrica del carbono. [36] [37] Los modelos estructurales anteriores a este trabajo habían sido bidimensionales, y van 't Hoff y Le Bel teorizaron que la disposición de los grupos alrededor de este tetraedro podría dictar la actividad óptica del compuesto resultante a través de lo que se conoció como la regla de Le Bel-van 't Hoff .

En 1894, Hermann Emil Fischer describió el concepto de inducción asimétrica [39] , en el que atribuyó correctamente la formación selectiva de D -glucosa por las plantas a la influencia de sustancias ópticamente activas dentro de la clorofila. Fischer también realizó con éxito lo que ahora se consideraría el primer ejemplo de síntesis enantioselectiva, al alargar enantioselectivamente los azúcares mediante un proceso que eventualmente se convertiría en la síntesis de Kiliani-Fischer [40] .
La primera síntesis química enantioselectiva se atribuye con mayor frecuencia a Willy Marckwald , de la Universidad de Berlín , por una descarboxilación enantioselectiva catalizada por brucina del ácido 2-etil-2-metilmalónico descrita en 1904. [38] [41] Se produjo un ligero exceso de la forma levógira del producto de la reacción, el ácido 2-metilbutírico; como este producto también es un producto natural (por ejemplo, como una cadena lateral de lovastatina formada por su dicetido sintasa (LovF) durante su biosíntesis [42]) , este resultado constituye la primera síntesis total registrada con enantioselectividad, así como otras primicias (como señala Koskinen, primer "ejemplo de catálisis asimétrica , selección enantiotópica y organocatálisis "). [38] Esta observación también tiene importancia histórica, ya que en ese momento la síntesis enantioselectiva solo podía entenderse en términos de vitalismo . En ese momento, muchos químicos destacados, como Jöns Jacob Berzelius, argumentaron que los compuestos naturales y artificiales eran fundamentalmente diferentes y que la quiralidad era simplemente una manifestación de la "fuerza vital" que solo podía existir en compuestos naturales. [43] A diferencia de Fischer, Marckwald había realizado una reacción enantioselectiva sobre un material de partida aquiral y no natural , aunque con un organocatalizador quiral (tal como entendemos ahora esta química). [38] [44] [45]
El desarrollo de la síntesis enantioselectiva fue inicialmente lento, en gran parte debido a la gama limitada de técnicas disponibles para su separación y análisis. Los diastereómeros poseen diferentes propiedades físicas, lo que permite la separación por medios convencionales, sin embargo, en ese momento los enantiómeros solo podían separarse por resolución espontánea (donde los enantiómeros se separan al cristalizar) o resolución cinética (donde un enantiómero se destruye selectivamente). La única herramienta para analizar los enantiómeros era la actividad óptica utilizando un polarímetro , un método que no proporciona datos estructurales.
No fue hasta la década de 1950 que realmente comenzaron los grandes avances, impulsados en parte por químicos como RB Woodward y Vladimir Prelog , pero también por el desarrollo de nuevas técnicas. La primera de ellas fue la cristalografía de rayos X , que Johannes Bijvoet utilizó para determinar la configuración absoluta de un compuesto orgánico en 1951. [46] La cromatografía quiral fue introducida un año después por Dalgliesh, que utilizó la cromatografía en papel para separar los aminoácidos quirales. [47] Aunque Dalgliesh no fue el primero en observar tales separaciones, atribuyó correctamente la separación de enantiómeros a la retención diferencial por la celulosa quiral. Esto se amplió en 1960, cuando Klem y Reed informaron por primera vez del uso de gel de sílice modificado quiralmente para la separación por HPLC quiral . [48]

Si bien se sabía que los diferentes enantiómeros de un fármaco podían tener diferentes actividades, y Arthur Robertson Cushny [49] [50] realizó un trabajo inicial importante , esto no se tuvo en cuenta en el diseño y las pruebas iniciales de fármacos. Sin embargo, después del desastre de la talidomida , el desarrollo y la concesión de licencias de fármacos cambiaron drásticamente.
La talidomida, sintetizada por primera vez en 1953, se recetó ampliamente para las náuseas matutinas entre 1957 y 1962, pero pronto se descubrió que era gravemente teratogénica [51] y que acabó causando defectos congénitos en más de 10.000 bebés. El desastre llevó a muchos países a introducir normas más estrictas para la prueba y la autorización de medicamentos, como la Enmienda Kefauver-Harris (EE. UU.) y la Directiva 65/65/CEE1 (UE).
Las primeras investigaciones sobre el mecanismo teratogénico, realizadas con ratones, sugirieron que un enantiómero de la talidomida era teratogénico mientras que el otro poseía toda la actividad terapéutica. Esta teoría se demostró posteriormente que era incorrecta y ha sido reemplazada por un conjunto de investigaciones. [52] Sin embargo, planteó la importancia de la quiralidad en el diseño de fármacos, lo que condujo a un aumento de la investigación sobre la síntesis enantioselectiva.
Las reglas de prioridad de Cahn-Ingold-Prelog (a menudo abreviadas como sistema CIP ) se publicaron por primera vez en 1966, lo que permitió que los enantiómeros se describieran con mayor facilidad y precisión. [53] [54] El mismo año se produjo la primera separación enantiomérica exitosa mediante cromatografía de gases [55], un avance importante ya que la tecnología era de uso común en ese momento.
La síntesis enantioselectiva catalizada por metales fue iniciada por William S. Knowles , Ryōji Noyori y K. Barry Sharpless ; por la cual recibirían el Premio Nobel de Química en 2001. Knowles y Noyori comenzaron con el desarrollo de la hidrogenación asimétrica , que desarrollaron de forma independiente en 1968. Knowles reemplazó los ligandos de trifenilfosfina aquirales en el catalizador de Wilkinson con ligandos de fosfina quirales . Este catalizador experimental se empleó en una hidrogenación asimétrica con un modesto exceso enantiomérico del 15% . Knowles también fue el primero en aplicar la catálisis enantioselectiva de metales a la síntesis a escala industrial; mientras trabajaba para la Compañía Monsanto , desarrolló un paso de hidrogenación enantioselectiva para la producción de L-DOPA , utilizando el ligando DIPAMP . [56] [57] [58]
Noyori ideó un complejo de cobre utilizando un ligando de base de Schiff quiral , que utilizó para la ciclopropanación metal-carbenoide del estireno . [59] En común con los hallazgos de Knowles, los resultados de Noyori para el exceso enantiomérico para este ligando de primera generación fueron decepcionantemente bajos: 6%. Sin embargo, la investigación continua finalmente condujo al desarrollo de la reacción de hidrogenación asimétrica de Noyori .
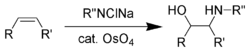
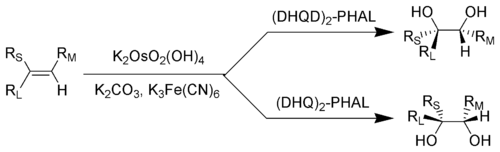
Sharpless complementó estas reacciones de reducción desarrollando una gama de oxidaciones asimétricas ( epoxidación de Sharpless , [60] dihidroxilación asimétrica de Sharpless , [61] oxiaminación de Sharpless [62] ) durante los años 1970 y 1980. La reacción de oxiaminación asimétrica, utilizando tetróxido de osmio , fue la primera.
Durante el mismo período, se desarrollaron métodos para permitir el análisis de compuestos quirales por RMN , ya sea utilizando agentes derivatizantes quirales, como el ácido de Mosher , [63] o reactivos de desplazamiento basados en europio , de los cuales Eu(DPM) 3 fue el primero. [64]
Los auxiliares quirales fueron introducidos por EJ Corey en 1978 [65] y ocuparon un lugar destacado en el trabajo de Dieter Enders . Casi al mismo tiempo se desarrolló la organocatálisis enantioselectiva, con trabajos pioneros que incluían la reacción de Hajos-Parrish-Eder-Sauer-Wiechert . Las reacciones enantioselectivas catalizadas por enzimas se volvieron cada vez más comunes durante la década de 1980, [66] particularmente en la industria, [67] con sus aplicaciones que incluyen la hidrólisis asimétrica de ésteres con esterasa de hígado de cerdo . La tecnología emergente de la ingeniería genética ha permitido la adaptación de enzimas a procesos específicos, lo que permite una mayor variedad de transformaciones selectivas. Por ejemplo, en la hidrogenación asimétrica de precursores de estatinas . [23]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )