En química , la racemización es una conversión, por calor o por reacción química, de un compuesto ópticamente activo en una forma racémica (ópticamente inactiva). Esto crea una relación molar de 1:1 de enantiómeros y se conoce como una mezcla racémica (es decir, contiene la misma cantidad de formas (+) y (−)). Las formas más y menos se denominan dextrorrotación y levorrotación . [1] Los enantiómeros D y L están presentes en cantidades iguales, la muestra resultante se describe como una mezcla racémica o un racemato. La racemización puede proceder a través de varios mecanismos diferentes y tiene particular importancia en farmacología, ya que diferentes enantiómeros pueden tener diferentes efectos farmacéuticos.
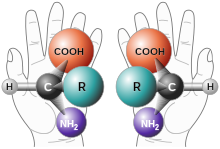
Las moléculas quirales tienen dos formas (en cada punto de asimetría), que difieren en sus características ópticas: la forma levógira (la forma (−) ) rotará en sentido antihorario en el plano de polarización de un haz de luz, mientras que la forma dextrógira (la forma (+) ) rotará en el sentido de las agujas del reloj en el plano de polarización de un haz de luz. [1] Se dice que las dos formas, que no son superponibles cuando se rotan en un espacio tridimensional, son enantiómeros . La notación no debe confundirse con la denominación D y L de moléculas que se refiere a la similitud en la estructura con D -gliceraldehído y L -gliceraldehído. Además, ( R )- y ( S )- se refieren a la estructura química de la molécula basada en las reglas de prioridad de denominación de Cahn-Ingold-Prelog en lugar de la rotación de la luz. La notación R/S es la notación principal utilizada para +/- ahora porque la notación D y L se utilizan principalmente para azúcares y aminoácidos. [2]
La racemización se produce cuando una forma pura de un enantiómero se convierte en una proporción igual de ambos enantiómeros, formando un racemato . Cuando hay un número igual de moléculas dextrógiras y levógiras, la rotación óptica neta de un racemato es cero. Los enantiómeros también deben distinguirse de los diastereómeros , que son un tipo de estereoisómero que tienen diferentes estructuras moleculares alrededor de un estereocentro y no son imágenes especulares.
La racemización parcial o completa de la estereoquímica en soluciones es resultado de mecanismos SN1 . Sin embargo, cuando ocurre una inversión completa de la configuración estereoquímica en una reacción de sustitución , la responsable es una reacción SN2 . [3]
En estado sólido, las mezclas racémicas pueden tener propiedades físicas diferentes a las de los enantiómeros puros debido a las interacciones intermoleculares diferenciales (ver la sección Importancia biológica). El cambio de un enantiómero puro a un racemato puede cambiar su densidad, punto de fusión, solubilidad, calor de fusión, índice de refracción y sus diversos espectros. La cristalización de un racemato puede dar como resultado formas (+) y (−) separadas, o un único compuesto racémico. Sin embargo, en estado líquido y gaseoso, las mezclas racémicas se comportarán con propiedades físicas que son idénticas, o casi idénticas, a sus enantiómeros puros . [4]
En general, la mayoría de las reacciones bioquímicas son estereoselectivas, por lo que solo un estereoisómero producirá el producto deseado mientras que el otro simplemente no participa o puede causar efectos secundarios. Cabe destacar que la forma L de los aminoácidos y la forma D de los azúcares (principalmente glucosa) suelen ser las formas biológicamente reactivas. Esto se debe al hecho de que muchas moléculas biológicas son quirales y, por lo tanto, las reacciones entre enantiómeros específicos producen estereoisómeros puros. [5] También es notable el hecho de que todos los residuos de aminoácidos existen en la forma L. Sin embargo, las bacterias producen residuos de aminoácidos D que se polimerizan en polipéptidos cortos que se pueden encontrar en las paredes celulares bacterianas. Estos polipéptidos son menos digeribles por las peptidasas y son sintetizados por enzimas bacterianas en lugar de la traducción del ARNm que normalmente produciría L -aminoácidos. [5]
La naturaleza estereoselectiva de la mayoría de las reacciones bioquímicas implica que los diferentes enantiómeros de una sustancia química pueden tener diferentes propiedades y efectos en una persona. Muchos fármacos psicotrópicos muestran diferente actividad o eficacia entre isómeros, por ejemplo, la anfetamina se suele dispensar en forma de sales racémicas, mientras que la dextroanfetamina, más activa , se reserva para casos refractarios o indicaciones más graves; otro ejemplo es la metadona , de la cual un isómero tiene actividad como agonista opioide y el otro como antagonista de NMDA . [6]
La racemización de fármacos farmacéuticos puede ocurrir in vivo . La talidomida como enantiómero ( R ) es eficaz contra las náuseas matutinas , mientras que el enantiómero ( S ) es teratogénico y causa defectos de nacimiento cuando se toma en el primer trimestre del embarazo. Si solo se administra un enantiómero a un sujeto humano, ambas formas pueden encontrarse más tarde en el suero sanguíneo. [7] Por lo tanto, el fármaco no se considera seguro para su uso por parte de mujeres en edad fértil y, aunque tiene otros usos, su uso está estrictamente controlado. [8] [9] La talidomida se puede utilizar para tratar el mieloma múltiple . [10]
Otro fármaco de uso común es el ibuprofeno , que solo es antiinflamatorio como un enantiómero, mientras que el otro es biológicamente inerte. Asimismo, el estereoisómero ( S ) es mucho más reactivo que el enantiómero ( R ) en citalopram (Celexa), un antidepresivo que inhibe la recaptación de serotonina, que es activo. [11] [5] [12] Por lo tanto, la estabilidad configuracional de un fármaco es un área de interés en la investigación farmacéutica. [13] La producción y el análisis de enantiómeros en la industria farmacéutica se estudia en el campo de la síntesis orgánica quiral.
La racemización se puede lograr simplemente mezclando cantidades iguales de dos enantiómeros puros. La racemización también puede ocurrir en una interconversión química. Por ejemplo, cuando ( R )-3-fenil-2- butanona se disuelve en etanol acuoso que contiene NaOH o HCl , se forma un racemato. La racemización ocurre por medio de una forma enólica intermedia en la que el antiguo estereocentro se vuelve planar y, por lo tanto, aquiral. [14] : 373 Un grupo entrante puede aproximarse desde cualquier lado del plano, por lo que existe una probabilidad igual de que la protonación de regreso a la cetona quiral produzca una forma R o S , lo que resulta en un racemato.
La racemización puede ocurrir a través de algunos de los siguientes procesos:
La tasa de racemización (de formas L a una mezcla de formas L y D ) se ha utilizado como método para datar muestras biológicas en tejidos con tasas de recambio lentas, muestras forenses y fósiles en depósitos geológicos. Esta técnica se conoce como datación de aminoácidos .
En 1843, Louis Pasteur descubrió la actividad óptica del ácido paratartárico, o racémico, presente en el vino de uva. Fue capaz de separar dos cristales enantiómeros que hacían girar la luz polarizada en direcciones opuestas. [11]