
El punto de ebullición de una sustancia es la temperatura a la que la presión de vapor de un líquido es igual a la presión que rodea al líquido [1] [2] y el líquido se convierte en vapor.
El punto de ebullición de un líquido varía dependiendo de la presión ambiental circundante. Un líquido en vacío parcial , es decir, a menor presión, tiene un punto de ebullición menor que cuando ese líquido está a presión atmosférica . Debido a esto, el agua hierve a 100 °C (o con precisión científica: 99,97 °C (211,95 °F)) bajo presión estándar al nivel del mar, pero a 93,4 °C (200,1 °F) a 1.905 metros (6.250 pies) [ 3] altitud. Para una presión determinada, diferentes líquidos hervirán a diferentes temperaturas.
El punto de ebullición normal (también llamado punto de ebullición atmosférico o punto de ebullición a presión atmosférica ) de un líquido es el caso especial en el que la presión de vapor del líquido es igual a la presión atmosférica definida al nivel del mar, una atmósfera . [4] [5] A esa temperatura, la presión de vapor del líquido se vuelve suficiente para superar la presión atmosférica y permitir que se formen burbujas de vapor dentro de la mayor parte del líquido. El punto de ebullición estándar ha sido definido por la IUPAC desde 1982 como la temperatura a la que se produce la ebullición bajo una presión de un bar . [6]
El calor de vaporización es la energía necesaria para transformar una cantidad determinada (un mol, kg, libra, etc.) de una sustancia de líquido a gas a una presión determinada (a menudo presión atmosférica).
Los líquidos pueden convertirse en vapor a temperaturas inferiores a sus puntos de ebullición mediante el proceso de evaporación . La evaporación es un fenómeno superficial en el que las moléculas ubicadas cerca del borde del líquido, no contenidas por suficiente presión del líquido en ese lado, escapan al entorno en forma de vapor . Por otro lado, la ebullición es un proceso en el que moléculas de cualquier parte del líquido escapan, lo que da como resultado la formación de burbujas de vapor dentro del líquido.
Un líquido saturado contiene tanta energía térmica como puede sin hervir (o por el contrario, un vapor saturado contiene tan poca energía térmica como puede sin condensarse ).
La temperatura de saturación significa punto de ebullición . La temperatura de saturación es la temperatura para una presión de saturación correspondiente a la que un líquido hierve hasta su fase de vapor . Se puede decir que el líquido está saturado de energía térmica . Cualquier adición de energía térmica produce una transición de fase .
Si la presión en un sistema permanece constante ( isobárica ), un vapor a temperatura de saturación comenzará a condensarse en su fase líquida a medida que se elimina energía térmica ( calor ). De manera similar, un líquido a temperatura y presión de saturación hervirá hasta su fase de vapor a medida que se aplica energía térmica adicional.
El punto de ebullición corresponde a la temperatura a la que la presión de vapor del líquido es igual a la presión ambiental circundante. Por tanto, el punto de ebullición depende de la presión. Los puntos de ebullición pueden publicarse con respecto a la presión estándar NIST, EE. UU. de 101,325 kPa (o 1 atm ), o la presión estándar IUPAC de 100,000 kPa. En elevaciones más altas, donde la presión atmosférica es mucho menor, el punto de ebullición también es menor. El punto de ebullición aumenta con el aumento de presión hasta el punto crítico , donde las propiedades del gas y del líquido se vuelven idénticas. El punto de ebullición no puede aumentarse más allá del punto crítico. Asimismo, el punto de ebullición disminuye al disminuir la presión hasta alcanzar el punto triple . El punto de ebullición no puede reducirse por debajo del punto triple.
Si se conocen el calor de vaporización y la presión de vapor de un líquido a una determinada temperatura, el punto de ebullición se puede calcular utilizando la ecuación de Clausius-Clapeyron , así:
dónde:
La presión de saturación es la presión para una temperatura de saturación correspondiente a la que un líquido hierve y pasa a su fase de vapor. La presión de saturación y la temperatura de saturación tienen una relación directa: a medida que aumenta la presión de saturación, también aumenta la temperatura de saturación.
Si la temperatura en un sistema permanece constante (un sistema isotérmico ), el vapor a presión y temperatura de saturación comenzará a condensarse en su fase líquida a medida que aumenta la presión del sistema. De manera similar, un líquido a presión y temperatura de saturación tenderá a pasar a su fase de vapor a medida que disminuye la presión del sistema.
Existen dos convenciones con respecto al punto de ebullición estándar del agua : El punto de ebullición normal es 99,97 °C (211,9 °F ) a una presión de 1 atm (es decir, 101,325 kPa). El punto de ebullición estándar del agua recomendado por la IUPAC a una presión estándar de 100 kPa (1 bar) [7] es 99,61 °C (211,3 °F ). [6] [8] A modo de comparación, en la cima del Monte Everest , a 8.848 m (29.029 pies) de altura, la presión es de aproximadamente 34 kPa (255 Torr ) [9] y el punto de ebullición del agua es 71 °C (160 ° F ). La escala de temperatura Celsius estuvo definida hasta 1954 por dos puntos: 0 °C definido por el punto de congelación del agua y 100 °C definido por el punto de ebullición del agua a presión atmosférica estándar.
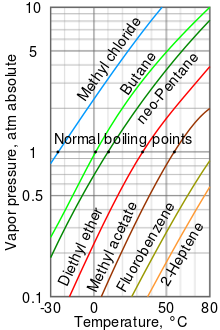
Cuanto mayor sea la presión de vapor de un líquido a una temperatura determinada, menor será el punto de ebullición normal (es decir, el punto de ebullición a presión atmosférica) del líquido.
La tabla de presión de vapor a la derecha tiene gráficos de las presiones de vapor versus temperaturas para una variedad de líquidos. [10] Como se puede ver en el gráfico, los líquidos con las presiones de vapor más altas tienen los puntos de ebullición normales más bajos.
Por ejemplo, a cualquier temperatura determinada, el cloruro de metilo tiene la presión de vapor más alta de todos los líquidos del cuadro. También tiene el punto de ebullición normal más bajo (-24,2 °C), que es donde la curva de presión de vapor del cloruro de metilo (la línea azul) se cruza con la línea de presión horizontal de una atmósfera ( atm ) de presión de vapor absoluta.
El punto crítico de un líquido es la temperatura (y presión) más alta a la que realmente hervirá.
Véase también Presión de vapor del agua .
El elemento con menor punto de ebullición es el helio . Tanto el punto de ebullición del renio como del tungsteno superan los 5000 K a presión estándar ; Debido a que es difícil medir temperaturas extremas con precisión y sin sesgos, ambas han sido citadas en la literatura por tener puntos de ebullición más altos. [11]
Como se puede ver en el gráfico anterior del logaritmo de la presión de vapor frente a la temperatura de cualquier compuesto químico puro , su punto de ebullición normal puede servir como una indicación de la volatilidad general de ese compuesto . Un compuesto puro determinado tiene sólo un punto de ebullición normal, si lo hay, y el punto de ebullición normal y el punto de fusión de un compuesto pueden servir como propiedades físicas características de ese compuesto, enumeradas en los libros de referencia. Cuanto mayor sea el punto de ebullición normal de un compuesto, menos volátil será en general y, a la inversa, cuanto menor sea el punto de ebullición normal de un compuesto, más volátil será en general. Algunos compuestos se descomponen a temperaturas más altas antes de alcanzar su punto de ebullición normal o, a veces, incluso su punto de fusión. Para un compuesto estable, el punto de ebullición va desde su punto triple hasta su punto crítico , dependiendo de la presión externa. Más allá de su punto triple, el punto de ebullición normal de un compuesto, si lo hay, es más alto que su punto de fusión. Más allá del punto crítico, las fases líquida y de vapor de un compuesto se fusionan en una sola fase, que puede denominarse gas sobrecalentado. A cualquier temperatura dada, si el punto de ebullición normal de un compuesto es más bajo, entonces ese compuesto generalmente existirá como un gas a presión externa atmosférica. Si el punto de ebullición normal del compuesto es más alto, entonces ese compuesto puede existir como líquido o sólido a esa temperatura dada a la presión externa atmosférica y, por lo tanto, existirá en equilibrio con su vapor (si es volátil) si sus vapores están contenidos. Si los vapores de un compuesto no están contenidos, algunos compuestos volátiles pueden eventualmente evaporarse a pesar de sus puntos de ebullición más altos.
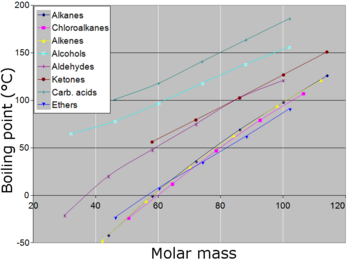
En general, los compuestos con enlaces iónicos tienen puntos de ebullición normales altos, si no se descomponen antes de alcanzar temperaturas tan altas. Muchos metales tienen puntos de ebullición elevados, pero no todos. Muy generalmente, en igualdad de condiciones con otros factores, en compuestos con moléculas unidas covalentemente , a medida que aumenta el tamaño de la molécula (o masa molecular ), aumenta el punto de ebullición normal. Cuando el tamaño molecular se vuelve muy grande, el compuesto a menudo se descompone a alta temperatura antes de alcanzar el punto de ebullición. Otro factor que afecta el punto de ebullición normal de un compuesto es la polaridad de sus moléculas. A medida que aumenta la polaridad de las moléculas de un compuesto, su punto de ebullición normal aumenta, siendo iguales los demás factores. Estrechamente relacionada está la capacidad de una molécula para formar enlaces de hidrógeno (en estado líquido), lo que dificulta que las moléculas abandonen el estado líquido y, por lo tanto, aumenta el punto de ebullición normal del compuesto. Los ácidos carboxílicos simples se dimerizan formando enlaces de hidrógeno entre moléculas. Un factor menor que afecta los puntos de ebullición es la forma de una molécula. Hacer que la forma de una molécula sea más compacta tiende a reducir ligeramente el punto de ebullición normal en comparación con una molécula equivalente con más superficie.
La mayoría de los compuestos volátiles (cualquier temperatura cercana a la ambiente) pasan por una fase líquida intermedia mientras se calientan desde una fase sólida para eventualmente transformarse en una fase de vapor. En comparación con la ebullición, una sublimación es una transformación física en la que un sólido se convierte directamente en vapor, lo que ocurre en algunos casos seleccionados, como con el dióxido de carbono a presión atmosférica. Para tales compuestos, un punto de sublimación es una temperatura a la cual un sólido que se convierte directamente en vapor tiene una presión de vapor igual a la presión externa.
En la sección anterior se cubrieron los puntos de ebullición de compuestos puros. Las presiones de vapor y los puntos de ebullición de las sustancias pueden verse afectados por la presencia de impurezas disueltas ( solutos ) u otros compuestos miscibles, dependiendo el grado del efecto de la concentración de las impurezas u otros compuestos. La presencia de impurezas no volátiles, como sales o compuestos de una volatilidad mucho menor que la del compuesto componente principal, disminuye su fracción molar y la volatilidad de la solución y, por lo tanto, aumenta el punto de ebullición normal en proporción a la concentración de los solutos. Este efecto se llama elevación del punto de ebullición . Como ejemplo común, el agua salada hierve a una temperatura más alta que el agua pura.
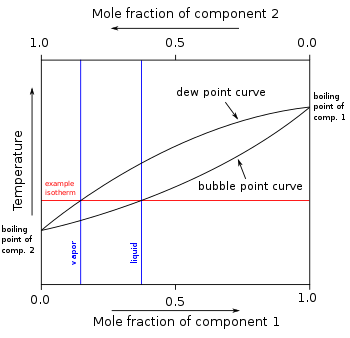
En otras mezclas de compuestos (componentes) miscibles, puede haber dos o más componentes de volatilidad variable, cada uno con su propio punto de ebullición de componente puro a cualquier presión determinada. La presencia de otros componentes volátiles en una mezcla afecta las presiones de vapor y, por tanto, los puntos de ebullición y los puntos de rocío de todos los componentes de la mezcla. El punto de rocío es la temperatura a la que un vapor se condensa en líquido. Además, a cualquier temperatura dada, la composición del vapor es diferente de la composición del líquido en la mayoría de estos casos. Para ilustrar estos efectos entre los componentes volátiles de una mezcla, comúnmente se utiliza un diagrama de punto de ebullición . La destilación es un proceso de ebullición y [normalmente] condensación que aprovecha estas diferencias de composición entre las fases líquida y vapor.