El experimento de la botella azul es una reacción química redox que cambia de color . Se prepara una solución acuosa que contiene glucosa , hidróxido de sodio y azul de metileno en un frasco cerrado que contiene un poco de aire. Al reposar, cambia espontáneamente de azul a incoloro debido a la reducción del azul de metileno por la solución de glucosa alcalina. Sin embargo, agitar la botella oxida el azul de metileno nuevamente a su forma azul. Si se agita más, este ciclo de cambio de color se puede repetir muchas veces. [1] Este experimento es una demostración de química clásica que se puede utilizar en cursos de laboratorio como un experimento de química general para estudiar la cinética química y el mecanismo de reacción . [2] La reacción también funciona con otros agentes reductores además de la glucosa [3] y otros colorantes indicadores redox además del azul de metileno. [4]
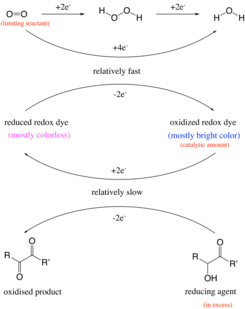
El mecanismo del experimento de la botella azul requiere una comprensión de las velocidades y mecanismos de reacciones químicas complejas que interactúan. En reacciones químicas complejas, las subreacciones individuales pueden ocurrir simultáneamente pero a velocidades significativamente diferentes. Estos, a su vez, pueden verse afectados por la concentración y la temperatura del reactivo . En la mayoría de los casos, la velocidad de reacción general está determinada por la reacción más rápida de un solo componente. Sin embargo, cuando algunos procesos forman moléculas intermedias que luego reaccionan en otros procesos para formar el producto final, la velocidad de la reacción general está determinada por la velocidad de la reacción más lenta. En tales circunstancias, los productos intermedios suelen estar en estado estacionario en concentraciones bajas porque son altamente reactivos. [7] El estado de equilibrio requiere que todos los mecanismos de reacción hacia adelante y hacia atrás ocurran al mismo ritmo. [8] Por lo tanto, la reacción neta general está determinada por la suma de todos los pasos del mecanismo donde la velocidad depende de la concentración y la temperatura. El experimento de la botella azul ilustra este principio de interacción de reacciones con diferentes velocidades. [4]
El experimento de la botella azul requiere sólo tres reactivos: solución de hidróxido de potasio , solución de dextrosa y solución diluida de azul de metileno . Estos reactivos se añaden a un matraz, se mezclan y se tapa el matraz. El color inicial de la solución es azul, pero al reposar durante un breve intervalo se desvanece espontáneamente hasta volverse incoloro, ya que la solución alcalina de dextrosa reduce el azul de metileno a azul de leucometileno incoloro. Agitar el matraz hace que el oxígeno presente en el aire del espacio superior se disuelva en la solución y oxide el azul de leucometileno nuevamente a su forma coloreada. [9] Otra variación utiliza azul de metileno en agua, glucosa y sosa cáustica ( NaOH ). [10] Hay muchas versiones del experimento, sin embargo, a diferencia de la versión clásica donde es necesario usar tinte como catalizador para la reacción, las versiones verde y rápida se someten a autooxidación incluso en ausencia del tinte. [11]
En el pasado, se pensaba que la reacción se producía mediante la oxidación de un grupo aldehído a un ácido carboxílico en condiciones alcalinas . Por ejemplo, la glucosa se oxidaría a gluconato por el oxígeno . [12] Sin embargo, el experimento también funciona con compuestos como la vitamina C y el benjuí , que no contienen un grupo aldehído. [4] Por lo tanto, la reacción es en realidad la oxidación de una aciloína o un grupo α - hidroxicarbonilo relacionado , que es una característica estructural de la glucosa, a una 1,2-dicetona . [13] El tinte redox reducido (estado incoloro) se forma a partir de tinte redox oxidado (azul). El cambio de color que se produce en el experimento de la botella azul tiene características de una reacción de reloj , en la que se produce repentinamente un cambio visible en la concentración de uno o más reactivos cuando se agota un reactivo limitante. Por ejemplo, el reactivo limitante, el oxígeno, es consumido por otro reactivo, el benjuí, con la ayuda de la safranina como catalizador. Una vez que se ha agotado la cantidad limitada de oxígeno, el catalizador no puede cambiar de forma y, como resultado, la solución cambia de color.
_is_consumed.jpg/440px-Air_(Oxygen)_is_consumed.jpg)
La solución acuosa de la reacción clásica contiene glucosa , hidróxido de sodio y azul de metileno . [14] En el primer paso se forma una aciloína de glucosa. El siguiente paso es una reacción redox de la aciloína con azul de metileno en la que la glucosa se oxida a dicetona en una solución alcalina [6] y el azul de metileno se reduce a azul de leucometileno incoloro. Si hay suficiente oxígeno disponible (es decir, después de agitar la botella), el azul de leucometileno se reoxida inmediatamente a azul de metileno y el color azul de la solución persiste. Sin embargo, cuando la solución se deja reposar, el oxígeno disuelto se consume gradualmente de manera irreversible [11] , y en el punto en que se ha agotado por completo, la reducción de la glucosa del azul de metileno continúa sin oposición y el color de la solución desaparece rápidamente. [15] La reacción es de primer orden en glucosa, azul de metileno e ion hidróxido y de orden cero en oxígeno. El proceso puede describirse como una reacción de pseudoprimer orden y puede usarse para ilustrar las concentraciones cambiantes de los reactivos durante el transcurso de la reacción a medida que la solución cambia de azul a incolora. [1]
Los productos finales de oxidación de la glucosa, además del gluconato de sodio, se han identificado como D -arabino-hexos-2-ulosa ( glucosona ), el anión del D -arabinonato después de la separación de un anión formiato y ácido arabinónico. [13]
Wellman y Noble propusieron una nueva formulación para el experimento de la Botella Azul en la que la vitamina C sirve como agente reductor en lugar de glucosa; Todavía se utilizan el azul de metileno y el oxígeno. [16] Se añade cobre como catalizador para la reoxidación del azul de leucometileno a azul de metileno . Estas modificaciones dan como resultado un experimento que genera una menor cantidad de desechos, que es menos corrosivo y más fácil de neutralizar y, por lo tanto, es un ejemplo de modificación de la química verde . [17]
La autooxidación del benjuí realizada por Chen [18] había realizado un experimento similar con respecto a las versiones clásica y verde. Se ha descubierto que los experimentos del semáforo y del San Valentín desaparecido pueden tener éxito independientemente de si se les añade azúcar. Una variación es más rápida, y el número de ciclos de cambio de color no dura tanto como las versiones clásica y verde porque los reactivos están presentes en cantidades más pequeñas; Además, el agente reductor para este experimento es el benjuí, que se agrega para ayudar a aumentar el número de ciclos en la solución. Además, el período útil en este experimento es bastante corto. Aunque el experimento se prepara durante la noche, el agente reductor se puede agregar en cualquier momento para poder observar más la solución. [19]
Zhang, Tsitkov y Hess de la Universidad de Columbia [20] propusieron una versión enzimática del "experimento de la botella azul". Lo llamaron "experimento de la botella verde", ya que el sistema es de color verde y los reactivos son más seguros que los métodos clásicos. El experimento se realiza en un vial de vidrio transparente que contiene dos enzimas comunes ( glucosa oxidasa y peroxidasa de rábano picante ), glucosa y ácido 2,2′-azino-bis(3-etilbenzotiazolina-6-sulfónico) (abreviado como ABTS) en tampón PBS. . Se utiliza una fina capa de aceite para bloquear la solución del aire. La solución inicialmente se vuelve verde y luego se vuelve incolora con el agotamiento del oxígeno disuelto. Al agitar la solución se introduce oxígeno fresco y la solución vuelve a colorearse de verde hasta que se consume el oxígeno.
Esta versión se basa en tres reacciones enzimáticas. Primero, la glucosa oxidasa cataliza la oxidación de la glucosa en presencia de oxígeno y produce peróxido de hidrógeno. En segundo lugar, la peroxidasa de rábano picante utiliza el peróxido de hidrógeno para oxidar el ABTS a su forma catiónica radical, ABTS +• . A medida que el oxígeno disuelto se consume en la solución, se produce la tercera reacción: la glucosa oxidasa cataliza la reducción de ABTS +• de nuevo a ABTS en presencia de glucosa. Este sistema también puede formar hermosos patrones que surgen de la convección de Rayleigh-Bénard impulsada por reacciones. [21]
Las reacciones químicas y el mecanismo del experimento de la botella azul se basan en la oxidación de un azúcar con la ayuda de aire y un tinte redox en una solución básica. Se ha informado que otras variaciones de esta reacción utilizan cuatro familias de colorantes redox : tiazinas , oxazinas , azinas e índigo carmín. Se ha informado que todos funcionan con glucosa y soda cáustica . [19]
El semáforo químico es una reacción redox que cambia de color y que está relacionada con el experimento de la botella azul . Una de las primeras fórmulas consta de glucosa , hidróxido de sodio , índigo carmín (tinte) y agua . Otra fórmula consta de índigo carmín , ácido ascórbico ( vitamina C ), bicarbonato de sodio , cloruro de sodio , sulfato de cobre (II) , hidróxido de sodio y agua . [17] Al hacerlo, se reducen los desechos químicos y el nivel de productos químicos corrosivos . La cantidad de sustancias químicas sólidas disueltas en el experimento se pudo reducir de 60 gramos a 6 gramos. Y el pH se puede reducir de 13 a 3, lo que es más fácil de neutralizar a 7 agregando bicarbonato de sodio antes de desecharlo. [16] Además, es más seguro y las reacciones también ocurren más rápido y son más fáciles de realizar.
Al principio, se añaden todos los productos químicos y el color aparece amarillo. Después de agitar, el color se vuelve verde y luego cambia a rojo cuando no se toca. Cuando se observa más a fondo, el color vuelve a ser amarillo, razón por la cual la solución se llama semáforo químico. Esta reacción se puede repetir muchas veces, pero necesita oxígeno adicional o índigo carmín .
Esta reacción ocurre por oxidación y reducción de la solución donde la solución de glucosa alcalina actúa como agente reductor . La solución de glucosa se agrega a la solución que contiene el indicador (tinte índigo carmín) y se producen cambios de color. Esta reacción también se conoce como experimento del reloj químico porque las concentraciones de los productos y reactivos cambiaron durante un período específico. [22] Cuando se agita la solución, el oxígeno se disuelve en la solución y oxida el índigo carmín. La solución se vuelve roja si se disuelve una pequeña cantidad de oxígeno y verde si se oxida todo el índigo carmín. [23] La solución volverá al color amarillo original cuando baje la concentración del nivel de oxígeno. [24]
El experimento del San Valentín desaparecido es otra reacción química relacionada con el experimento de la botella azul . Esta reacción ocurre cuando se mezclan en un matraz agua, glucosa , hidróxido de sodio y resazurina . Cuando se agita la solución, cambia de color azul claro a rojizo. La solución vuelve a tomar un color azul claro después de dejarla reposar durante un tiempo. Esta reacción se puede repetir varias veces. [25]
Después de mezclar todos los componentes, agite el frasco y el color se volverá rojo o rosado dependiendo de la cantidad de resazurina en la solución. Más resazurina hará que se necesite más tiempo para que la solución recupere el color y la intensidad del color rojo.
La reacción química estimula la glucosa para reducir la resazurina a resorufina. Luego se reduciría nuevamente a un compuesto incoloro llamado dihidroresorufina. Cuando se agita la dihidroresorufina, se oxida nuevamente a resorufina. Esto se debe al hecho de que al agitarlo, el oxígeno de la botella convierte la dihidroresorufina oxidada nuevamente en resorufina. [26]
En el experimento de la botella azul se descubrió que la erioglaucina , un colorante alimentario y un tinte redox, era un sustituto eficaz del azul de metileno. Dado que algunos dulces y bebidas como Gatorade contienen colorante y un azúcar reductor, solo es necesario agregar hidróxido de sodio para convertir estos productos alimenticios en una solución de botella azul. [27]
La tionina se puede utilizar en la versión verde del experimento en combinación con un catalizador de cobre/hierro para crear el matraz morado. [28]
La formación de patrones se produce cuando una solución que contiene NaOH, glucosa y colorante se vierte en una placa de Petri abierta a la atmósfera. [29] Esto dará como resultado que la solución cambie su estructura durante un período de tiempo. Las estructuras surgen del transporte molecular mediante difusión y cinética química . Los patrones formados en la placa de Petri pueden describirse como un patrón de mosaico; Espiral dinámica en forma de red, ramificación y líneas que se conectan entre sí. [30]
Los cambios en la formación de patrones no son homogéneos y pueden verse afectados por varios factores. Diferentes tipos de tinte en solución darán el mismo patrón debido a que la formación del enlace y la dinámica siguen siendo las mismas, esto se debe a que la solución tiene el mismo color que el tinte. Diferentes cantidades de tinte pueden provocar un cambio de densidad en la solución y esto provoca un cambio en el movimiento convectivo. Diferentes cantidades de tinte pueden producir diferentes cantidades de células convencionales que también están formadas por diferentes cantidades de glucosa y producto oxidado. Esto puede dar como resultado un fenómeno espacial interesante. El tiempo también puede afectar la formación de patrones. Con el paso del tiempo, un patrón se fue desvaneciendo gradualmente. Las espirales y ramas comenzaron a desaparecer y eventualmente desaparecieron por completo. Estos hechos indican que el oxígeno afecta la reacción química y esto juega un papel fundamental en la formación del patrón. La formación de patrones también puede deberse a una inestabilidad convectiva impulsada químicamente. Esto significa que la materia se intercambia a través de la interfaz aire-mezcla de reacción, debido a las fluctuaciones en la naturaleza molecular de los sistemas químicos. [31] La temperatura puede afectar la formación del patrón. [6] La temperatura más fría formó un patrón más claro que la temperatura caliente. La forma de la placa de Petri también contribuyó a la formación del patrón. [6]
Un grupo de investigadores de la Universidad de Glasgow llamado Pons, Batiste y Bees llegó a una pequeña conclusión sobre la formación de patrones en el sistema azul de metileno-glucosa. Llegaron a la conclusión concluyente de que se puede formar un patrón similar en un recipiente con oxígeno accesible. Este efecto de tensión superficial resultante no es necesario para producir inestabilidad. También se encontraron pequeños agujeros en la tapa del recipiente a los que el oxígeno no puede acceder, lo que da como resultado una cantidad fina, azul y menor de oxígeno. La longitud del patrón y la escala de tiempo se exploraron en uno de sus experimentos debido a la variación en la viscosidad y la profundidad del fluido. El experimento revela que la longitud de onda se forma a medida que un patrón comienza a formarse rápidamente. Entonces la longitud de onda o el patrón se pueden mantener u oscilar durante un tiempo. [32]
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )