La investigación sobre las lesiones de la médula espinal busca nuevas formas de curarlas o tratarlas para disminuir los efectos debilitantes de la lesión a corto o largo plazo. No existe cura para las LME y los tratamientos actuales se centran principalmente en la rehabilitación de las lesiones de la médula espinal y el manejo de los efectos secundarios de la afección. [1] Dos áreas principales de investigación incluyen la neuroprotección , formas de prevenir el daño a las células causado por procesos biológicos que tienen lugar en el cuerpo después de la lesión, y la neurorregeneración , la regeneración o reemplazo de los circuitos neuronales dañados.
La lesión secundaria ocurre minutos o semanas después de la lesión inicial e incluye una serie de procesos en cascada que dañan aún más los tejidos ya dañados por la lesión primaria. [2] Da como resultado la formación de una cicatriz glial, que impide el crecimiento axonal. [2] Las lesiones secundarias pueden ocurrir por diferentes formas de estrés agregado a la médula espinal en formas tales como contusiones adicionales, compresiones, torceduras o estiramientos de la médula espinal.
[3]
Las complicaciones de una lesión medular secundaria son resultado de un desequilibrio homeostático que puede provocar cambios metabólicos y hemostáticos a raíz de una respuesta inflamatoria. Los posibles efectos inmediatos de una lesión medular secundaria incluyen lesión neuronal, neuroinflamación, deterioro de la barrera hematoencefálica, disfunción isquémica, estrés oxidativo y complicaciones en las funciones de la vida diaria.
Los animales utilizados como organismos modelo de LME en la investigación incluyen ratones, ratas, gatos, perros, cerdos y primates no humanos; estos últimos son cercanos a los humanos pero plantean preocupaciones éticas sobre la experimentación con primates . [1] Existen dispositivos especiales para aplicar golpes de fuerza específica y monitoreada a la médula espinal de un animal experimental. [1] Existen varias clasificaciones de impacto mecánico de estas lesiones que se pueden replicar en un modelo animal. Esto incluye contusión, compresión, colagenasa y reperfusión de isquemia, distracción, dislocación y transección.
Las limitaciones de estos experimentos con modelos son comunes. Por ejemplo, la lesión medular por isquemia-reperfusión implica la interrupción del flujo sanguíneo a la médula espinal. Se ha observado que surgen complicaciones en modelos animales debido a la necesidad de pinzar la aorta.
Se han utilizado sillas de enfriamiento epidurales, colocadas quirúrgicamente sobre tejido de la médula espinal con traumatismo agudo, para evaluar los efectos potencialmente beneficiosos de la hipotermia localizada, con y sin glucocorticoides concomitantes . [4] [5]
En la actualidad, la cirugía se utiliza para proporcionar estabilidad a la columna vertebral lesionada o para aliviar la presión de la médula espinal. [1] [6] Cuánto tiempo después de la lesión se debe realizar una cirugía descompresiva es un tema controvertido, y ha sido difícil demostrar que una cirugía temprana proporciona mejores resultados en ensayos humanos. [1] Algunos sostienen que la cirugía temprana podría privar aún más de oxígeno a una médula espinal ya lesionada, pero la mayoría de los estudios no muestran diferencias en los resultados entre la cirugía temprana (dentro de los tres días) y la tardía (después de cinco días), y algunos muestran un beneficio de la cirugía temprana. [7]
En 2014, Darek Fidyka se sometió a una cirugía pionera de columna vertebral en la que se utilizaron injertos de nervios, de su tobillo, para "cerrar el hueco" en su médula espinal cortada y células de la envoltura olfatoria (OEC) para estimular las células de la médula espinal. La cirugía se realizó en Polonia en colaboración con el profesor Geoff Raisman, presidente de regeneración neuronal en el Instituto de Neurología del University College de Londres, y su equipo de investigación. Las OEC se extrajeron de los bulbos olfatorios del cerebro del paciente y luego se cultivaron en el laboratorio; luego, estas células se inyectaron por encima y por debajo del tejido espinal dañado. [8]
La neuroprotección tiene como objetivo prevenir el daño que se produce por una lesión secundaria. [2] Un ejemplo es apuntar a la proteína calpaína que parece estar involucrada en la apoptosis ; la inhibición de la proteína ha producido mejores resultados en ensayos con animales. [2] El hierro de la sangre daña la médula espinal a través del estrés oxidativo , por lo que una opción es utilizar un agente quelante para unir el hierro; los animales tratados de esta manera han mostrado mejores resultados. [2] El daño de los radicales libres por especies reactivas de oxígeno (ROS) es otro objetivo terapéutico que ha mostrado una mejora cuando se dirige a animales. [2] Un antibiótico, la minociclina , está bajo investigación en ensayos humanos por su capacidad para reducir el daño de los radicales libres, la excitotoxicidad , la alteración de la función mitocondrial y la apoptosis. [2] El riluzol, un anticonvulsivo, también se está investigando en ensayos clínicos por su capacidad para bloquear los canales de sodio en las neuronas, lo que podría prevenir el daño por excitotoxicidad. [2] Otros agentes potencialmente neuroprotectores que se encuentran bajo investigación en ensayos clínicos incluyen cetrina, eritropoyetina y dalfampridina . [2]
Un tratamiento experimental, la hipotermia terapéutica , se utiliza en el tratamiento, pero no hay evidencia de que mejore los resultados. [9] [10] Algunos tratamientos experimentales, incluida la hipotermia sistémica, se han realizado en casos aislados con el fin de llamar la atención sobre la necesidad de más estudios preclínicos y clínicos para ayudar a aclarar el papel de la hipotermia en la lesión aguda de la médula espinal. [11] A pesar de la financiación limitada, una serie de tratamientos experimentales, como el enfriamiento local de la columna y la estimulación de campo oscilante, han llegado a ensayos controlados en humanos. [12] [13]
La inflamación y la cicatriz glial se consideran factores inhibidores importantes de la neuroregeneración después de una lesión medular. Sin embargo, aparte de la metilprednisolona , ninguno de estos desarrollos ha alcanzado un uso siquiera limitado en la atención clínica de las lesiones de la médula espinal en humanos en los EE. UU. [14] La metilprednisolona se puede administrar poco después de la lesión, pero la evidencia de efectos secundarios nocivos supera a la de un beneficio. [6] Se están realizando investigaciones para encontrar mecanismos de administración más eficientes de la metilprednisolona que reducirían sus efectos nocivos. [1]
La neurorregeneración tiene como objetivo reconectar los circuitos rotos en la médula espinal para permitir que la función regrese. [2] Una forma es regenerar los axones, lo que ocurre espontáneamente en el sistema nervioso periférico . Sin embargo, la mielina en el sistema nervioso central contiene moléculas que impiden el crecimiento axonal; por lo tanto, estos factores son un objetivo para las terapias para crear un entorno propicio para el crecimiento. [2] Una de estas moléculas es Nogo-A , una proteína asociada con la mielina. Cuando esta proteína es atacada con anticuerpos inhibidores en modelos animales, los axones crecen mejor y se mejora la recuperación funcional. [2]
Las células madre son células que pueden diferenciarse para convertirse en diferentes tipos de células. [15] La esperanza es que las células madre trasplantadas en un área lesionada de la médula espinal permitan la neuroregeneración . [6] Los tipos de células que se están investigando para su uso en LME incluyen células madre embrionarias , células madre neurales , células madre mesenquimales , células envolventes olfativas , células de Schwann , macrófagos activados y células madre pluripotentes inducidas . [1] Cuando las células madre se inyectan en el área dañada en la médula espinal, secretan factores neurotróficos , y estos factores ayudan a las neuronas y los vasos sanguíneos a crecer, ayudando así a reparar el daño. [16] [17] [18] También es necesario recrear un entorno en el que las células madre crezcan. [19]
Un ensayo de fase 2 en curso en 2016 presentó datos [20] que mostraban que después de 90 días de tratamiento con células progenitoras de oligodendrocitos derivadas de células madre embrionarias, 4 de 4 sujetos con lesiones cervicales completas habían mejorado los niveles motores, con 2 de 4 mejorando dos niveles motores (en al menos un lado, con un paciente mejorando dos niveles motores en ambos lados). El punto final original del ensayo había sido 2/5 pacientes mejorando dos niveles en un lado en 6 a 12 meses. Los 8 sujetos cervicales en este ensayo de fase 1-2 habían mostrado puntuaciones motoras de las extremidades superiores (UEMS) mejoradas en relación con el inicio sin efectos secundarios adversos graves, y un ensayo de fase 1 de 2010 en 5 pacientes torácicos no ha encontrado problemas de seguridad después de 5 a 6 años de seguimiento.
Se esperan datos de eficacia de seis meses en enero de 2017; mientras tanto, se está investigando una dosis más alta y el estudio ahora también está reclutando pacientes con lesiones incompletas. [21]
En 2022, un equipo informó sobre las primeras [22] redes neuronales (motoras) humanas funcionales diseñadas derivadas de células madre pluripotentes inducidas (iPSC) del paciente para su implantación con el fin de regenerar la médula espinal lesionada , que muestran éxito en pruebas con ratones. [23] [24]
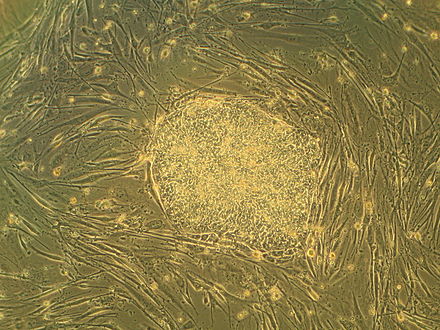
Las células madre embrionarias (CME) son pluripotentes ; pueden convertirse en cualquier tipo de célula de un organismo, como los oligodendrocitos ... [6] Se ha predicho que los oligodendrocitos y las neuronas motoras son un objetivo favorable para las CME en lo que respecta al tratamiento de trastornos y traumatismos neurológicos. [25] Después de que se produce una LME, hay evidencia de degradación de los oligodendrocitos, lo que finalmente conduce a la muerte celular. Esto da como resultado una falta de mielinización , que mejora las señales enviadas entre neuronas, lo que causa una disfunción en la señalización. Una posible solución podría ser el trasplante de oligodendrocitos derivados de células madre embrionarias; sin embargo, el éxito de este proceso depende de la capacidad de la célula para diferenciarse hacia tipos de células neuronales in vitro. Aquí es donde se están realizando más pruebas e investigaciones utilizando modelos animales.
Las células madre neurales (CMN) son multipotentes ; pueden diferenciarse en diferentes tipos de células neurales, ya sean neuronas o glía , a saber, oligodendrocitos y astrocitos . [15] La esperanza es que estas células, cuando se inyectan en una médula espinal lesionada, reemplacen las neuronas y oligodendrocitos muertos y secreten factores que apoyan el crecimiento. [1] Sin embargo, es posible que no se diferencien en neuronas cuando se trasplantan, ya sea permaneciendo indiferenciadas o convirtiéndose en glía. [15] En 2011, comenzaron los ensayos clínicos de fase I/II para implantar CMN en humanos con LME [1] y finalizaron en junio de 2015. [26]
Las células madre mesenquimales no necesitan provenir de fetos, por lo que se evitan las dificultades éticas; provienen de tejidos que incluyen la médula ósea, el tejido adiposo y el cordón umbilical . [1] A diferencia de otros tipos de células madre, las células mesenquimales no presentan la amenaza de formación de tumores o de desencadenar una respuesta del sistema inmunológico . [1] Los estudios en animales con inyección de células madre de médula ósea han demostrado una mejora en la función motora; sin embargo, no fue así en un ensayo en humanos un año después de la lesión. [1] Se están realizando más ensayos. [1] Las células madre del tejido adiposo y umbilical necesitan más estudios antes de que se puedan realizar ensayos en humanos, pero se iniciaron dos estudios coreanos para investigar las células adiposas en pacientes con LME. [1]
Se ha demostrado que el trasplante de tejidos como las células envolventes olfatorias de los bulbos olfatorios produce efectos beneficiosos en ratas con lesiones en la médula espinal. [27] Los ensayos también han comenzado a mostrar éxito cuando las células envolventes olfatorias se trasplantan en humanos con médulas espinales cortadas. [28] Las personas han recuperado la sensibilidad, el uso de músculos anteriormente paralizados y la función de la vejiga y los intestinos después de las cirugías, [29] por ejemplo, Darek Fidyka .
En 2006, unos investigadores japoneses descubrieron que añadir ciertos factores de transcripción a las células hacía que se volvieran pluripotentes y capaces de diferenciarse en múltiples tipos de células. [6] De esta manera, se podrían utilizar los propios tejidos del paciente, teóricamente debido a una menor probabilidad de rechazo del trasplante . [6]
En los últimos años se han utilizado diversas técnicas de ingeniería para mejorar la reparación de las lesiones de la médula espinal. El uso de biomateriales es un enfoque de ingeniería para el tratamiento de las lesiones de la médula espinal que se puede combinar con el trasplante de células madre. [6] Pueden ayudar a llevar células al área lesionada y crear un entorno que fomente su crecimiento. [6] La hipótesis general detrás de los biomateriales diseñados es que unir el sitio de la lesión utilizando un andamio que permita el crecimiento puede ayudar a que los axones crezcan y, por lo tanto, mejoren la función. Los biomateriales utilizados deben ser lo suficientemente fuertes como para proporcionar un soporte adecuado, pero lo suficientemente suaves como para no comprimir la médula espinal. [2] Deben degradarse con el tiempo para dejar paso al cuerpo para que vuelva a generar tejido. [2] Los tratamientos diseñados no inducen una respuesta inmunitaria como pueden hacerlo los tratamientos biológicos, y son fácilmente ajustables y reproducibles. Se ha demostrado que la administración in vivo de hidrogeles o nanofibras autoensamblables promueve la brotación axonal y la recuperación funcional parcial. [30] [31] Además, se ha demostrado que la administración de nanotubos de carbono aumenta la extensión del axón motor y disminuye el volumen de la lesión, sin inducir dolor neuropático . [32] Además, la administración de microfibras de ácido poliláctico ha demostrado que las señales de guía topográfica por sí solas pueden promover la regeneración axonal en el sitio de la lesión. [33] Sin embargo, todos estos enfoques indujeron una recuperación funcional o conductual modesta, lo que sugiere que es necesaria una mayor investigación.
Los hidrogeles son estructuras hechas de polímeros que están diseñados para ser similares a la matriz extracelular natural que rodea las células. [2] Se pueden utilizar para ayudar a administrar medicamentos de manera más eficiente a la médula espinal y para sostener las células, y se pueden inyectar en un área lesionada para rellenar una lesión. [2] Se pueden implantar en un sitio lesionado con medicamentos o factores de crecimiento en ellos para dar a los químicos el mejor acceso al área dañada y permitir una liberación sostenida. [2]
En noviembre de 2021, se informó sobre una nueva terapia para las lesiones de la médula espinal: un gel inyectable de nanofibras que imita la matriz que rodea las células y contiene moléculas diseñadas para moverse. Estas moléculas móviles se conectan con los receptores de las células, lo que provoca señales de reparación en el interior; en particular, conduce a un crecimiento vascular relativamente mayor, regeneración axonal, mielinización, supervivencia de las neuronas motoras, reducción de la gliosis y recuperación funcional, lo que permite a los ratones paralizados volver a caminar. [34] [35] [36]
La tecnología para crear exoesqueletos motorizados , maquinaria portátil que ayuda a caminar, está logrando avances significativos en la actualidad. Hay productos disponibles, como el Ekso, que permite a las personas con una lesión espinal completa de hasta C7 (o cualquier nivel de lesión incompleta) ponerse de pie y dar pasos con asistencia tecnológica. [37] El propósito inicial de esta tecnología es la rehabilitación funcional, pero a medida que la tecnología se desarrolle, también lo harán sus usos. [37]
La estimulación eléctrica funcional (EEF) utiliza descargas eléctricas coordinadas a los músculos para hacer que se contraigan en un patrón de caminata. [38] Si bien puede fortalecer los músculos, una desventaja significativa para los usuarios de EEF es que sus músculos se cansan después de un corto tiempo y distancia. [38] Una dirección de investigación combina EEF con exoesqueletos para minimizar las desventajas de ambas tecnologías, apoyando las articulaciones de la persona y utilizando los músculos para reducir la potencia necesaria de la máquina y, por lo tanto, su peso. [38] Un equipo de investigación de la Escuela de Ingeniería McKelvey de la Universidad de Washington en St. Louis , dirigido por el profesor asistente de ingeniería biomédica Ismael Seáñez, está lanzando un ensayo clínico de estimulación eléctrica de la médula espinal para ayudar a restaurar el movimiento en pacientes con problemas de movimiento o paralizados. [39]
Investigaciones recientes muestran que la combinación de la interfaz cerebro-computadora y la estimulación eléctrica funcional puede restaurar el control voluntario de músculos paralizados. Un estudio con monos mostró que es posible utilizar directamente órdenes del cerebro, evitando la médula espinal y permitiendo un control y una función limitada de las manos. [40]
Un estudio de 2016 desarrollado por el Walk Again Project con ocho parapléjicos demostró la recuperación neurológica con el uso de terapias basadas en el IMC, la realidad virtual y el uso de robots. Una paciente logró caminar con apoyos después de una década paralizada y otra logró llevar adelante un embarazo. [41] [42] [43] [44] [45]
Se están estudiando implantes de médula espinal, como los implantes e-dura, diseñados para su implantación en la superficie de la médula espinal, para la parálisis posterior a una lesión de la médula espinal. [46]
Los implantes e-dura están diseñados utilizando métodos de neurotecnología blanda , en los que se distribuyen electrodos y un sistema de administración de microfluidos a lo largo del implante espinal. [47] La estimulación química de la médula espinal se administra a través del canal de microfluidos del e-dura. Los implantes e-dura, a diferencia de los implantes de superficie anteriores, imitan de cerca las propiedades físicas del tejido vivo y pueden administrar impulsos eléctricos y sustancias farmacológicas simultáneamente. La duramadre artificial se construyó mediante la utilización de PDMS e hidrogel de gelatina. [47] El hidrogel simula el tejido espinal y una membrana de silicona simula la duramadre. Estas propiedades permiten que los implantes e-dura se mantengan en una aplicación a largo plazo en la médula espinal y el cerebro sin provocar inflamación, acumulación de tejido cicatricial y rechazo normalmente causados por los implantes de superficie que se frotan contra el tejido nervioso.
En 2018, dos equipos de investigación distintos de la Clínica Mayo de Minnesota y la Universidad de Louisville de Kentucky lograron restaurar algo de movilidad a pacientes que sufrían de paraplejia con un estimulador electrónico de la médula espinal. La teoría detrás del nuevo estimulador de la médula espinal es que en ciertos casos de lesión de la médula espinal, los nervios espinales entre el cerebro y las piernas todavía están vivos, pero solo inactivos. [48] El 1 de noviembre de 2018, un tercer equipo de investigación distinto de la Universidad de Lausana publicó resultados similares con una técnica de estimulación similar en la revista Nature . [49] [50] En 2022, los investigadores demostraron un estimulador de la médula espinal que permitió a los pacientes con lesión de la médula espinal volver a caminar mediante estimulación eléctrica epidural (EES) con un progreso sustancial de neurorrehabilitación durante el primer día. [51] [52] En un estudio publicado en mayo de 2023 en la revista Nature , investigadores de Suiza describieron implantes que permitieron a un hombre de 40 años, paralizado de la cadera hacia abajo durante 12 años, ponerse de pie, caminar y subir una rampa empinada con solo la ayuda de un andador. Más de un año después de la inserción del implante, ha conservado estas capacidades y caminaba con muletas incluso cuando el implante estaba apagado. [53]
Los estimuladores de la médula espinal y la fisioterapia intensa están ayudando a los pacientes parapléjicos a volver a aprender a caminar. Los estimuladores de la médula espinal pueden ayudar potencialmente a "despertar" los nervios inactivos.
Una nueva terapia que amplifica los impulsos nerviosos también puede ayudar al cuerpo a sanar