El síndrome del cromosoma X frágil ( SXF ) es un trastorno genético del desarrollo neurológico que se caracteriza por una discapacidad intelectual de leve a moderada . [1] El coeficiente intelectual promedio en los hombres con SXF es inferior a 55, mientras que aproximadamente dos tercios de las mujeres afectadas tienen discapacidad intelectual. [3] [4] Las características físicas pueden incluir una cara larga y estrecha , orejas grandes, dedos flexibles y testículos grandes . [1] Aproximadamente un tercio de los afectados tienen características del autismo, como problemas con las interacciones sociales y retraso en el habla. [1] La hiperactividad es común y las convulsiones ocurren en aproximadamente el 10 %. [1] Los hombres suelen verse más afectados que las mujeres. [1]
Este trastorno y el hallazgo del síndrome del cromosoma X frágil tiene una herencia dominante ligada al cromosoma X [1]. Por lo general, es causado por una expansión de la repetición del triplete CGG dentro del gen FMR1 (ribonucleoproteína 1 mensajera del cromosoma X frágil) en el cromosoma X. [1] Esto da como resultado el silenciamiento ( metilación ) de esta parte del gen y una deficiencia de la proteína resultante (FMRP), que es necesaria para el desarrollo normal de las conexiones entre las neuronas . [1] El diagnóstico requiere pruebas genéticas para determinar el número de repeticiones CGG en el gen FMR1 . [5] Normalmente, hay entre 5 y 40 repeticiones; el síndrome del cromosoma X frágil ocurre con más de 200. [1] Se dice que hay una premutación cuando el gen tiene entre 55 y 200 repeticiones; las mujeres con una premutación tienen un mayor riesgo de tener un hijo afectado. [1] Las pruebas para portadores de premutación pueden permitir el asesoramiento genético . [5]
No existe cura. [2] Se recomienda una intervención temprana, ya que brinda la mayor oportunidad para desarrollar una gama completa de habilidades. [6] Estas intervenciones pueden incluir educación especial , terapia del habla , fisioterapia o terapia conductual . [2] [7] Se pueden usar medicamentos para tratar las convulsiones asociadas , los problemas de humor, el comportamiento agresivo o el TDAH . [8] El síndrome del cromosoma X frágil tiende a mostrar más síntomas en los varones afectados, ya que las mujeres tienen otro cromosoma X que puede compensar el dañado. [4] [9]

La mayoría de los niños pequeños no muestran ningún signo físico de FXS. [10] No es hasta la pubertad que las características físicas de FXS comienzan a desarrollarse. [10] Aparte de la discapacidad intelectual, las características prominentes del síndrome pueden incluir una cara alargada, orejas grandes o salientes , pies planos, testículos más grandes ( macroorquidismo ) y bajo tono muscular . [11] [12] La otitis media recurrente (infección del oído medio) y la sinusitis son comunes durante la primera infancia. El habla puede ser confusa o nerviosa. Las características conductuales pueden incluir movimientos estereotipados (p. ej., aleteo de manos) y desarrollo social atípico, particularmente timidez, contacto visual limitado , problemas de memoria y dificultad con la codificación facial. Algunas personas con síndrome del cromosoma X frágil también cumplen los criterios de diagnóstico para el autismo . [13]
Los varones con una mutación completa muestran una penetrancia prácticamente completa y, por lo tanto, casi siempre mostrarán síntomas de FXS, mientras que las mujeres con una mutación completa generalmente muestran una penetrancia de alrededor del 50% como resultado de tener un segundo cromosoma X normal. [14] Las mujeres con FXS pueden tener síntomas que van de leves a graves, aunque generalmente se ven menos afectadas que los varones debido a la variabilidad en la inactivación del cromosoma X. [15] [16]
Las personas con SXF pueden presentar cualquier tipo de trastorno, desde discapacidades de aprendizaje en el contexto de un coeficiente intelectual (CI) normal hasta discapacidad intelectual grave , con un CI promedio de 40 en los hombres que tienen silenciamiento completo del gen FMR1 . [12] Las mujeres, que tienden a verse menos afectadas, generalmente tienen un CI que es normal o limítrofe con dificultades de aprendizaje. Las principales dificultades en las personas con SXF son con la memoria de trabajo y de corto plazo, la función ejecutiva , la memoria visual, las relaciones visoespaciales y las matemáticas, mientras que las habilidades verbales se ven relativamente poco afectadas. [12] [20]
Los datos sobre el desarrollo intelectual en el síndrome del X frágil son limitados. Sin embargo, hay cierta evidencia de que el coeficiente intelectual estandarizado disminuye con el tiempo en la mayoría de los casos, aparentemente como resultado de un desarrollo intelectual más lento. Un estudio longitudinal que analizó pares de hermanos en los que un niño estaba afectado y el otro no encontró que los niños afectados tuvieran una tasa de aprendizaje intelectual que fuera un 55% más lenta que los niños no afectados. [20]
Las personas con síndrome del X frágil a menudo presentan problemas de lenguaje y comunicación. [21] Esto puede estar relacionado con la función muscular de la boca y déficits del lóbulo frontal. [21]
El síndrome del cromosoma X frágil se presenta junto con el autismo en muchos casos y se sospecha que es una causa genética del autismo en estos casos. [11] [22] Este hallazgo ha dado lugar a que se considere obligatoria la detección de la mutación FMR1 en niños con diagnóstico de autismo. [11] Se ha estimado que la prevalencia del trastorno del espectro autista (TEA) concurrente en aquellos con síndrome del cromosoma X frágil es de entre el 15 y el 60 %, y la variación se debe a las diferencias en los métodos de diagnóstico y a la alta frecuencia de características autistas en individuos con síndrome del cromosoma X frágil que no cumplen los criterios del DSM para un TEA. [22]
Aunque las personas con SXF tienen dificultades para entablar amistades, las personas con SXF y TEA también suelen tener dificultades para conversar recíprocamente con sus pares. Las conductas de retraimiento social, como la evitación y la indiferencia, parecen ser los mejores predictores del TEA en el SXF, y la evitación parece estar más correlacionada con la ansiedad social, mientras que la indiferencia está más fuertemente correlacionada con el TEA. [22] Cuando están presentes tanto el autismo como el SXF, se observa un mayor déficit del lenguaje y un coeficiente intelectual más bajo en comparación con los niños que solo tienen SXF. [23]
También se ha demostrado que los modelos genéticos de ratones con síndrome del X frágil tienen comportamientos similares al autismo. [24] [25] [26] [27] [28]
El síndrome del X frágil se caracteriza por ansiedad social , que incluye un contacto visual deficiente, aversión a la mirada, tiempo prolongado para iniciar la interacción social y dificultades para establecer relaciones con los compañeros. [29] La ansiedad social es una de las características más comunes asociadas con el síndrome del X frágil, y hasta el 75 % de los hombres en una serie se caracteriza por tener una timidez excesiva y el 50 % por tener ataques de pánico. [22] La ansiedad social en individuos con síndrome del X frágil está relacionada con dificultades para codificar rostros, la capacidad de reconocer un rostro que uno ha visto antes. [30]
Parece que las personas con síndrome del X frágil están interesadas en la interacción social y muestran mayor empatía que los grupos con otras causas de discapacidad intelectual, pero muestran ansiedad y retraimiento cuando se las coloca en situaciones desconocidas con personas desconocidas. [22] [29] Esto puede variar desde un retraimiento social leve, que se asocia predominantemente con la timidez, hasta un retraimiento social severo, que puede estar asociado con un trastorno del espectro autista coexistente. [22]
Las mujeres con síndrome del X frágil suelen mostrar timidez, ansiedad social y evitación o retraimiento social. [12] Además, se ha descubierto que la premutación en mujeres está asociada con la ansiedad social.
Las mujeres con síndrome del X frágil muestran una activación reducida en las regiones prefrontales del cerebro. [31] [ cita requerida ]
El trastorno por déficit de atención con hiperactividad (TDAH) se presenta en la mayoría de los varones con SXF y en el 30 % de las mujeres, lo que lo convierte en el diagnóstico psiquiátrico más común en aquellos con SXF. [11] [29] Los niños con síndrome del cromosoma X frágil tienen períodos de atención muy cortos, son hiperactivos y muestran hipersensibilidad a los estímulos visuales, auditivos, táctiles y olfativos . Estos niños tienen dificultad en grandes multitudes debido a los ruidos fuertes y esto puede provocar rabietas debido a la hiperactivación . La hiperactividad y el comportamiento disruptivo alcanzan su punto máximo en los años preescolares y luego disminuyen gradualmente con la edad, aunque los síntomas de falta de atención generalmente duran toda la vida. [29]
Aparte de los rasgos característicos de la fobia social, hay una serie de otros síntomas de ansiedad que se asocian muy comúnmente con el síndrome del X frágil, y que suelen abarcar varios diagnósticos psiquiátricos, pero que no cumplen ninguno de los criterios en su totalidad. [29] Los niños con síndrome del X frágil se apartan del tacto suave y pueden encontrar irritantes las texturas de los materiales. Las transiciones de un lugar a otro pueden resultar difíciles para los niños con síndrome del X frágil. En algunos casos, se puede utilizar la terapia conductual para disminuir la sensibilidad del niño. [19] Conductas como agitar las manos y morder, así como la agresión, pueden ser una expresión de ansiedad. [ cita requerida ]
La perseverancia es una característica comunicativa y conductual común en el síndrome del X frágil. Los niños con síndrome del X frágil pueden repetir una determinada actividad ordinaria una y otra vez. En el habla, la tendencia no es solo repetir la misma frase, sino también hablar sobre el mismo tema continuamente. Es común observar un habla desordenada y un diálogo interno . El diálogo interno incluye hablar con uno mismo utilizando diferentes tonos y timbres. [19] Aunque solo una minoría de los casos de síndrome del X frágil cumplirán los criterios del trastorno obsesivo-compulsivo (TOC), una mayoría significativa tendrá síntomas de obsesión. Sin embargo, como las personas con síndrome del X frágil generalmente encuentran placenteras estas conductas, a diferencia de las personas con TOC, se las suele denominar conductas estereotipadas. [ cita requerida ]
Los síntomas del estado de ánimo en personas con síndrome del X frágil rara vez cumplen los criterios de diagnóstico de un trastorno del estado de ánimo importante, ya que normalmente no tienen una duración sostenida. [29] En cambio, suelen ser transitorios y estar relacionados con factores estresantes, y pueden implicar un estado de ánimo lábil (fluctuante), irritabilidad, autolesiones y agresión. [ cita requerida ]
Las personas con síndrome de temblor/ataxia asociado al cromosoma X frágil (FXTAS) tienen probabilidades de experimentar combinaciones de demencia , trastornos del estado de ánimo y de ansiedad . Se encontró que los varones con la premutación FMR1 y evidencia clínica de FXTAS tenían una mayor incidencia de somatización , trastorno obsesivo-compulsivo , sensibilidad interpersonal, depresión, ansiedad fóbica y psicoticismo . [32]
Los problemas oftalmológicos incluyen el estrabismo , que requiere una identificación temprana para evitar la ambliopía . Si el estrabismo se diagnostica a tiempo, suele ser necesario recurrir a la cirugía o a la colocación de un parche para tratarlo. Los errores de refracción en pacientes con síndrome del X frágil también son comunes. [23]
Las personas con síndrome del X frágil tienen un mayor riesgo de desarrollar convulsiones , con tasas entre el 10% y el 40% reportadas en la literatura. [33] En poblaciones de estudio más grandes, la frecuencia varía entre el 13% y el 18%, [12] [33] en consonancia con una encuesta reciente de cuidadores que encontró que el 14% de los hombres y el 6% de las mujeres experimentaron convulsiones. [33] Las convulsiones tienden a ser parciales , generalmente no son frecuentes y son susceptibles de tratamiento con medicación. [ cita requerida ]
Las personas portadoras de alelos de premutación corren el riesgo de desarrollar el síndrome de temblor/ataxia asociado al cromosoma X frágil (FXTAS), una enfermedad neurodegenerativa progresiva. [14] [34] Se observa en aproximadamente la mitad de los portadores varones mayores de 70 años, mientras que la penetrancia en las mujeres es menor. Por lo general, el inicio del temblor ocurre en la sexta década de la vida, con posterior progresión a ataxia (pérdida de coordinación) y deterioro cognitivo gradual. [34]
A partir de los 40 años, los varones con SXF comienzan a desarrollar problemas progresivamente más graves en la realización de tareas que requieren el ejecutivo central de la memoria de trabajo . La memoria de trabajo implica el almacenamiento temporal de información "en la mente", mientras se procesa la misma u otra información. La memoria fonológica (o memoria de trabajo verbal) se deteriora con la edad en los varones, mientras que la memoria visoespacial no está directamente relacionada con la edad. Los varones a menudo experimentan un deterioro en el funcionamiento del bucle fonológico . La longitud de CGG está significativamente correlacionada con el ejecutivo central y la memoria visoespacial. Sin embargo, en un individuo premutado, la longitud de CGG solo está significativamente correlacionada con el ejecutivo central, no con la memoria fonológica ni con la memoria visoespacial. [35]
Alrededor del 20% de las mujeres portadoras de la premutación del cromosoma X frágil se ven afectadas por insuficiencia ovárica primaria asociada al cromosoma X frágil (FXPOI), que se define como menopausia prematura , que es la menopausia que ocurre antes de los 40 años de edad (la edad promedio de la menopausia es de 51 años en los EE. UU.). [14] [34] El número de repeticiones CGG se correlaciona con la penetrancia y la edad de aparición, pero no es una relación lineal. [36] [14] Sin embargo, la menopausia prematura es más común en portadoras de la premutación que en mujeres con la mutación completa, y el mayor riesgo de FXPOI se observa en mujeres con entre 70 y 100 repeticiones. [37] [38] La FXPOI es uno de los tres trastornos asociados al cromosoma X frágil (FXD) causados por cambios en el gen FMR1. La FXPOI afecta a las mujeres portadoras de la premutación, causada por el gen FMR1, cuando sus ovarios no funcionan correctamente. Las mujeres con FXPOI pueden presentar cambios en los ciclos menstruales y en los niveles hormonales, pero no ser consideradas menopáusicas. Las mujeres con FXPOI aún tienen la posibilidad de quedar embarazadas en aproximadamente el 10% de los casos, porque sus ovarios ocasionalmente liberan óvulos viables a través de la ovulación de "escape". [39] [40]
FMRP es una proteína de unión a la cromatina que funciona en la respuesta al daño del ADN . [41] [42] FMRP también ocupa sitios en los cromosomas meióticos y regula la dinámica de la maquinaria de respuesta al daño del ADN durante la espermatogénesis . [41]
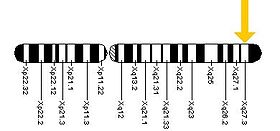
El síndrome del cromosoma X frágil es un trastorno genético que se produce como resultado de una mutación del gen de la ribonucleoproteína 1 del mensajero del cromosoma X frágil ( FMR1 ) en el cromosoma X , más comúnmente un aumento en el número de repeticiones de trinucleótidos CGG en la región no traducida 5' de FMR1 . [14] [34] La mutación en ese sitio se encuentra en 1 de cada 2000 hombres y 1 de cada 259 mujeres . La incidencia del trastorno en sí es de aproximadamente 1 de cada 3600 hombres y 1 de cada 4000–6000 mujeres. [43] Aunque esto representa más del 98% de los casos, el SXF también puede ocurrir como resultado de mutaciones puntuales que afectan a FMR1 . [14] [34]
En individuos no afectados, el gen FMR1 contiene de 5 a 44 repeticiones de la secuencia CGG, más comúnmente 29 o 30 repeticiones. [14] [34] [44] Entre 45 y 54 repeticiones se considera una "zona gris", con un alelo de premutación generalmente considerado entre 55 y 200 repeticiones de longitud. Los individuos con síndrome del cromosoma X frágil tienen una mutación completa del alelo FMR1 , con más de 200 repeticiones CGG. [11] [44] [45] En estos individuos con una expansión de repeticiones mayor a 200, hay metilación de la expansión de repeticiones CGG y del promotor FMR1 , lo que lleva al silenciamiento del gen FMR1 y a la falta de su producto.
Se cree que esta metilación de FMR1 en la banda cromosómica Xq27.3 produce una constricción del cromosoma X, que en ese punto parece "frágil" al microscopio, un fenómeno que dio nombre al síndrome. Un estudio descubrió que el silenciamiento de FMR1 está mediado por el ARNm de FMR1. El ARNm de FMR1 contiene el tracto de repetición CGG transcrito como parte de la región no traducida 5', que se hibrida con la porción complementaria de repetición CGG del gen FMR1 para formar un dúplex ARN·ADN. [46]
Se ha descubierto que un subconjunto de personas con discapacidad intelectual y síntomas similares al síndrome del cromosoma X frágil presenta mutaciones puntuales en FMR1. Este subconjunto carecía de la expansión de repeticiones CGG en FMR1, tradicionalmente asociada con el síndrome del cromosoma X frágil. [47] La primera secuencia completa de ADN de la expansión de repeticiones en una persona con la mutación completa fue generada por científicos en 2012 utilizando la secuenciación SMRT . [48]
El síndrome del cromosoma X frágil se ha considerado tradicionalmente una afección dominante ligada al cromosoma X con expresividad variable y posiblemente penetrancia reducida . [12] La probabilidad de transmisión depende del sexo de los padres, el cromosoma X que porta la mutación y el número de repeticiones CGG en la premutación.
Debido a la anticipación genética y la inactivación del cromosoma X en las mujeres, la herencia del síndrome del cromosoma X frágil no sigue el patrón habitual de herencia dominante ligada al cromosoma X, y los investigadores del Centro Médico de la Universidad de Chicago y del Hospital Universitario de Groningen han publicado un resumen en el American Journal of Medical Genetics que propone dejar de etiquetar los trastornos ligados al cromosoma X como dominantes o recesivos. [49] Los varones con una mutación completa suelen verse afectados y ser infértiles, mientras que las mujeres portadoras tienen un 50 % de posibilidades de transmitir la mutación.
Antes de que se descubriera el gen FMR1 , el análisis de los pedigríes mostraba la presencia de portadores masculinos que eran asintomáticos y cuyos nietos se veían afectados por la enfermedad en mayor proporción que sus hermanos, lo que sugiere que se estaba produciendo una anticipación genética . [14] Esta tendencia de que las generaciones futuras se vieran afectadas con mayor frecuencia se conoció como la paradoja de Sherman después de su descripción en 1985. [14] [50] Debido a esto, los niños varones a menudo tienen un mayor grado de síntomas que sus madres. [51]
La explicación de este fenómeno es que los portadores masculinos transmiten su premutación a todas sus hijas, y la longitud de la repetición CGG de FMR1 normalmente no aumenta durante la meiosis , la división celular necesaria para producir esperma. [14] [34] Por cierto, los hombres con una mutación completa solo transmiten premutaciones a sus hijas. [34] Sin embargo, las mujeres con una mutación completa pueden transmitir esta mutación completa, por lo que teóricamente hay un 50% de posibilidades de que un niño se vea afectado. [34] [44] Además, la longitud de la repetición CGG con frecuencia aumenta durante la meiosis en las mujeres portadoras de premutación debido a la inestabilidad y, por lo tanto, dependiendo de la longitud de su premutación, pueden transmitir una mutación completa a sus hijos que luego se verán afectados. La expansión de repeticiones se considera una consecuencia del deslizamiento de la cadena durante la replicación del ADN o la síntesis de reparación del ADN . [52]
El mosaicismo se refiere a casos en los que los individuos tienen copias de mutación completa y de premutación. El mosaicismo puede ser resultado de la inestabilidad en las repeticiones CGG y los individuos afectados pueden mostrar síntomas clásicos, aunque algunas evidencias sugieren capacidades intelectuales superiores en comparación con aquellos con una mutación completa. [53] 1
La FMRP se encuentra en todo el cuerpo, pero en concentraciones más altas en el cerebro y los testículos. [11] [14] Parece ser el principal responsable de unirse selectivamente a alrededor del 4% del ARNm en los cerebros de los mamíferos y transportarlo fuera del núcleo celular y hacia las sinapsis de las neuronas . Se ha descubierto que la mayoría de estos objetivos de ARNm se encuentran en las dendritas de las neuronas, y el tejido cerebral de humanos con FXS y modelos de ratón muestra espinas dendríticas anormales , que son necesarias para aumentar el contacto con otras neuronas. Las anomalías posteriores en la formación y función de las sinapsis y el desarrollo de circuitos neuronales dan como resultado una neuroplasticidad deteriorada , una parte integral de la memoria y el aprendizaje. [11] [14] [54] Desde hace mucho tiempo se ha sospechado que los cambios en el conectoma están involucrados en la fisiopatología sensorial [55] y, más recientemente, se ha demostrado una variedad de alteraciones de los circuitos, que implican una conectividad local estructuralmente aumentada y una conectividad de largo alcance funcionalmente disminuida. [56]
Además, el FMRP se ha visto implicado en varias vías de señalización que están siendo objeto de una serie de fármacos en fase de ensayos clínicos. La vía del receptor de glutamato metabotrópico del grupo 1 (mGluR), que incluye mGluR1 y mGluR5 , está implicada en la depresión a largo plazo (LTD) y la potenciación a largo plazo (LTP) dependientes de mGluR, ambos mecanismos importantes en el aprendizaje. [11] [14] La falta de FMRP, que reprime la producción de ARNm y, por tanto, la síntesis de proteínas, conduce a una LTD exagerada. El FMRP también parece afectar a las vías de la dopamina en la corteza prefrontal, lo que se cree que da lugar al déficit de atención, la hiperactividad y los problemas de control de impulsos asociados al SXF. [11] [14] [29] La regulación negativa de las vías del GABA , que cumplen una función inhibidora y están implicadas en el aprendizaje y la memoria, puede ser un factor en los síntomas de ansiedad que se observan comúnmente en el SXF. [ cita requerida ]
Las investigaciones realizadas en un modelo murino de FSX muestran que las neuronas corticales reciben una información sensorial reducida (hiposensibilidad), contrariamente a la suposición común de que estas neuronas son hipersensibles, acompañada de una información contextual mejorada, acumulada a partir de experiencias previas. Por lo tanto, estos resultados sugieren que el fenotipo hipersensible de los individuos afectados podría surgir de una información contextual no coincidente que llega a estas neuronas. [57]
El diagnóstico clínico se basa en la identificación de una variante de FMR1 asociada con una disminución de la función junto con un deterioro intelectual de moderado a grave, en particular en los hombres o moderado en las mujeres. Las pruebas de diagnóstico incluyen PCR para analizar el número de repeticiones CGG, análisis Southern blot y examen de trinucleótidos AGG en la región del gen FMR1.
El análisis citogenético del síndrome del cromosoma X frágil se realizó por primera vez a fines de la década de 1970, cuando el diagnóstico del síndrome y el estado de portador se podían determinar cultivando células en un medio deficiente en folato y luego evaluando los " sitios frágiles " (discontinuidad de la tinción en la región de la repetición del trinucleótido) en el brazo largo del cromosoma X. [58] Sin embargo, esta técnica resultó poco confiable, ya que el sitio frágil a menudo se veía en menos del 40% de las células de un individuo. Esto no era un problema tan grande en los hombres, pero en las mujeres portadoras, donde el sitio frágil generalmente solo se podía ver en el 10% de las células, la mutación a menudo no se podía visualizar. [ cita requerida ]
Desde la década de 1990, se han utilizado técnicas moleculares más sensibles para determinar el estado de portador. [58] La anomalía del cromosoma X frágil ahora se determina directamente mediante el análisis del número de repeticiones CGG utilizando la reacción en cadena de la polimerasa (PCR) y el estado de metilación mediante el análisis Southern blot . [12] Al determinar el número de repeticiones CGG en el cromosoma X, este método permite una evaluación más precisa del riesgo de los portadores de premutación en términos de su propio riesgo de síndromes asociados al cromosoma X frágil, así como su riesgo de tener hijos afectados. Debido a que este método solo prueba la expansión de la repetición CGG, las personas con FXS debido a mutaciones sin sentido o deleciones que involucran FMR1 no serán diagnosticadas utilizando esta prueba y, por lo tanto, deben someterse a la secuenciación del gen FMR1 si existe sospecha clínica de FXS. [ cita requerida ]
Las pruebas prenatales con muestreo de vellosidades coriónicas o amniocentesis permiten diagnosticar la mutación FMR1 mientras el feto está en el útero y parecen ser confiables. [12]
El diagnóstico precoz del síndrome del cromosoma X frágil o de la condición de portador es importante para proporcionar una intervención temprana en niños o fetos con el síndrome y permitir el asesoramiento genético con respecto a la posibilidad de que los futuros hijos de una pareja se vean afectados. La mayoría de los padres notan retrasos en las habilidades del habla y del lenguaje, dificultades en los dominios sociales y emocionales, así como niveles de sensibilidad en determinadas situaciones con sus hijos. [59]
No existe cura para los defectos subyacentes del síndrome del cromosoma X frágil. [2] El tratamiento del síndrome del cromosoma X frágil puede incluir terapia del habla , terapia conductual , terapia ocupacional , educación especial o planes educativos individualizados y, cuando sea necesario, tratamiento de anomalías físicas. A las personas con antecedentes familiares del síndrome del cromosoma X frágil se les recomienda buscar asesoramiento genético para evaluar la probabilidad de tener hijos afectados y la gravedad de las deficiencias en los descendientes afectados. [60]
Las tendencias actuales en el tratamiento del trastorno incluyen medicamentos para tratamientos basados en los síntomas que apuntan a minimizar las características secundarias asociadas con el trastorno. Si a una persona se le diagnostica SXF, el asesoramiento genético para realizar pruebas a los miembros de la familia en riesgo de ser portadores de la mutación completa o la premutación es un primer paso fundamental. Debido a una mayor prevalencia del SXF en los niños, los medicamentos más utilizados son estimulantes que se dirigen a la hiperactividad, la impulsividad y los problemas de atención. [12] Para los trastornos comórbidos con SXF, se utilizan antidepresivos como los inhibidores selectivos de la recaptación de serotonina (ISRS) para tratar la ansiedad subyacente, las conductas obsesivo-compulsivas y los trastornos del estado de ánimo. Después de los antidepresivos, se utilizan antipsicóticos como la risperidona y la quetiapina para tratar las altas tasas de conductas autolesivas, agresivas y aberrantes en esta población (Bailey Jr et al., 2012). Los anticonvulsivos son otro conjunto de tratamientos farmacológicos utilizados para controlar las convulsiones , así como los cambios de humor en el 13%–18% de las personas con SXF. Los medicamentos dirigidos a los mGluR5 (receptores de glutamato metabotrópicos) que están vinculados con la plasticidad sináptica son especialmente beneficiosos para los síntomas específicos del SXF. [12] El litio también se está utilizando actualmente en ensayos clínicos con humanos, mostrando mejoras significativas en el funcionamiento conductual, el comportamiento adaptativo y la memoria verbal. Pocos estudios sugirieron el uso de ácido fólico, pero se necesitan más investigaciones debido a la baja calidad de esa evidencia. [61] Junto con los tratamientos farmacológicos, las influencias ambientales como el entorno del hogar y las habilidades de los padres, así como las intervenciones conductuales como la terapia del habla, la integración sensorial, etc., se combinan para promover el funcionamiento adaptativo de las personas con SXF. [60] Si bien la metformina puede reducir el peso corporal en personas con síndrome del cromosoma X frágil, no se sabe con certeza si mejora los síntomas neurológicos o psiquiátricos. [62]
El tratamiento farmacológico actual se centra en el manejo de los problemas de conducta y los síntomas psiquiátricos asociados con el síndrome del X frágil. Sin embargo, como se han realizado muy pocas investigaciones en esta población específica, la evidencia que respalda el uso de estos medicamentos en personas con síndrome del X frágil es deficiente. [63]
El TDAH , que afecta a la mayoría de los niños y al 30% de las niñas con SXF, se trata con frecuencia con estimulantes . [11] Sin embargo, el uso de estimulantes en la población del síndrome del cromosoma X frágil se asocia con una mayor frecuencia de eventos adversos que incluyen mayor ansiedad, irritabilidad y labilidad del estado de ánimo. [29] La ansiedad, así como los síntomas del estado de ánimo y obsesivo-compulsivos, pueden tratarse con ISRS , aunque estos también pueden agravar la hiperactividad y causar un comportamiento desinhibido. [12] [29] Los antipsicóticos atípicos se pueden utilizar para estabilizar el estado de ánimo y controlar la agresión, especialmente en aquellos con TEA comórbido. Sin embargo, se requiere monitoreo de efectos secundarios metabólicos que incluyen aumento de peso y diabetes, así como trastornos del movimiento relacionados con efectos secundarios extrapiramidales como discinesia tardía . Las personas con trastorno convulsivo coexistente pueden requerir tratamiento con anticonvulsivos .
Una revisión de 2013 afirmó que la esperanza de vida para el síndrome del X frágil era 12 años menor que la de la población general y que las causas de muerte eran similares a las encontradas para la población general. [64]
El síndrome del cromosoma X frágil es el trastorno del neurodesarrollo humano más "traducido" en estudio. Por lo tanto, la investigación sobre la etiología del SXF ha dado lugar a muchos intentos de descubrimiento de fármacos. [65] La mayor comprensión de los mecanismos moleculares de la enfermedad en el SXF ha llevado al desarrollo de terapias dirigidas a las vías afectadas. La evidencia de los modelos de ratón muestra que los antagonistas (bloqueadores) de mGluR5 pueden rescatar anomalías de las espinas dendríticas y convulsiones, así como problemas cognitivos y conductuales, y pueden mostrarse prometedores en el tratamiento del SXF. [11] [66] [67] Dos nuevos fármacos, AFQ-056 ( mavoglurant ) y dipraglurant , así como el fármaco reutilizado fenobam , se están sometiendo actualmente a ensayos en humanos para el tratamiento del SXF. [11] [68] También hay evidencia temprana de la eficacia del arbaclofeno , un agonista de GABA B , para mejorar el aislamiento social en personas con SXF y TEA. [11] [22] Además, existen evidencias provenientes de modelos de ratón de que la minociclina , un antibiótico utilizado para el tratamiento del acné , rescata anomalías de las dendritas. Un ensayo abierto en humanos ha mostrado resultados prometedores, aunque actualmente no existen evidencias provenientes de ensayos controlados que respalden su uso. [11]
En 1943, el neurólogo británico James Purdon Martin y la genetista británica Julia Bell describieron un árbol genealógico de discapacidad intelectual ligada al cromosoma X, sin tener en cuenta el macroorquidismo (testículos de mayor tamaño). [69] En 1969, Herbert Lubs detectó por primera vez un "cromosoma X marcador" inusual asociado con la discapacidad intelectual. [70] En 1970, Frederick Hecht acuñó el término "sitio frágil". Y, en 1985, Felix F. de la Cruz describió extensamente las características físicas, psicológicas y citogenéticas de quienes padecen esta afección, además de las perspectivas de terapia. [71] Su continua defensa de la causa le valió un honor a través de la Fundación de Investigación FRAXA en diciembre de 1998. [72]